慢性阻塞性肺疾病、肺炎和肺癌患者血清HMGB1水平及临床意义
崔正森,李 菡,姜宝珍,张志红
高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种重要的非组蛋白染色体结合蛋白之一,广泛存在于真核细胞核中。Wang et al[1]发现HMGB1为一种重要的炎症介质,可以释放到胞外并介导炎症反应;HMGB1作为细胞因子广泛参与炎症反应[2],与诱导炎症反应、细胞分化、细胞迁移、细胞增殖与凋亡等密切相关。HMGB1在多种人类肿瘤组织中高表达,与多种肿瘤的发生、浸润、转移等生物学行为关系密切,其在肺癌的发生及发展中亦有重要作用[3]。肺癌是人类最常见的恶性肿瘤之一,其发病率和死亡率近年均呈上升趋势,5年生存率仅10%~15%。该研究通过分析肺炎、慢性阻塞性肺疾病急性加重期(acute exacerbation chronic obstructive pulmonary disease,AECOPD)以及肺癌患者与健康对照者血清中HMGB1水平之间的差异,探讨HMGB1在呼吸系统炎症性疾病及肺癌中的可能作用。
1 材料与方法
1.1 研究对象 选取2012年11月~2013年3月在我院呼吸内科住院的AECOPD患者40例,肺炎患者40例,非小细胞肺癌(non-small cell lung cancer,NSCLC)患者30例及同期健康对照者30例。AECOPD、肺炎、肺癌等疾病诊断标准分别参照中华医学会呼吸病学分会慢性阻塞性肺疾病诊治指南、社区获得性肺炎诊断和治疗指南、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)NSCLC诊断治疗指南等执行,其中30例肺癌患者根据NCCN NSCLC诊断治疗指南进行临床分期(Ⅰ期4例,Ⅱ期6例,Ⅲ期11例,IV期9例)。研究对象均排除糖尿病、高血压病、结缔组织病、其他肿瘤性疾病等。其中 AECOPD组男22例,女18例;年龄52~81(61.4±5.2)岁;病程5~30(16.5±5.8)年。肺炎组男20例,女20例;年龄27~78(58.4±4.6)岁;肺癌组男17例,女13例;年龄46~76(62.2±7.5)岁。另选30例体检中心健康志愿者为对照组,其中男16例,女14例;年龄40~69(56.7±7.6)岁。AECOPD、肺炎、肺癌组与对照组在性别比例、年龄上差异无统计学意义(P>0.05)。
1.2 主要仪器 白细胞(white blood cell,WBC)计数使用LH-750血液分析仪(beckman coulter,美国)测定;C-反应蛋白(C reactive protein,CRP)浓度使用Image特定蛋白分析仪(Beckman Coulter,美国)测定;血清肺癌标志物如癌胚抗原(carcinoma embry-onic antigen,CEA)、细胞角质蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)使用美国罗氏化学分析仪测定。
1.3 标本采集及实验方法 研究对象均未接受任何治疗,入组时即抽取肘静脉血2 ml,3 h内于3 000 r/min离心20 min,离心后收集血清,分装后-80℃冰箱冻存用于HMGB1浓度的测定。血清HMGB1测定采用酶联免疫吸附法(ELISA),HMGB1 ELISA试剂盒为美国R&D公司产品,购自合肥志宏生物有限公司。
1.4 统计学处理 应用SPSS 20.0软件进行统计学分析,计量资料以±s表示。组间比较采用t检验。相关性分析采用Pearson相关性分析法。
2 结果
2.1AECOPD 患者血清中 HMGB1、CRP、WBC水平 AECOPD组患者血清HMGB1、CRP、WBC水平均明显高于对照组,差异有统计学意义(P<0.01),见表1。
表1 AECOPD组临床和实验室资料比较(±s)
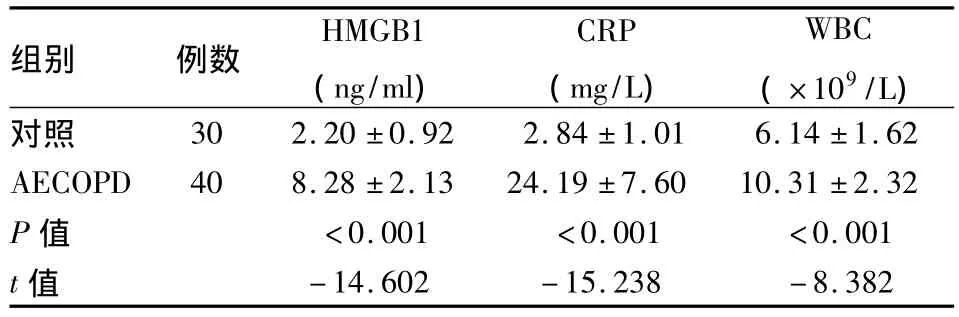
表1 AECOPD组临床和实验室资料比较(±s)
?
2.2 肺炎患者血清中HMGB1、CRP、WBC水平肺炎组患者血清HMGB1、CRP、WBC水平均明显高于对照组,差异有统计学意义(P<0.01),见表2。
表2 肺炎组临床和实验室资料比较(±s)

表2 肺炎组临床和实验室资料比较(±s)
?
2.3 肺癌患者血清HMGB1、肿瘤标志物水平 肺腺癌组患者血清HMGB1、CEA水平均明显高于对照组,差异有统计学意义(P<0.01),见表3;肺鳞癌组患者血清HMGB1、CYFRA21-1水平均明显高于对照组,差异有统计学意义(P<0.01),见表4;不同分期肺癌患者血清HMGB1水平比较:Ⅳ期明显高于Ⅲ期(P <0.01)、Ⅲ期明显高于Ⅱ期(P <0.01)、Ⅱ期明显高于Ⅰ期(P<0.01),差异均有统计学意义,见图1。
表3 肺腺癌组临床和实验室资料比较(±s)

表3 肺腺癌组临床和实验室资料比较(±s)
?
表4 肺鳞癌组临床和实验室资料比较(±s)

表4 肺鳞癌组临床和实验室资料比较(±s)
?

图1 不同分期肺癌患者血清HMGB-1水平比较
2.4 相关性分析 Pearson相关性分析显示,在AECOPD组,患者血清HMGB1水平与CRP、WBC均呈正相关(r=0.490,P=0.001;r=0.413,P=0.008);在肺炎组,患者血清HMGB1水平与CRP、WBC均呈正相关(r=0.500,P=0.001;r=0.465,P=0.002);在肺腺癌组,患者血清HMGB1水平与CEA水平呈正相关(r=0.607,P=0.036);在肺鳞癌组,患者血清HMGB1水平与CYFRA21-1亦呈正相关(r=0.607,P=0.008)。
3 讨论
HMGB由Johns在20世纪60年代发现,因其分子量小、在聚丙烯酰胺凝胶电泳中的高迁移能力而得名,HMG家族有3个成员即 HMGB1、HMGB2、HMGB3。其中HMGB1广泛分布于淋巴组织、脑、肝、肺、心、脾、肾等组织细胞中,是含量最多的HMG蛋白,其从受损的或坏死的细胞内被动分泌,从被刺激的单核细胞或巨噬细胞内主动分泌;细胞外的HMGB1通过与其受体结合刺激其他细胞产生适当的生物学效应。
文献[4-5]报道HMGB1在脓毒症、内毒素血症、肿瘤、自身免疫性疾病等疾病的发病机制中可能发挥重要的作用。近来研究[6]显示血清HMGB1变化参与了COPD的发生发展,是COPD急性加重的炎症机制之一。Yoshinori et al[7]发现肺炎患者的血清HMGB1浓度明显高于普通流感患者。本研究显示,AECOPD及肺炎患者血清HMGB1水平显著高于正常者;CRP水平和WBC计数是反映机体炎症严重程度的常用实验室指标,AECOPD及肺炎患者血清HMGB1与 CRP及 WBC呈正相关,说明血清HMGB1亦可能参与了COPD及肺炎的发生发展,是AECOPD及肺炎发生的炎症机制之一;HMGB1在AECOPD及肺炎患者的血液中均高度表达,容易检测,HMGB1是一种重要的晚期炎症介质,且较肿瘤坏死因子(TNF)、白介素1(IL-1)等早期速发型炎性介质具有更重要的临床意义。
目前研究[8]显示,HMGB1还参与多种肿瘤以及自身免疫性疾病等多种病理状态的发病机制。新近研究[9]显示HMGB1在多种肿瘤组织中表达增加,其水平在NSCLC、胃癌、结肠癌、乳腺癌、前列腺癌中明显升高,并且对评估肿瘤浸润深度、淋巴结转移、大小及预后提供重要价值;肿瘤的大小、转移情况、临床分期等是影响恶性肿瘤患者预后的主要因素[10]。肺癌是常见的恶性肿瘤之一,其严重威胁人类生命健康,尤其是NSCLC,中晚期内科治疗效果差,死亡率居高不下,其浸润性生长和转移是主要原因,肿瘤的浸润转移与多种蛋白的表达有关。Schraml et al[11]通过在肺癌中研究 HMGB1 的配体晚期糖基化终末产物受体,报道在肺癌中HMGB1存在高表达,指出HMGB1在肺癌发生中起着主要作用。
本研究结果显示NSCLC的患者血清中HMGB1表达水平比健康对照者显著增加,同时对肿瘤不同分期标本血清HMGB1水平进行检测,结果显示肺癌患者血清HMGB1水平与临床病理特征的关系密切,血清HMGB1水平在Ⅲ期和Ⅳ期NSCLC中明显高于I期和Ⅱ期,提示HMGB1在肺癌的发展、浸润及转移中有可能起着重要的作用。HMGB1水平与肺癌肿瘤标志物水平在NSCLC中的表达具有正相关,联合检测可作为临床NSCLC早期辅助诊断、判断预后的依据。由于本研究中研究样本量相对较少,对于其临床应用价值需要通过扩大样本量进一步研究。
总之,HMGB1在AECOPD、肺炎以及肺癌患者血液中水平均有明显升高,提示HMGB1在肺部炎症性疾病和肺癌中有重要临床意义,能否成为治疗这些疾病的靶点,还需大量的研究。
[1]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-51.
[2]Grasser M,Lentz A,Lichota J,et al.The arabidopsis genome encodes strutturally and functionally diverse HMGB-type proteins[J].J Mol Biol,2006,358(3):654 -64.
[3]Ellerman J E,Brown C K,de Vera M,et al.Masquerader:high mobility group box-1 and cancer[J].Clin Cancer Res,2007,13(10):2836-48.
[4]Chen G,Ward M F,Sama A E,et al.Extracellular HMGB1 as a proinflammatory cytokine[J].J Interferon Cytokine Res,2004,24(6):329-33.
[5]Shang G H,Jia C Q,Tian H,et al.Serum high mobility group box protein-1 as a clinical marker for non-small cell lung cancer[J].Respir Med,2009,103(12):1949 -53.
[6]Weitzenblum E,Chaouat A,Canuet M,et al.Pulmonary hypertension in chronic obstructive pulmonary disease and interstitial lung diseases[J].Semin Respir Crit Care Med,2009,30(4):458 -70.
[7]Yoshinori Ito,Yuka Torii,Rieko Ohta,et al.Increased levels of cytokines and high-mobility group box 1 are associated with the development of severe pneumonia,but not acute encephalopathy,in 2009 H1N1 influenza-infected children[J].Cytokine,2011,56(2):180-7.
[8]Raucci A,Palumbo R,Bianchi M E,et al.HMGB1:A signal of necrosis[J].Autoimmunity,2007,40(4):285 -9.
[9]Chung H W,Lee S G,Kim H,et al.Serum high mobility group box-1(HMGB1)is closely associated with the clinical and pathologic features of gastric cancer[J].J Transl Med,2009,7:38.
[10]Gnanasekar M,Thirugnanam S,Ramaswamy K.Short hairpin RNA(shRNA)constructstargeting high mobility group box-1(HMGB1)expression leads to inhibition of prostate cancer cell survival and apoptosis[J].Int J Oncol,2009,34(2):425 - 31.
[11]Schraml P,Bendik I,Ludwig C U.Differential messenger RNA and protein expression of the receptor for advanced glycosylated end products in normal lung and non-small cell lung carcinoma[J].Cancer Res,1997,57(17):3669 -71.

