氯肟衍生物对记忆障碍模型动物空间学习记忆障碍改善作用及其机制研究
于潇冰,王 琴,杨克凡,范丽霞,张在军,王玉强,陶 亮
(1.中山大学中山医学院药理学教研室,广东广州 510080;2.暨南大学药学院新药研究所,广东 广州 510632)
阿尔采末病(Alzheimer′s disease,AD)是一种以老年斑(SPs)、神经元纤维缠结(NFTs)以及脑淀粉样血管病变(CAA)为特征性病理改变的神经退行性疾病,其典型临床表现为渐进性且不可逆转的记忆丢失、认知障碍等精神症状[1]。SPs与CAA均由聚集态Aβ蛋白在胞外沉积所形成,而NFTs则由神经元胞内过度磷酸化的微管结合蛋白tau聚合形成[2-3]。AD发生时,β淀粉样蛋白在细胞外异常沉积并引发一系列的细胞级联反应,包括神经元兴奋性毒性、钙稳态的破坏、自由基产生、神经炎症、tau蛋白高度磷酸化等,直接或间接地作用在神经元和神经胶质细胞,从而最终导致神经元功能异常或数量减少,引发一系列精神症状[4-5]。这一“β淀粉样蛋白级联假说”是目前公认的AD病理机制之一。在Aβ蛋白引起的级联反应的下游,tau蛋白的代谢异常是引起神经元功能退化乃至凋亡的一个重要原因[6]。因此,抑制Aβ级联反应中的关键环节已成为AD药物开发中的重点。AD的病理表现(包括SPs、NFTs、CAA)提示,该神经退行性病变可能与蛋白质的异常折叠和聚集有关,而作为参与细胞中蛋白质折叠的主要因子,热休克蛋白家族(HSPs)在AD发生、发展中的作用逐渐受到人们的重视,不少研究者提出将热休克蛋白作为AD治疗的潜在靶点。研究发现,某些氯肟衍生物能选择性增强病理状态的热休克蛋白活性,而对正常热休克蛋白无影响。TCO-2是由暨南大学药学院将中药川穹嗪(TMP)连接到小分子氯肟衍生物arimoclomol上得到的一种新型氯肟衍生物(化学结构见Fig 1)。我们的前期试验表明,TCO-2在应激细胞模型中,能清除泛素化蛋白(ubiqitination)的聚集,逆转神经细胞损伤,活性优于arimoclomol,表明该化合物有可能成为治疗AD的新型药物。本研究在东莨菪碱致记忆获得性障碍小鼠模型和侧脑室注射Aβ1-42所致记忆障碍大鼠模型中,研究了TCO-2和arimoclomol对痴呆动物空间学习记忆障碍的改善作用,并对其机制进行了初步探讨。
1 材料与方法
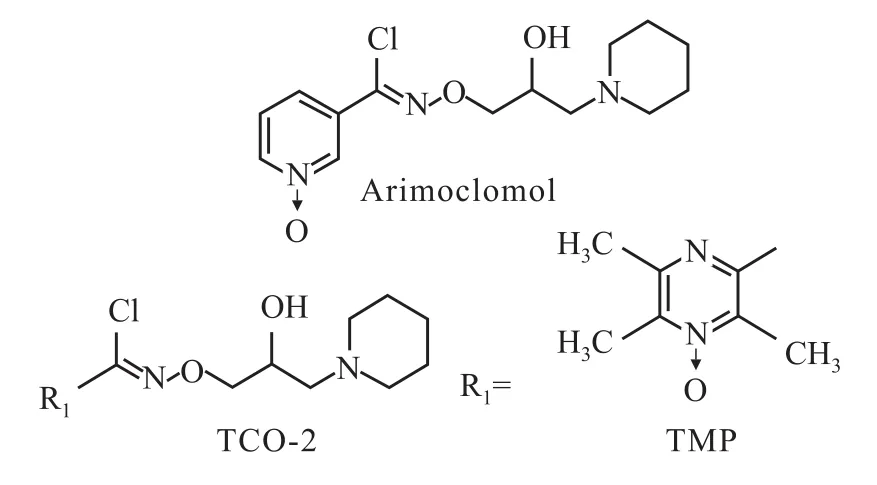
Fig 1 Chem ical structures of chloro-oxime derivatives
1.1 试剂与仪器 Aβ1-42购自 Sigma公司;氢溴酸东莨菪碱购自Sigma公司;arimoclomol及TCO-2由暨南大学药学院提供;多奈哌齐由国内某知名药企提供;β淀粉样蛋白1-42(Aβ1-42)ELISA试剂盒购自深圳菲优生物有限公司;乙酰胆碱酯酶试剂盒购自南京建成生物工程研究所;phpspho-tau(Ser202)抗体购自武汉博士德公司;phpspho-tau(Ser396)抗体购自美国Abcam公司;HRP标记的山羊抗鼠二抗、山羊抗兔二抗、ECL-plus化学发光剂、DC蛋白定量试剂盒购自美国Bio-Rad公司。Morris水迷宫测试系统购自淮北正华生物仪器设备有限公司;大鼠脑立体定位仪(NARISHIGE SN-3型)购自日本成茂公司;酶标仪购自美国Biotek公司;微量进样器(规格5μl)购自上海高鸽工贸有限公司;凝胶成像系统购自美国GE公司。
1.2 动物与分组 健康♂成年昆明小鼠40只,体质量(20±2)g;健康♂成年 SD大鼠40只,体质量(200±20)g,均由南方医科大学实验动物中心提供,SPF级,许可证号SCXK(粤)2011-0015。两种动物均随机分为正常组、模型组、阳性药对照组(多奈哌齐)、arimoclomol组和TCO-2组,每组8只。多奈哌齐组采取灌胃给药方式,其余各组采用腹腔注射给药。多奈哌齐、arimoclomol、TCO-2均用生理盐水溶解。给药剂量分别为:多奈哌齐3 mg·kg-1、arimoclomol 10 mg·kg-1、TCO-2 10 mg·kg-1,正常组与模型组腹腔注射给予相应剂量的药物溶剂(生理盐水),给药容量为 1 ml·(100 g)-1体重,每日 1次,共给药8 d。
1.3 造模药物的配制 氢溴酸东莨菪碱由无菌生理盐水配制,储存液浓度为0.2 g·L-1,现用现配。Aβ1-42由无菌生理盐水配制,储存浓度为2 mg·L-1,37℃恒温箱孵育4 d,-20℃冰箱保存,切忌反复冻融。
1.4 痴呆动物模型的建立 东莨菪碱痴呆模型的建立:于给药d 5开始进行学习记忆训练,实验共进行5 d,东莨菪碱模型组、待测药组和多奈哌齐对照组分别在训练前20 min腹腔注射东莨菪碱(2 mg·kg-1)造成记忆障碍模型,对照组小鼠注射相应剂量生理盐水。侧脑室注射Aβ1-42痴呆模型的建立:大鼠腹腔注射10%水合氯醛麻醉(4 ml·kg-1),将麻醉的大鼠固定于大鼠脑立体定位仪上,定位参照George Paxinos和CharlesWatson合著的第5版大鼠脑立体定位图谱,定位方法:前囟向后1.08 mm、中线旁开2.50 mm、硬脑膜下3.70 mm,采用微量进样器每只大鼠注射5μl配制好的 Aβ1-42,注射应缓慢,注射完留针10 min以保证其充分弥散,后缓慢撤针,缝合消毒。
1.5 M orris水迷宫实验 实验方法参照文献[7],并作适当修改。时间共进行5 d,前4 d为定位航行实验,连续4 d观察和记录实验动物寻找并爬上平台所需的时间,检测小鼠学习获得能力。d 5进行空间搜索实验,撤去平台,记录动物第1次经过原平台位置的时间(潜伏期)、穿越原平台位置的次数,检测动物空间记忆能力。以潜伏期和穿越平台次数作为评价指标,检测药物对痴呆模型小鼠学习记忆的改善作用。
1.6 乙酰胆碱酯酶活性的测定 Morris水迷宫测试结束后,腹腔注射10%水合氯醛4 ml·kg-1将动物麻醉,并以冰冷生理盐水快速进行心脏灌流,直至肝脏及虹膜颜色变白。迅速将动物断头、取出大脑、分离海马。按所取出海马的重量加9倍重量的生理盐水,制备脑组织匀浆,1 000×g离心20 min,取上清液置于-20℃冰箱保存。根据南京建成生物工程研究所提供的乙酰胆碱酯酶活性测试盒的说明书,测定乙酰胆碱酯酶活性,用考马斯亮蓝法进行蛋白定量。
1.7 侧脑室注射痴呆模型大鼠海马组织Aβ1-42蛋白含量测定 按上述方法取出海马,并按所取出海马的重量加9倍重量的蛋白裂解液制备脑组织匀浆,1 000×g离心20 min,取上清液置于-20℃冰箱保存。根据深圳菲优生物有限公司提供的Aβ1-42ELISA试剂盒的说明书测定海马组织Aβ1-42的蛋白含量。
1.8 侧脑室注射痴呆模型大鼠海马组织磷酸化tau蛋白的免疫印迹 将“1.7”中海马组织匀浆经1 000×g离心20 min,取上清液以DC蛋白定量试剂盒进行蛋白定量。将含20μg蛋白的样品90℃水浴5 min变性,经SDS-PAGE电泳(8%分离胶)分离后,电转印至硝酸纤维素膜上。脱脂奶粉封闭,分别加入 phpspho-tau(Ser202)一抗(1∶400),phpsphotau(Ser396)一抗(1∶2 000),4℃孵育过夜。TBST洗膜后加入HRP标记的二抗(1∶1 000),室温孵育30 min,洗膜后用增强型化学发光底物(ECL)显影,曝光。使用Bio Imaging system(Gene Genius)对胶片进行灰度扫描分析。以β-actin为内参对照,蛋白表达强度以 phpspho-tau(Ser202)、phpspho-tau(Ser396)蛋白表达灰度值与β-actin灰度值比值表示。
1.9 数据的分析与统计 采用Sigma Plot10.0统计软件对结果进行分析,所有数值均采用表示,水迷宫试验中的逃避潜伏期和游泳距离均采用重复测量的方差分析;组间比较采用单因素方差分析和t检验。
2 结果
2.1 定位航行实验 定位航行实验结果见Tab 1、2。各组实验动物找到平台时间(潜伏期)均随着训练进行而逐渐缩短。与对照组相比,模型组从d 3开始潜伏期明显延长(P<0.05)。而给予阳性药物Donepezil以及实验药物 Arimoclomol、TCO-2后,由东莨菪碱以及Aβ1-42造成的空间学习记忆障碍均得到改善,各实验组动物的潜伏期明显缩短,与模型组比较差异有统计学意义(P<0.05)。
Tab 1 Escape latency of Kunm ing m ice treated by scopolam ine
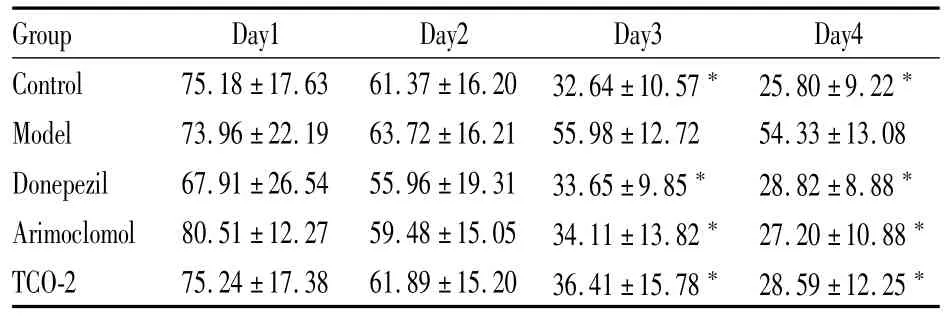
Tab 1 Escape latency of Kunm ing m ice treated by scopolam ine
*P<0.05 vs modelgroup
Group Day1 Day2 Day3 Day4 Control 75.18±17.63 61.37±16.20 32.64±10.57*25.80±9.22*Model 73.96±22.19 63.72±16.21 55.98±12.72 54.33±13.08 Donepezil 67.91±26.54 55.96±19.31 33.65±9.85* 28.82±8.88*Arimoclomol 80.51±12.27 59.48±15.05 34.11±13.82*27.20±10.88*TCO-2 75.24±17.38 61.89±15.20 36.41±15.78*28.59±12.25*
Tab 2 Escape latency of SD rats treated by Aβ1-4
*P<0.05 vs modelgroup
Group Day1 Day2 Day3 Day4 Control 83.96±8.80 65.93±17.47 46.00±21.21*35.26±20.01*Model 83.63±12.30 80.55±11.16 79.42±13.38 71.93±20.58 Donepezil 79.23±11.87 64.83±20.91 54.40±23.15*46.41±21.25*Arimoclomol 81.42±8.14 61.76±22.83 48.59±21.25*37.99±16.78*TCO-2 79.11±11.11 63.71±23.37 44.36±20.86*33.47±16.95*
2.2 空间搜索实验 空间搜索实验结果见Tab 3、4。各组动物之间的游泳速度差异没有统计学意义(P>0.05),排除了动物体力差异对空间学习记忆能力的影响。与对照组相比,模型组动物到达平台位置时间(潜伏期)明显延长,穿越平台次数明显减少,差异有统计学意义(P<0.05)。而各给药组动物潜伏期缩短,穿越平台次数增加,与模型组相比差异有统计学意义(P<0.05)。在东莨菪碱模型小鼠试验中,各给药组与对照组相比,穿越平台次数仍然较少,差异存在统计学意义(P<0.05)。
2.3 乙酰胆碱酯酶活性测定 Tab 5、6显示,注射东莨菪碱及Aβ1-42模型动物海马组织匀浆中AChE活性与对照组相比明显升高(P<0.05);而给予Donepezil、Arimoclomol和 TCO-2后,模型动物海马组织AChE活性明显降低,与模型组相比,差异有统计学意义(P<0.05)。
Tab 3 Results of spatial probe test on Kunm ingm ice treated by scopolam ine
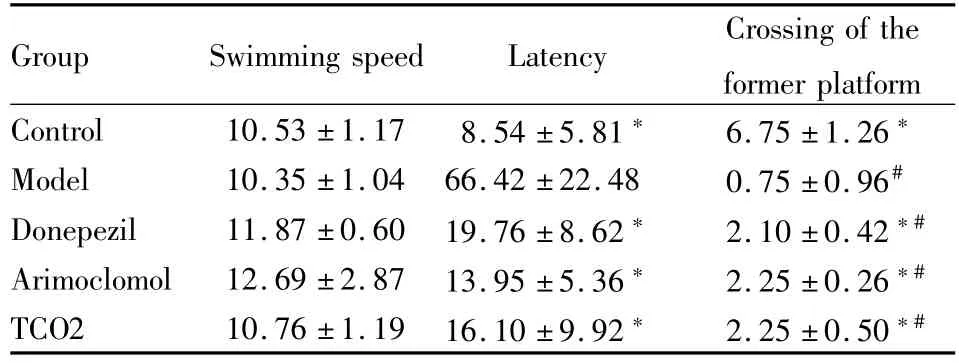
Tab 3 Results of spatial probe test on Kunm ingm ice treated by scopolam ine
*P<0.05 vs model group;#P<0.05 vs control group
Group Swimming speed Latency Crossing of the former platform Control 10.53±1.17 8.54±5.81* 6.75±1.26*Model 10.35±1.04 66.42±22.48 0.75±0.96#Donepezil 11.87±0.60 19.76±8.62* 2.10±0.42*#Arimoclomol 12.69±2.87 13.95±5.36* 2.25±0.26*#TCO2 10.76±1.19 16.10±9.92* 2.25±0.50*#
Tab 4 Results of spatial probe test on SD rats treated by Aβ1-42
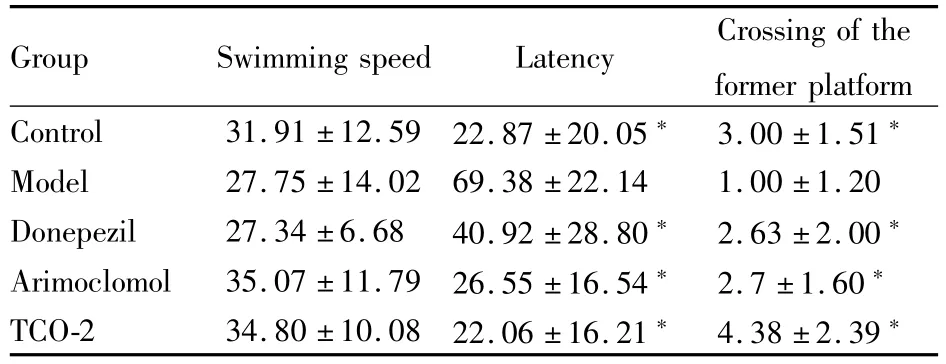
Tab 4 Results of spatial probe test on SD rats treated by Aβ1-42
*P<0.05 vs model group
Group Swimming speed Latency Crossing of the former platform Control 31.91±12.59 22.87±20.05*3.00±1.51*Model 27.75±14.02 69.38±22.14 1.00±1.20 Donepezil 27.34±6.68 40.92±28.80*2.63±2.00*Arimoclomol 35.07±11.79 26.55±16.54*2.7±1.60*TCO-2 34.80±10.08 22.06±16.21*4.38±2.39*
Tab 5 Acetyl cholinesterase activity of Kunm ing m ice treated by scopolam ine

Tab 5 Acetyl cholinesterase activity of Kunm ing m ice treated by scopolam ine
*P<0.05 vs model group
Group Acetyl cholinesterase activity/kU·g-1Pro Control 0.63±0.15*Model 1.41±0.31 Donepezil 0.72±0.14*Arimoclomol 0.88±0.19*TCO-2 0.77±0.09*
Tab 6 Acetyl cholinesterase activity of SD rats treated by Aβ1-42
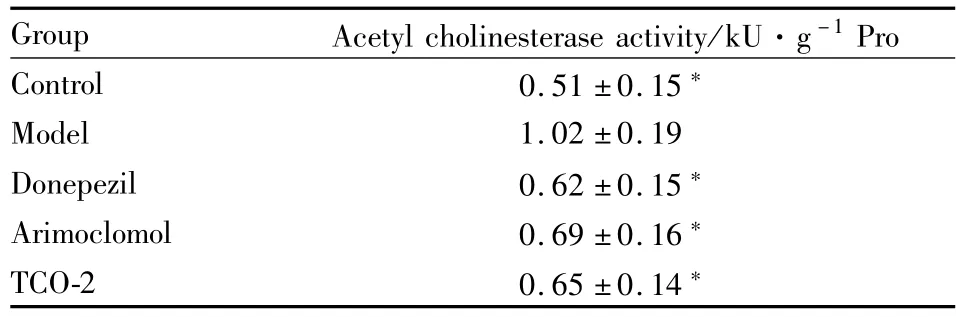
Tab 6 Acetyl cholinesterase activity of SD rats treated by Aβ1-42
*P<0.05 vs model group
Group Acetyl cholinesterase activity/kU·g-1Pro Control 0.51±0.15*Model 1.02±0.19 Donepezil 0.62±0.15*Arimoclomol 0.69±0.16*TCO-2 0.65±0.14*
2.4 侧脑室注射 Aβ1-42模型动物海马组织 Aβ1-42蛋白含量测定 Tab 7结果显示,经侧脑室注射凝聚态 Aβ1-42后,海马组织匀浆中 Aβ1-42含量明显增加,与对照组相比差异有统计学意义(P<0.05);给予试验药物arimoclomol以及TCO-2之后,海马组织中Aβ1-42含量降低,与模型组和Donepezil组相比,差异均有统计学意义(P<0.05);给予 Donepezil后,海马组织Aβ1-42含量与模型组相比,差异无显著性(P>0.05),而与对照组相比,差异存在统计学意义(P<0.05)。
Tab 7 Concentration of Aβ1-42 in hippocampus ofSD rats treated by Aβ1-42

Tab 7 Concentration of Aβ1-42 in hippocampus ofSD rats treated by Aβ1-42
*P<0.05 vs model group;#P<0.05 vs donepezil group
Group Concentration of Aβ1-42 in hippocampus/ng·L-1 Control 26.41±5.87*#Model 81.35±24.91 Donepezil 62.05±22.01 Arimoclomol 32.23±8.51*#TCO-2 32.72±4.56*#
2.5 侧脑室注射Aβ1-42模型动物海马组织中磷酸化tau蛋白含量测定 Fig 2、3免疫印迹结果显示,与对照组相比,经侧脑室注射凝聚态 Aβ1-42后,ptau(包括Ser202、Ser396)表达明显增加,差异有统计学意义(P<0.05);给予 arimoclomol后,p-tau(包括Ser202、Ser396)表达下降,与模型组相比差异有显著性(P<0.05),但p-tau(Ser202)表达与Donepezil组相比差异无统计学意义(P>0.05);给予TCO-2后,p-tau(Ser202)表达明显降低(P<0.05),而 ptau(Ser396)的表达并无明显变化(P>0.05);注射Donepezil对p-tau的表达没有影响。
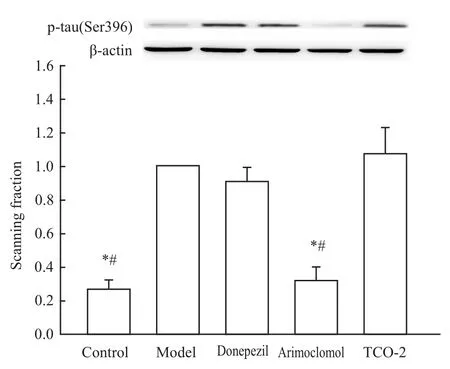
Fig 2 Expression of p-tau(Ser396)in hippocam pus of SD rats treated by Aβ1-42(n=3)*P<0.05 vs model group;#P<0.05 vs donepezil group
3 讨论
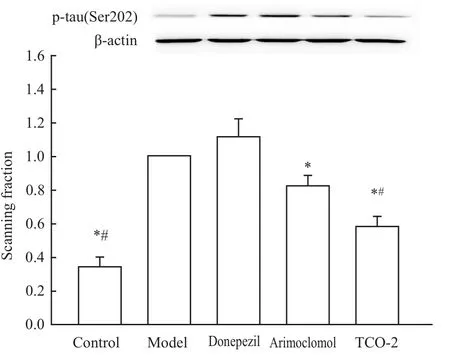
Fig 3 Expression of p-tau(Ser202)in hippocam pus of SD rats treated by Aβ1-42(n=3)*P<0.05 vs model group;#P<0.05 vs donepezil group
神经退行性疾病,如AD、帕金森综合症、脊髓侧索硬化综合症,又被称为“蛋白质错误折叠疾病”,其典型病理改变为神经系统中大量沉积的错误折叠的蛋白质。大量研究表明,HSPs对神经退行性疾病模型具有一定的神经保护作用,例如,过表达HSP70可以对抗Aβ介导的神经元毒性,近年来有研究表明[8-10],HSP70的这一神经保护机制可能与其对Aβ低聚物形成的抑制和Aβ蛋白胞吞降解途径的激活有关。也有证据显示,CHIP-HSC70复合体通过介导泛素与磷酸化tau蛋白的结合,从而达到清除可溶性磷酸化tau蛋白的作用[11]。因此,调节热休克蛋白表达的化合物有望成为治疗AD的新药。近年研究发现[12],某些氯肟(chloro-oxime)衍生物能选择性扩大病理状态HSP70活性,并对正常状态无明显影响,具有较好的临床疗效和安全性,有望成为临床治疗AD的药物。有研究表明[13],氯肟衍生物bimoclomol可恢复受损组织对乙酰胆碱的敏感性,这一现象与组织中大量HSP70的累积有关。而Gupta等[14]的研究表明,温度与化学物质诱发的HSP70表达明显升高都伴随着脑内乙酰胆碱酯酶(AChE)活性的明显抑制。我们的研究发现,氯肟衍生物可以明显抑制海马组织中AChE活性,这与以上研究结果相符。AD患者脑组织中神经递质乙酰胆碱的数量减少,东莨菪碱为M胆碱受体阻断剂,是乙酰胆碱的竞争性非选择性拮抗剂,能模拟乙酰胆碱分泌不足造成可逆的记忆障碍,常作为抗老年性痴呆药物研究的初筛模型[15-16]。Aβ蛋白具有神经毒性作用,可导致脑内胆碱能系统功能降低,促进tau蛋白异常磷酸化等。研究表明,侧脑室内单次或持续性注射Aβ蛋白能够引起学习记忆损害及认知功能障碍,并且能够多方面模拟AD病理特征,是一种较理想的抗痴呆药物研究模型[17]。
本实验采用了上述两种模型,观察了氯肟衍生物对痴呆动物学习记忆能力的影响。行为学结果显示,氯肟衍生物(包括小分子氯肟衍生物arimoclomol以及新型合成氯肟衍生物TCO-2)可改善痴呆模型动物的学习记忆障碍,明显缩短寻找平台潜伏期,增加穿越平台次数,显示出对AD模型有一定的防治作用。AD胆碱能假说认为,中枢胆碱能系统与学习记忆有密切关系,乙酰胆碱(ACh)由胆碱乙酰转移酶(ChAT)合成,AChE分解,中枢ACh含量下降以及AChE活性升高是AD的主要病理生化改变。而β淀粉样蛋白级联假说认为,β淀粉样肽(Aβ)才是AD发病的多种早期病理改变的促发因素。为了探讨氯肟衍生物改善痴呆动物学习记忆能力的机制,本实验根据两种痴呆模型建立的原理,分别对东莨菪碱模型小鼠海马组织进行AChE测定,以及对侧脑室注射Aβ1-42模型大鼠的海马组织进行AChE测定、Aβ1-42含量测定和磷酸化tau蛋白含量测定。结果显示,氯肟衍生物可以抑制脑内AChE活性,并且降低脑内Aβ1-42含量,还可以不同程度地降低脑内磷酸化tau蛋白表达。我们的试验结果显示,两种模型动物学习记忆的改善情况与AChE活性结果呈负相关;并且在侧脑室注射Aβ1-42所致的痴呆模型中,痴呆动物记忆改善的情况也与Aβ1-42含量以及磷酸化tau蛋白的表达量呈负相关。以上结果与AD的两种病理假说相符,而本试验的结果也提示氯肟衍生物可能具有多方面的药理作用,其增强痴呆动物的学习记忆能力的机制可能与抑制AChE合成,减少ACh分解,从而提高脑内ACh水平有关;并且该化合物也可能通过抑制模型大鼠脑组织Aβ1-42含量,降低tau蛋白磷酸化,稳定微管蛋白,从而改善大脑功能,促进学习记忆能力。此外,本研究发现,自主合成的新型氯肟衍生物TCO-2与arimoclomol对不同位点磷酸化的tau蛋白表达的影响存在差异。Western blot结果显示,TCO-2可以明显降低 p-tau(Ser202)的表达,而对 p-tau(Ser396)表达无影响;arimoclomol对 p-tau(Ser202)以及 p-tau(Ser396)的表达均有抑制作用。据 Wang等[18]研究发现,在体外实验中,细胞周期蛋白依赖性蛋白激酶5(cdk-5)可明显提高 tau蛋白 Ser199、Ser202、Thr205、Thr212、Thr231、Ser404位点的磷酸化,但不影响Ser396位点磷酸化。故本实验的结果提示,新型氯肟衍生物TCO-2可能与特异性地抑制cdk-5激酶信号通路,从而下调磷酸化tau蛋白的表达有关。尽管在本研究中,动物行为学结果、AChE活性以及Aβ1-42含量在 arimoclomol与 TCO-2两种化合物干预下差异并没有统计学意义,但是不同磷酸化tau蛋白表达的差异提示,这两种化合物可能通过诱导不同分子伴侣蛋白(包括sHSP、HSP70、HSP90等),从而抑制了不同影响tau蛋白磷酸化的激酶,但其更深层次的作用机制有待进一步研究。
参考文献:
[1] Selkoe D J.Themolecular pathology of Alzheimer′s disease[J].Neuron,1991,6(4):487-98.
[2] Glenner G G,Wong CW.Alzheimer′s disease:initial report of the purification and characterization of a novel cerebrovascular amyloid protein[J].Biochem BiophysResCommun,1984,120(3):885-90.
[3] Lee V M,Balin B J,Otvos L J,et al.A68:a major subunit of paired helical filaments and derivatized forms of normal Tau[J].Science,1991,251(4994):675-8.
[4] Hardy J,Selkoe D J.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353-6.
[5] Francis P T,Palmer A M,Sims N R,et al.Neurochemical studies of early-onset Alzheimer′s disease.Possible influence on treatment[J].N Engl JMed,1985,313(1):7-11.
[6] Roberson E D,Scearce-Levie K,Palop J J,et al.Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer′s disease mouse model[J].Science,2007,316(5825):750-4.
[7] 李爱萍,赵 慧,李 韶,等.不同鼠种在Morris水迷宫学习记忆行为中的种属差异[J].中国行为医学科学,2005,14(1):29-31.
[7] Li A P,Zhao H,LiS,etal.Species differencesofmuridae in the learning and memory behavior in morris water maze[J].Chin J Behavioral Med Sci,2005,14(1):29-31.
[8] Hoshino T,Murao N,Namba T,etal.Suppression of Alzheimer′s disease-related phenotypes by expression of heat shock protein 70 in mice[J].JNeurosci,2011,31(14):5225-34.
[9] Smith R C,Rosen K M,Pola R,et al.Stress proteins in Alzheimer′s disease[J].Int JHyperthermia,2005,21(5):421-31.
[10]Magrane J,Smith R C,Walsh K,et al.Heat shock protein 70 participates in the neuroprotective response to intracellularly expressed beta-amyloid in neurons[J].J Neurosci,2004,24(7):1700-6.
[11]Shimura H,Schwartz D,Gygi S P,et al.CHIP-Hsc70 complex ubiquitinates phosphorylated tau and enhances cell survival[J].J Biol Chem,2004,279(6):4869-76.
[12]Zhou Y,Vu K,Chen Y,et al.Chloro-oxime derivatives as novel smallmolecule chaperone amplifiers[J].Bio Org Med Chem Lett,2009,19(11):3128-35.
[13]Nanasi PP,Jednakovits A.Multilateralin vivoandin vitroprotective effects of the novel heat shock protein coinducer,bimoclomol:results of preclinical studies[J].Cardiovasc Drug Rev,2001,19(2):133-51.
[14]Gupta SC,Siddique H R,Saxena D K,etal.Hazardous effectof organophosphate compound,dichlorvos in transgenic Drosophila melanogaster(hsp70-lacZ):induction of hsp70,anti-oxidant enzymes and inhibition of acetylcholinesterase[J].Biochim Biophys Acta,2005,1725(1):81-92.
[15]李 斌,郭德玉,李 林.三种老年痴呆动物模型行为学比较[J].中国实验动物学报,1999,7(1):40-5.
[15]Li B,Guo D Y,Li L.Behavioral comparison among three animal modelsmimicking Alzheimer′s disease[J].Acta Laborat Anim Sci Sin,1999,7(1):40-5.
[16]朴景华,蒲小平,马 建,等.类叶升麻苷对东莨菪碱所致记忆获得性障碍的改善作用[J].中国药理学通报,2001,17(6):625-7.
[16]Piao JH,Pu X P,Ma J,et al.Effects of acetoside on improving the ability of learning and memory in mice[J].Chin Pharmacol Bull,2001,17(6):625-7.
[17]Yamada K,Nabeshima T.Animalmodels of Alzheimer′s disease and evaluation of anti-dementia drugs[J].Pharmacol Ther,2000,88(2):93-113.
[18]Wang JZ,Grundke-Iqbal I,Iqbal K.Kinases and phosphatases and tau sites involved in Alzheimer neurofibrillary degeneration[J].Eur JNeurosci,2007,25(1):59-68.