靶向乳腺癌耐药蛋白逆转肿瘤耐药:研究进展与药物开发
于存治,戚新明,任 进
(中国科学院上海药物研究所新药研究国家重点实验室、药物安全评价研究中心,上海 201203)
恶性肿瘤严重危害人类健康,化疗是肿瘤治疗的重要手段。但在化疗过程中人们也会面临许多问题,其中肿瘤耐药严重影响了化疗成功率。多药耐药(multidrug resistance,MDR)是经某一种药物诱发,导致肿瘤细胞对其它多种结构和作用机制完全不同的药物产生交叉耐药的现象。多种因素导致了肿瘤细胞对化疗药物交叉耐受,药物转运体介导的药物外排在其中起着重要的作用[1]。最初研究发现,参与MDR的药物转运体有P-糖蛋白(P-glycoprotein,ABCB1、P-gp)和多药耐药蛋白(multidrug resistance protein,ABCC、MRP)。1998年,Doyle等[2]在研究跨膜转运体在乳腺癌中的作用时发现一种新的ATP依赖的药物外排转运体。由于该蛋白是在一种乳腺癌细胞系中发现,研究人员将其命名为乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)。蛋白数据库分析发现,该基因是ABC(ATP binding cassette)转运体超家族中G亚家族的第二个成员,所以也称它为ABCG2。BCRP基因定位于人染色体4q22,编码1个含有655个氨基酸的72 ku的蛋白质。BCRP蛋白包括1个核酸结合区和6个跨膜区,而目前的研究发现大部分的功能性ABC转运体蛋白包括2个核酸结合区和12个跨膜区,所以现在一般认为BCRP通过形成寡聚物或者同源多聚物发挥功能。BCRP分布于正常的组织中,参与了多能干细胞生理功能维持、卟啉和亚铁血红素代谢、叶酸稳态维持和激素分泌等生理过程[3]。近期的研究表明,BCRP在阿尔采末症等疾病的发生过程中也发挥重要作用[4]。
BCRP作为一种外排性转运体介导了多种肿瘤的多药耐药性,将BCRP作为靶点进行药物开发是解决肿瘤多药耐药问题的一个重要方向,近年来该方面的研究引起了人们的高度关注,不断有新的成果发表。本文从BCRP表达调控、亚细胞定位、能量依赖、转运活性抑制等基础研究方面和针对BCRP的给药策略等临床应用方面总结了关于靶向BCRP逆转肿瘤耐药的最新研究进展,以期为本领域内的医药研究工作者提供重要参考。
1 关于BCRP基础研究的药物开发思路
蛋白发挥生物学功能包括转录翻译、细胞定位以及功能活性维持等多个环节,本文将从这些环节总结BCRP的最新研究进展。针对这些方面进行药物开发可以为逆转BCRP介导的肿瘤多药耐药提供新的方向与思路。
1.1 BCRP的表达调控 近年的研究发现,多种因子在转录水平、转录后水平影响了BCRP的表达(Tab 1),这些研究有助于更好地理解BCRP表达调控机制和在药物转运中的作用。
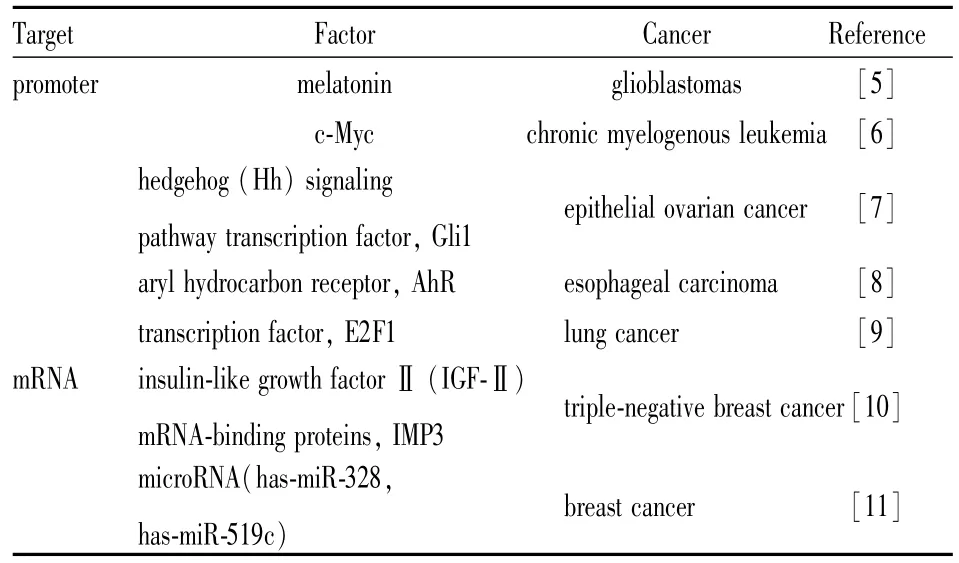
Tab 1 Factors regulating the expression of BCRP
1.1.1 BCRP表达的转录水平调控研究 BCRP的转录水平调控主要分为两类:(1)影响BCRP基因启动子区域的甲基化水平;(2)转录因子调控。研究[5]表明褪黑激素可以影响BCRP启动子的甲基化水平,即褪黑激素处理脑部肿瘤干细胞会引起BCRP启动子的甲基化水平增加,进而下调BCRP的表达,体外实验进一步证实,褪黑激素与化疗药物联合给药可以增强化疗药物的药效。
针对慢性粒细胞白血病的探究[6]发现原癌蛋白c-Myc可以作用于BCRP基因的启动子区进而促进其表达,该过程受BCRP启动子区的甲基化水平影响。与此类似,子宫癌[7]中“刺猬信号通路转录因子Gli1”(hedgehog signaling pathway transcription factor,Gli1)影响了 ABC转运体——BCRP、ABCB1的表达,抑制Gli1的表达可以下调BCRP和ABCB1表达量,进一步发现两个基因的启动子区均存在一段Gli1结合区;食管鳞状细胞癌[8]中,芳烃受体可以结合到BCRP启动子的外源物反应元件,从而促进BCRP表达上调。Rosenfeldt等[9]在最近发表的文章中提到,转录因子E2F1可以结合到BCRP启动子区,特异性地促进BCRP的表达,从而影响肿瘤药物耐受。上述研究提示我们针对BCRP转录水平的表达调控,有两种策略可以应用于逆转BCRP介导的肿瘤耐药:(1)针对BCRP启动子区域的甲基化水平调控,在临床上联合应用化疗药物与DNA甲基转移酶抑制剂(5-氮杂-2’-脱氧胞苷等)或者开发新的表观遗传学修饰小分子[12];(2)针对可以上调BCRP转录水平的转录因子,开发和应用相应的转录因子抑制剂,如c-myc抑制剂10058-F4等[13]。
1.1.2 BCRP表达的转录后水平调控 BCRP转录水平的调节机制日益清晰,近年来BCRP转录后调控的研究成为热点。BCRP转录后调控的研究主要包括RNA结合蛋白与BCRPmRNA的直接作用以及microRNA的作用等方面。Samanta等[10]在研究胰岛素生长因子mRNA结合蛋白3(insulin-like growth factorⅡ mRNA-binding proteins,IMP3)在三阴乳腺癌肿瘤耐药中的作用时发现,IMP3可以结合到BCRP mRNA上进而上调其表达。
作为近年来发现的最重要的转录后调控机制,多个microRNAs被发现可以在转录后调控BCRP的表达。miR-328和miRNA-519c均可以序列依赖性地结合到BCRPmRNA的3’非翻译区域,通过促进BCRPmRNA降解或翻译抑制的机制来下调BCRP蛋白表达[11]。
BCRP转录后水平的调控研究为我们揭示了两种逆转BCRP介导的肿瘤耐药的新策略:(1)针对近年研究热点RNA结合蛋白,寻找并开发与BCRPmRNA结合的RNA结合蛋白的小分子抑制剂;(2)寻找可以有效下调BCRP表达的microRNAs,加深对BCRP介导的肿瘤多药耐药机制的理解,而化学修饰合成microRNAs也是一种潜在并有效的肿瘤耐药对抗手段。
1.2 影响BCRP的亚细胞定位 作为一种膜蛋白,准确的亚细胞定位是BCRP功能发挥的前提。文献报道了多种分子可以影响BCRP的膜定位,3种PPARγ的激动剂(替米沙坦、吡格列酮、罗格列酮)在作用于PTEN/PI3K/Akt信号通路时也会影响BCRP的功能[14]:增加PTEN蛋白的表达可以抑制PI3K/Akt信号通路,同时也会导致BCRP从细胞膜上回到细胞质中,继而抑制其转运活性以逆转肿瘤耐药。MCF-7细胞中发现,CD147会上调BCRP的表达、影响BCRP的二聚化和细胞定位[15]。上述研究提示了一种新的靶向BCRP逆转肿瘤耐药的药物开发策略,即针对BCRP的亚细胞定位,寻找并开发新的小分子化合物,促使BCRP从细胞膜脱落至胞质或者改变其二聚体结构,抑制其表达或转运活性,从而达到逆转肿瘤耐药的效果。
1.3 降低BCRP的能量供应 BCRP属于ABC转运体超家族,它参与转运需要ATP供能,在肿瘤细胞中ATP主要来源于糖酵解。Nakano等[16]研究了抑制糖酵解对BCRP功能发挥的影响,他们使用3-溴丙酮酸抑制肿瘤细胞糖酵解降低其ATP水平,结果发现3-溴丙酮酸可以明显提高肿瘤细胞中药物的蓄积。重症综合性免疫缺陷小鼠实验也证实3-溴丙酮酸与阿霉素共同作用可以抑制肿瘤的生长。
能量代谢紊乱是肿瘤细胞的常见特征,肿瘤细胞会增加糖酵解有关酶的表达、提高糖摄取和有氧糖酵解,产生大量ATP和细胞存活相关的因子,即瓦博格效应(Warburg效应),有氧糖酵解的增加是肿瘤细胞的重要的标志[17]。近年来,针对肿瘤细胞瓦博格效应的研究发现其与肿瘤耐药密切相关,因此,开发特异性针对肿瘤细胞的糖酵解抑制剂或调节剂也是解决肿瘤耐药问题的一种潜在的有效策略。
1.4 BCRP药物转运活性抑制 BCRP是一个跨膜蛋白,可以将米托蒽醌、甲氨蝶呤、拓扑替康、舒尼替尼等多种临床常用化疗药物从细胞内转运到细胞外,在肿瘤多药耐药中起到重要的作用。针对BCRP转运活性进行抑制剂或调节剂开发是近年来的研究热点(Tab 2)。多个实验室致力于寻找在功能水平影响BCRP转运活性的药物,以降低肿瘤细胞对药物的外排作用,提高胞内的药物蓄积,期望以联合用药的方式逆转BCRP介导的肿瘤多药耐药。
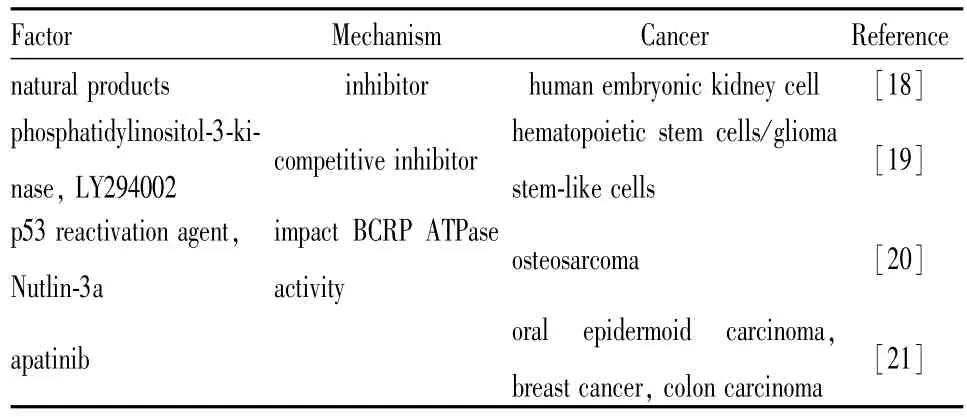
Tab 2 BCRP inhibitors
Tan等[18]运用基于细胞和微囊膜转运抑制分析方法研究了56种天然产物与BCRP之间的相互作用,结果显示黄连素、雷公藤红素、鞣花酸、柠檬苦素等对BCRP介导的药物转运具有明显的抑制作用。
PI3激酶(PI3K)抑制剂是临床常用的分子靶向治疗药物。Imai等[19]研究发现,PI3K激酶抑制剂LY294002可以竞争性地抑制BCRP转运活性。另外,该抑制剂也可以抑制另外两种参与肿瘤多药耐药产生的 ABC转运体(P-gp、MRP1)的功能。
作为p53激活剂,Nutlin-3a目前正在实体瘤和白血病模型中进行临床前研究。Nutlin-3a也可以通过影响BCRP ATPase活性来抑制BCRP功能,最终增加细胞内BCRP底物的蓄积[20]。针对阿帕替尼的研究[21]也发现了类似的实验现象:阿帕替尼作为一种小分子多靶点酪氨酸酶抑制剂可用于非小细胞肺癌和胃癌的治疗。实验人员发现,阿帕替尼在过表达ABCC1(P-gp)和BCRP的细胞中可以通过抑制药物转运体的ATPase活性逆转肿瘤耐药,有意思的是,他们发现阿帕替尼对于BCRP ATPase活性的影响具有双向性,即阿帕替尼在低浓度时可以提高ATPase活性,当阿帕替尼浓度高的时候会抑制BCRPATPase活性,但药物并不会影响BCRP等转运体的表达。
越来越多的实验研究表明,抑制肿瘤增殖或者细胞内重要的信号通路的药物会影响BCRP的转运活性,这些研究为靶向BCRP逆转肿瘤耐药的药物研究和开发提供了新的思路。
2 靶向BCRP的给药策略的研究进展
针对BCRP的表达调控、亚细胞定位、能量依赖和药物转运活性等方面的研究让我们在更好地理解BCRP的生理功能的同时,对BCRP介导的肿瘤耐药机制的认识也更加全面,这些研究必将为靶向BCRP药物开发提供新的理论支持。除了进行新型药物开发之外,选择和应用更好的临床给药策略(Tab 3)对指导临床用药也具有十分重要的意义。
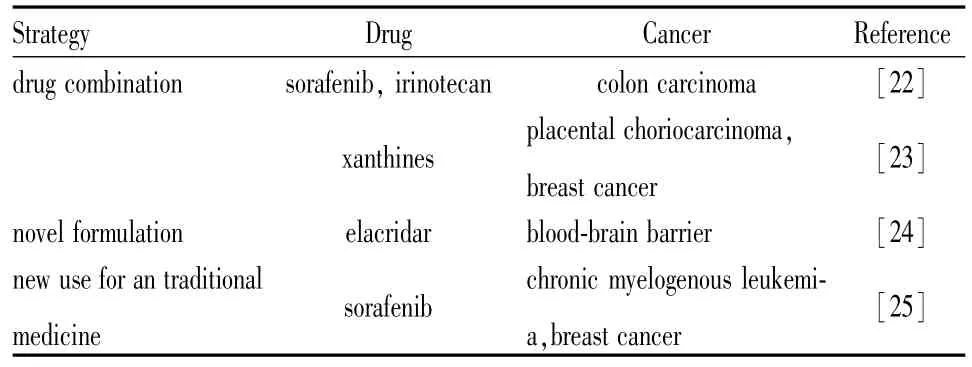
Tab 3 Research on clinicalmedication
2.1 联合用药 索拉非尼可以通过抑制BCRP转运活性,增加伊立替康的胞内蓄积,最终增强伊立替康的抗肿瘤效果[22]。Ding等[23]发现多种黄嘌呤类药物(咖啡因、茶碱、二羟丙茶碱)可以时间、剂量依赖地降低细胞内BCRP的表达,米托蒽醌与黄嘌呤类药物联合用药的效果明显优于米托蒽醌单独用药。
2.2 改变制剂的剂型 除了联合用药之外,改变药物制剂形式也是一种新的用药尝试。作为P-gp和BCRP的抑制剂,依克立达可用于提高脑部的药物分布,但溶解度低导致的口服生物利用度差等缺点严重限制了依克立达的作用效果。人们[24]尝试用微乳剂方法来提高依克立达的生物利用度,细胞实验证实依克立达微乳剂可以抑制P-gp和BCRP的功能。动物实验中,口服给药和腹腔注射给药结果进一步显示依克立达微乳剂可以明显升高药物在脑内的分布。
2.3 老药新用 BCRP作为一种药物转运体参与了肿瘤多药耐药。针对P-gp、MRP、BCRP等的研究发现了许多候选物,但是由于药物毒性、生物利用度等方面的问题,很多候选物并没有进入临床研究。索拉菲尼可以促进BCRP在溶酶体中降解,基于BCRP抑制剂的构效关系模型,研究人员发现并证实索拉非尼是一种良好的BCRP抑制剂[25]。在已上市的临床药物中寻找可能的BCRP抑制剂可以省略临床前药物毒理学和药代动力学等一系列评价,进而可大大缩短研发的时间和降低研发成本等,这种老药新用的药物开发策略已经越来越受到药物研发人员的重视。
3 结语
BCRP主要分布于如胎盘、乳腺导管、肠道、肝脏微管膜等具有分泌、排泄功能的细胞膜上,并参与干细胞功能维持、叶酸稳态、激素分泌、物质代谢等过程[3]。作为一种药物转运体,BCRP可以转运多种肿瘤药物,如米托蒽醌、甲氨蝶呤、拓扑替康、舒尼替尼等,所以BCRP是肿瘤多药耐药产生的重要因素。针对BCRP的研究让我们更好地了解它的生理功能和转运机制,同时也有助于更全面地认识BCRP介导的肿瘤耐药。文章对靶向BCRP逆转肿瘤耐药的不同方向研究进行了综述,这些研究也为针对BCRP进行药物开发提供理论技术支持和新的研究思路。新实验技术的出现、实验方法的不断完善、药理基因组学的发展等将更有助于对BCRP的生物结构、调节机制、作用原理等研究,这些研究的开展为将来的新药开发、临床用药提供更多理论依据。
参考文献:
[1] 袁 翔,程 昕,许元富,等.降低细胞膜角蛋白8和乳腺癌耐药蛋白的表达逆转耐药性[J].中国药理学通报,2009,25(11):1425-9.
[1] Yuan X,Cheng X,Xu Y F,et al.Reversalmulti-drug resistance by reducing the expression of CK8 and BCRP[J].Chin Pharmacol Bull,2009,25(11):1425-9.
[2] Doyle L A,Yang W,Abruzzo L V,et al.A multidrug resistance transporter from human MCF-7 breast cancer cells[J].Proc Natl Acad Sci USA,1998,95(26):15665-70.
[3] Natarajan K,Xie Y,Baer M R,et al.Role of breast cancer resistance protein(BCRP/ABCG2)in cancer drug resistance[J].Biochem Pharmacol,2012,83(8):1084-103.
[4] Abuznait A H,Kaddoumi A.Role of ABC transporters in the pathogenesis of Alzheimer′s disease[J].ACS Chem Neurosci,2012,3(11):820-31.
[5] Martin V,Sanchez-Sanchez A M,Herrera F,et al.Melatonin-induced methylation of the ABCG2/BCRP promoter as a novelmechanism to overcomemultidrug resistance in brain tumour stem cells[J].Br JCancer,2013,108(10):2005-12.
[6] Porro A,Iraci N,Soverini S,et al.c-MYC oncoprotein dictates transcriptional profiles of ATP-binding cassette transporter genes in chronic myelogenous leukemia CD34+hematopoietic progenitor cells[J].Mol Cancer Res,2011,9(8):1054-66.
[7] Chen Y,Bieber M M,Teng N N.Hedgehog signaling regulates drug sensitivity by targeting ABC transporters ABCB1 and ABCG2 in epithelial ovarian cancer[J].Mol Carcinog,2013,doi:10.1002/mc.22015.[Epub ahead of print]
[8] To K K,Yu L,Liu S,et al.Constitutive AhR activation leads to concomitant ABCG2-mediated multidrug resistance in cisplatin-re-sistant esophageal carcinoma cells[J].Mol Carcinog,2012,51(6):449-64.
[9] Rosenfeldt M T,Bell L A,Long JS,et al.E2F1 drives chemotherapeutic drug resistance via ABCG2[J].Oncogene,2013,doi:10.1038/onc.2013.470.[Epub ahead of print]
[10]Samanta S,Pursell B,Mercurio A M.IMP3 protein promotes chemoresistance in breast cancer cells by regulating breast cancer resistance protein(ABCG2)expression[J].JBiol Chem,2013,288(18):12569-73.
[11]Li X,Pan Y Z,Seigel G M,et al.Breast cancer resistance protein BCRP/ABCG2 regulatorymicroRNAs(hsa-miR-328,-519c and-520h)and their differential expression in stem-like ABCG2+cancer cells[J].Biochem Pharmacol,2011,81(6):783-92.
[12] Saito J,Hirota T,Furuta S,et al.Association between DNA methylation in themiR-328 5′-flanking region and inter-individual differences in miR-328 and BCRP expression in human placenta[J].PLoSOne,2013,8(8):e72906.
[13]Huang M J,Cheng Y C,Liu C R,et al.A small-molecule c-Myc inhibitor,10058-F4,induces cell-cycle arrest,apoptosis,and myeloid differentiation of human acutemyeloid leukemia[J].Exp Hematol,2006,34(11):1480-9.
[14]To K K,Tomlinson B.Targeting the ABCG2-overexpressingmultidrug resistant(MDR)cancer cells by PPARgamma agonists[J].Br JPharmacol,2013,170(5):1137-51.
[15]Zhou S,Liao L,Chen C,et al.CD147 mediates chemoresistance in breast cancer via ABCG2 by affecting its cellular localization and dimerization[J].Cancer Lett,2013,337(2):285-92.
[16]Nakano A,Tsuji D,Miki H,et al.Glycolysis inhibition inactivates ABC transporters to restore drug sensitivity inmalignant cells[J].PLoSOne,2011,6(11):e27222.
[17]Bensinger S J,Christofk H R.New aspects of the Warburg effect in cancer cell biology[J].Semin Cell Dev Biol,2012,23(4):352-61.
[18]Tan KW,Li Y,Paxton JW,et al.Identification of novel dietary phytochemicals inhibiting the efflux transporter breast cancer resistance protein(BCRP/ABCG2)[J].Food Chem,2013,138(4):2267-74.
[19]Imai Y,YamagishiH,Ono Y,etal.Versatile inhibitory effects of the flavonoid-derived PI3K/Akt inhibitor,LY294002,on ATP-binding cassette transporters that characterize stem cells[J].Clin Transl Med,2012,1(1):24.
[20]Zhang F,Throm SL,Murley L L,etal.MDM2 antagonistnutlin-3a reversesmitoxantrone resistance by inhibiting breast cancer resistance proteinmediated drug transport[J].Biochem Pharmacol,2011,82(1):24-34.
[21]Mi Y J,Liang Y J,Huang H B,et al.Apatinib(YN968D1)reversesmultidrug resistance by inhibiting the efflux function ofmultiple ATP-binding cassette transporters[J].Cancer Res,2010,70(20):7981-91.
[22]Mazard T,Causse A,Simony J,et al.Sorafenib overcomes Irinotecan resistance in colorectal cancer by inhibiting the ABCG2 drugefflux pump[J].Mol Cancer Ther,2013,12(10):2121-34.
[23]Ding R,Shi J,Pabon K,Scotto K W.Xanthines down-regulate the drug transporter ABCG2 and reversemultidrug resistance[J].Mol Pharmacol,2012,81(3):328-37.
[24]Sane R,MittapalliR K,ElmquistW F.Developmentand evaluation of a novelmicroemulsion formulation of elacridar to improve its bioavailability[J].JPharm Sci,2013,102(4):1343-54.
[25]Wei Y,Ma Y,Zhao Q,etal.New use for an old drug:inhibiting ABCG2 with sorafenib[J].Mol Cancer Ther,2012,11(8):1693-702.