壮筋续骨汤对骨折大鼠血清BMP-7和IGF-1水平的影响和意义
张继东 祝汉忠 纪晓军* 周 缜 汪贯习
(青岛大学医学院中西医结合中心,山东 青岛 266021)
壮筋续骨汤对骨折大鼠血清BMP-7和IGF-1水平的影响和意义
张继东 祝汉忠 纪晓军* 周 缜 汪贯习
(青岛大学医学院中西医结合中心,山东 青岛 266021)
目的研究壮筋续骨汤对大鼠股骨骨折后骨形态发生蛋白(BMP-7)和胰岛素样生长因子-1(IGF-1)血清水平的变化,探讨其促进骨折愈合的作用机制。方法成年健康雄性Wistar大鼠72只,用低速牙科钻在股骨中段切断股骨制备骨折模型,应用壮筋续骨汤水煎液干预治疗。X线观察骨折局部愈合情况,组织病理学观察骨痂结构,酶联免疫吸附试验检测血清BMP-7和IGF-1水平。结果大鼠骨折后7 d骨折断端主要为纤维肉芽组织,14 d为纤维-软骨性骨痂组织,21 d骨性骨痂增多,模型组与治疗组未见显著差异,28 d治疗组骨痂重塑质量明显优于模型组。大鼠术后7~21 d,治疗组和模型组血清BMP-7和IGF-1水平无显著性差异,术后28 d均显著降低(P<0.05),但治疗组明显高于模型组(P<0.05)。结论壮筋续骨汤可能通过降低内源性BMP-7和IGF-1降解,增强其活性,发挥促进骨折愈合的作用。
壮筋续骨汤;骨折;X线;BMP-7;IGF-1;大鼠
骨折创伤后机体细胞在分子水平的生物因子发生应激性改变[1],骨折端坏死骨细胞、成骨细胞以及被吸收的骨基质均向周围释放内源性生长因子[2],并随环境变化而调整影响骨折愈合进程[3]。在众多细胞因子中,骨形态发生蛋白(BMP-7)[4]和胰岛素样生长因子-1(IGF-1)的作用尤为突出[5]。现代医学以复位、固定、功能锻炼等治疗手段为主,祖国医学治疗骨折坚持动静结合(固定与功能活动结合)、筋骨并重(骨折愈合与功能恢复并进)、内外兼治(局部治疗与整体治疗兼顾)、医患配合(医疗措施与患者主观能动性配合)四大原则,疗效显著。传统中药治疗骨折有其独特的优势,有研究表明,大鼠股骨骨折后应用壮筋续骨汤干预治疗,可促进骨折愈合速度[6],但观察时间只有2周,未能全面反映骨折愈合的过程[7]。本实验试图进一步研究壮筋续骨汤促进骨折愈合的作用机制。
1 材料与方法
1.1 动物模型和分组
成年健康雄性Wistar大鼠72只,体质量230~250 g,清洁级,青岛市药物检验所动物中心提供。所有动物适应性饲养7 d,然后随机分为对照组、模型组、治疗组各24只。用10%水合氯醛(300 mg/kg)腹腔注射麻醉动物,俯卧位固定,常规消毒,无菌操作,取股外侧切口,经股前、外侧肌间隔分离至股骨,对照组动物不切断股骨,然后逐层缝合切口,喷洒青霉素注射液,无菌包扎。模型组和治疗组动物分离暴露股骨后,在股骨中段(大转子下1 cm)用低速牙科钻(JBXNE22,NSK Co.Ltd.Japan)切断股骨,然后行克氏针(直径1 mm,上海医用缝合针厂)髓腔逆行固定后逐层缝合,喷洒青霉素注射液,无菌包扎切口。术后即刻拍摄X线,后将动物放置笼中,每笼1只,单独饲养。
1.2 治疗方法
壮筋续骨汤配方根据清代赵濂《伤科大成》记载的壮筋续骨丹演化而来,由本院制剂室依据《医疗机构中药煎药室管理规范》制备。每副中药充分煎煮两次,使最终药液达到224 mL,含生药112 g,浓度0.5 g/mL。根据前期研究结果证实,每日1.25 g/kg较为理想[8]。本实验以1.25 g/kg定量喂养,每日1次,连续28 d。对照组和模型组同步给予等量的生理盐水。
1.3 评价指标
治疗后7、14、21、28 d,每组各取6只动物观察应用以下方法观察研究。①X线摄片:用10%水合氯醛(300 mg/kg)腹腔注射麻醉动物,X线摄片,观察骨痂结构和骨质密度改变,判断骨折愈合情况。②组织病理:颈椎脱臼处死动物,经腹主动脉取血4 mL(备用),完整取出股骨,剔除多余软组织,生理盐水洗涤,置4%多聚甲醛中固定24 h,蒸馏水浸泡4 h,再置于20%乙二胺四乙酸(EDTA)溶液脱钙15 d。然后截取骨折处上、下1 cm部位的组织(包括血肿、骨痂组织),常规梯度乙醇脱水,二甲苯透明,石蜡包埋,沿股骨纵轴连续切片,厚5 μm,贴于载玻片。苏木精-伊红(HE)染色观察骨痂组织结构。③酶联免疫吸附试验(ELISA):动物经腹主动脉取血4 mL,4000 r/min离心10 min,分离血清2 mL,-20 ℃保存。采用双抗夹心ELISA试剂盒(Blue Green公司)测定血清BMP-7和IGF-1水平。测定前室温复溶,再次离心取上清标本100μL,按试剂盒说明书操作,用酶标仪(Bio-Rad 550型,美国)在450 nm测定BMP-7和IGF-1的吸光度值,根据样品吸光度值在坐标上找出对应的BMP-7(pg/mL)和IGF-1(ng/L)浓度。
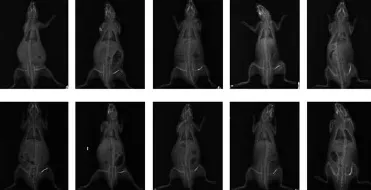
图1 大鼠骨折愈合的X线观察(A对照组,B骨折7 d,C骨折14 d,D骨折21 d,E骨折28 d,F模型组,G治疗7 d,H治疗14 d,I治疗21 d,J治疗28 d)
1.4 统计学处理
所有数据以(x¯±s)表示,用SPSS11.0统计软件处理。
2 结 果
2.1 X线观察
X线片示,对照组大鼠股骨骨皮质完整、连续(图1A),模型组大鼠骨折当天骨折线清晰,骨皮质连续性中断(图1F),骨折7 d(图1B)骨折断端被纤维性组织填充,但骨折线仍然明显;至14 d(图1C)纤维性骨痂开始形成,至21 d(图1D)有钙盐沉着,至28 d(图1E)骨性骨痂形成,骨小梁排列不规则。治疗组大鼠骨折后7~21 d(图1G、H、I),骨痂结构变化与模型组相应时间比较无明显差异,但至28 d治疗组骨痂结构(图1J)优于模型组(图1E),其皮质骨及髓腔可辨,成像清晰。
2.2 HE染色
对照组大鼠骨质结构正常(图2A),模型组大鼠在骨折当天骨折端断为血肿组织所填充(图2F),骨折后7 d(图2B)骨折断端炎性细胞浸润、纤维母细胞自骨膜下增生长入骨折间隙,形成纤维性肉芽组织,夹杂有少量的成骨细胞,治疗组与模型组无明显差异;至14 d(图2C)骨折端纤维性组织生长,成骨细胞数目增多,纤维性骨痂生成,并有少量软骨骨痂,治疗组与模型组无明显差异;至21 d(图2D)破骨细胞、成骨细胞活跃,可见骨重塑腔隙、散在骨小梁形成,至28 d(图2E)骨小梁清晰可见,排列规则,可见骨皮质及骨髓腔。治疗组骨架结构在7~21 d(图2G、H、I)与模型组相应时间比较无显著性差异,但至28 d治疗组骨细胞排列相对整齐清晰(图2J),显著优于骨折组(图2E)。
2.3 酶联免疫检测
①血清BMP-7水平:从时间方面比较,对照组大鼠血清BMP-7水平在术后7~28 d未见显著性变化(P>0.05)。模型组和治疗组大鼠血清BMP-7水平在术后7~21 d未见显著性变化(P>0.05),至28 d则显著下降(P<0.05)。组间比较:模型组和治疗组大鼠血清BMP-7水平在术后7~28 d各时间点均显著高于对照组(P<0.05);治疗组大鼠血清BMP7水平术后7~21 d与模型组相应时间点比较无显著性差异(P>0.05),但第28天仍显著高于模型组和对照组(P<0.05)。②血清IGF-1水平:对照组大鼠术后7、14、21、28 d血清IGF-1水平未见显著性变化(P>0.05)。模型组和治疗组大鼠血清IGF-1水平在术后7、14、21 d无显著性变化(P>0.05),在28 d显著下降(P<0.05),均显著高于对照组相应时间点的水平(P<0.05)。模型组和治疗组比较,血清IGF-1水平在术后7~21 d无明显差异(P>0.05),但术后28 d治疗组显著高于模型组(P<0.05)。

图2 大鼠骨折处骨痂的病理学观察,HE染色×200(A对照组,B骨折7 d,C骨折14 d,D骨折21 d,E骨折28 d,F模型组,G治疗7 d,H治疗14 d,I治疗21 d,J治疗28 d)
3 讨 论
骨折愈合是一个复杂的骨再生、修复过程,有多种细胞因子参与。Urist等[1]首先发现了BMP,并由此提出了“诱导成骨”理论。BMP-7具有强烈的诱骨活性,通过诱导间充质干细胞内转录因子Runx2和Osterix的表达,诱导间充质干细胞向成骨细胞分化,并协同其他调节因子参与骨组织的形成[4]。IGF-1是调节骨细胞功能和代谢的重要因子,能减少骨胶原退化、增加骨质沉积,促进成骨细胞分化、成熟及补充[8,9],并以剂量时间依赖性方式影响增生及功能代谢[10]。IGF-1与骨组织中的受体结合,发生受体自身磷酸化激活络氨酸蛋白酶,促使胰岛素受体底物磷酸化,从而调节软骨细胞、骨细胞的生长、增殖与代谢[11-13]。骨生长因子生物活性大,生理作用强,能加速骨折愈合[14],但是外源性细胞因子半衰期短,清除率高,不能持续有效地促进骨折愈合。中药治疗骨折除了解痉止痛、活血化瘀、去腐生肌等常规作用外,也直接或间接影响骨生长因子的分泌、降解和活性调节。研究显示[15],中药治疗骨折可通过提高外骨痂、联接骨痂、桥梁骨痂、矿化骨痂的体积密度,从而增加骨骼强度,使骨痂拉伸强度、弯曲强度、抗折力等力学性能明显增强。王力等实验结果[16]显示,用壮筋续骨汤体外培养骨细胞,S期细胞明显增多,能促进成骨细胞增殖,说明壮筋续骨汤能促进成骨细胞DNA的合成,通过促进成骨细胞增殖来实现加快骨折愈合的作用。王祥杰等[8]动物实验表明,壮筋续骨汤在骨折初期即能显著提高实验性大鼠血清BMP-7和NPY水平,促进实验性大鼠骨折愈合。本次实验结果显示壮筋续骨汤在骨折术后第1~3周内并未显著提高大鼠血清中BMP7和IGF-1水平,在21 d后能使骨生长因子继续保持较高水平,说明壮筋续骨汤并不能促进内源性骨生长因子分泌,只起到增强内源性因生物子活性、延长其半衰期、减缓内源性BMP-7和IGF-1降解,发挥促进骨折愈合的作用。
[1] Urist MR,Delange RJ,Finerman GA.Born cell differentiation and growth factors[J].Science,1983,220(4598):680-686.
[2] Croteau S,Ranch F.Bone morphogenetic proteins in orthopedics: from basic science to clinical Practice[J].Orthopedics,1999,22(7):686-695.
[3] Tatsuyama K,Maezawa Y.Expression of various growth factors for cell proliferation and cylodifferentiation[J].Eur J Histochem, 2000,44(3):269-278.
[4] Kwong FN,Hoyland JA.Altered relative expression of BMPs and BMP inhibitors in cartilaginous areas of human fractures progressing[J]. Orthop Res,2009,27(6):752-757.
[5] Raschke M,Wildeman B.Insulin-like growth factor 1 andtransforming growth factor-beat 1 accelerates osteotomy healing using implants[J].Bone,2002,30(1):144-151.
[6] Guo YL,Wang XJ.ZJXG Decoction promotes the expression of bone morphogenetic protein-7[J].J Trauma Treat,2012,1(1):1-4.
[7] Pan YX,Wang XJ.Zhuang Jin Xu Gu Decoction improves fracture healing in rats by augmenting the expression[J].J Dent Med Med Sci,2012,3(8):517-521.
[8] 王祥杰,潘月兴.壮筋续骨汤对大鼠骨折骨痂中骨形态发生蛋白-7和神经肽Y表达的影响[J].中华中医药杂志,2013,28(8):2420-2422.
[9] Kurland ES,Rosen CJ.Insulin-like growth factor-I in men with idiopathic osteoporosis[J].J Clin Endocrinol Metab,1997,82(2):279-286.
[10] 刘刚,胡蕴玉.胰岛素样生长因子-I对兔关节软骨细胞增殖及代谢的影响[J].中国修复重建外科杂志,2002,16(3):228-230.
[11] Schmidmaier G,Wildemann B.Long-term effects of local growth factor treatment on fracture healing[J].J Orthop Res,2004,22(3):514-519.
[12] Wildemann B,Bambad P.Local delivery of growth factors from coat titanium plates increases osteotomy healing[J].Bone,2004, 34(5):862-868.
[13] 王敏,辛海霞.胰岛素样生长因子对成骨细胞生长影响的实验研究[J].中国矫形外科杂志, 2004,12(3):236-238.
[14] Westerhuis IL,Van Bezooijen RL,Klcen P.Use of bone morphogenetic proteins in traumatology[J].Injury,2005,36(12):1405-1412.
[15] 黄佩军.壮筋续骨汤联合锁定加压钢板内固定治疗胫骨平台骨折疗效观察[J].内蒙古中医药,2012,31(14):20-21.
[16] 王力,涂宏.壮筋续骨汤含药血清体外培养大鼠成骨细胞的增殖[J].中国组织工程研究与临床康复,2011,15(37):6959-6962.
The Effect and Significance of ZJXG Decoction on the Serum Levels of BMP-7 and IGF-1 in Femur Fracture Rats
ZHANG Ji-dong, ZHU Han-zhong, JI Xiao-jun*, ZHOU Zhen, WANG Guan-xi
(Institute of Integrative Medicine, Qingdao University Medical College, Qingdao 266021, China)
ObjectiveTo investigate the effect of Zhuang Jin Xu Gu Decoction(ZJXG Decoction) on serum levels of bone morphogenetic protein-7(BMP-7)and insulin-like growth factor-1 (IGF-1)and to explore its promoting healing of femoral fracture in rats.MethodsFemur fractures were generated in 72 male adult Wistar rats by cutting femur transversely at middle point. ZJXG Decoction was administered orally after surgery for 7-28 d. The healing process was analyzed by X-ray and hematoxtlin-eosin(HE)staining in rats. The serum levels of BMP-7 and IGF-1 were detected by enzyme linked immunobsorbent assay(ELISA).ResultsX-ray imaging indicated that the fibrous callus tissue at the femoral fracture-end increased and the fracture line became fuzzy at 7-14 d following treatment with ZJXG Decoction. HE staining showed that the fibrous-granular tissue at the fracture-end changed gradually to fibrous, cartilaginous and osseous callus tissues. ELISA results showed that the serum levels of BMP-7 and IGF-1 increased significantly 28 days following treatment with ZJXG Decoction.ConclusionIt is concluded that ZJXG Decoction could enhance the fracture healing by reducing the decomposition of BMP-7 and IGF-1 and enhancing their activities.
ZJXG decoction; fracture; X-ray; BMP-7; IGF-1; rats
R683
B
1671-8194(2014)24-0008-03
*通讯作者

