OK 432优化的内皮细胞疫苗抗小鼠乳腺癌作用研究
徐茂磊,周 玲,杨小平
(滨州医学院药学院,山东烟台 264003)
抗血管生成疗法因其具有药物容易到达靶细胞,不易产生耐药性,抗瘤谱广泛,毒副作用小,以及与放化疗存在联合增效等优点,已经成为肿瘤临床治疗的研究热点。然而,传统的血管生成抑制剂多为蛋白多肽类药物或单克隆抗体,蛋白多肽类药物体内半衰期较短,需要频繁给药以维持药效,非人缘化的单克隆抗体应用时会出现人抗鼠抗体反应(human anti-mouse antibody reaction,HAMA reaction),这些缺点都严重限制了传统血管生成抑制剂抗肿瘤效应的发挥[1]。
近年来,随着免疫治疗技术的不断发展,以自体或异体的内皮细胞制备疫苗,利用主动免疫的方式诱导机体产生靶向肿瘤血管的免疫反应,杀伤肿瘤新生血管,显示了一定的抗肿瘤效果[2-5]。然而,临床实验证实,仅仅以内皮细胞作为抗原制备疫苗诱导的免疫应答强度有限,提示我们需要寻找合适的佐剂以提高现行内皮细胞疫苗的疗效[6]。
OK432是链球菌株(streptococcus pyogenes)Su株细胞壁成分的冻干制剂,具有免疫活性作用,可以有效激活DC、NK、抗原特异性的CTL和其它效应细胞[7]。此外,OK432刺激成熟的 DC可以通过CD40/CD40L相互作用促进Th1类杀伤性细胞因子的分泌,在肿瘤疫苗的制备中显示了良好的佐剂效应[8]。在我们前期研究中,以OK432为佐剂,人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为抗原制备得到了佐剂优化的HUVECs-OK432疫苗,该疫苗在B16F10黑色素瘤皮下移植瘤模型中显示了较强的抗肿瘤活性,并可以明显降低肿瘤血管的微密度[9-10]。在本研究中,我们拟以EAC乳腺癌作为考查模型,进一步考查HUVECs-OK432疫苗的抗肿瘤药效,并对相关的作用机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 动物和细胞株 ICR小鼠,♀,5~6周龄,由扬州大学比较医学中心提供,许可证号:SCXK(苏)2007-0001;HUVEC购于美国ATCC细胞库;小鼠EAC乳腺癌细胞株,购自中科院上海细胞所。
1.1.2 试剂 ECM内皮细胞专用培养基、内皮细胞生长因子ECGS,购自美国Sciencell公司;细胞培养用新生牛血清,购自杭州四季青生物工程材料研究所;DMEM培养基,Gibco公司产品;四甲基偶氮唑蓝盐(MTT)、刀豆蛋白(ConA)为 Sigma公司产品;羊抗小鼠IgG,购自武汉博士德生物工程有限公司;二甲基亚砜(DMSO)、台盼兰,购自上海生工生物工程技术服务有限公司;CytoTox96非放射性细胞毒性检测试剂盒,购自美国Promega公司;OK432,购自广州百济抗肿瘤药房;其他试剂均为市售。
1.2 方法
1.2.1 HUVECs-OK432疫苗的制备 用ECM内皮细胞专用培养基,5%CO2,37℃条件下培养 HUVEC,待HUVEC长到80%融合度时胰酶消化,收集HUVEC于离心管中,pH 7.2磷酸盐缓冲液洗涤3次,用0.9%生理盐水将细胞悬液稀释至5×1010·L-1。取1 ml细胞悬液溶解0.5 KE佐剂OK432,充分混合,即成HUVECs-OK432疫苗。另取1 ml HUVEC细胞悬液为HUVECs疫苗,用1 ml 0.9%生理盐水溶解0.5 KE OK432为OK432佐剂对照组。
1.2.2 抗肿瘤动物实验 32只4~5周龄的♀ICR小鼠适应实验室环境1周后,随机分为PBS对照组,OK432组,HUVECs组和HUVECs-OK432组,每组8只。免疫程序如下:于d 0、7、14、21于小鼠右肋皮下注射100μl各组疫苗,对照组注射等量的生理盐水。在第4次免疫后的1周,即d 28,在各组小鼠左肋皮下接种100μl浓度为5×109·L-1乳腺癌细胞悬液,于肿瘤接种后1周每两天测量1次肿瘤大小,肿瘤体积按照下列公式计算:V=0.52×长×宽2。肿瘤接种后d 14处死所有小鼠,剥取肿瘤拍照并称重[10]。
1.2.3 体液免疫反应检测-血清中抗体的 ELISA检测 采用间接ELISA法检测免疫血清中的特异性HUVEC抗体,用反复冻融裂解后的HUVEC细胞裂解物包被96孔ELISA板,1∶50倍稀释免疫血清,以HRP标记的羊抗小鼠IgG抗体(1∶10 000稀释)作为二抗,TMB显色,用酶标仪测量OD450nm吸光值。
1.2.4 细胞免疫反应检测—脾淋巴细胞增殖反应采用MTT法检测脾淋巴细胞增殖。无菌条件下取各组小鼠的脾脏,研磨成单细胞悬液,加红细胞裂解液裂解,调整细胞浓度为5×109·L-1,以100μl/孔加入到96孔细胞培养板中。各组的脾淋巴细胞分别加入空白培养基(阴性对照)、100 mg·L-1HUVEC裂解物,5 mg·L-1的 ConA(阳性对照),每个样品重复3次。继续培养72 h后每孔加入20μl噻唑蓝(MTT)溶液,培养4 h后吸去上清,每孔加入100μl二甲基亚砜(DMSO),用酶标仪测量OD570nm吸光值。
1.2.5 CTL实验 细胞毒性CTL测定采用乳酸脱氢酶(lactic dehydrogenase,LDH)法,选用 CytoTox96 Promega试剂盒检测,具体操作步骤按说明书进行。脾淋巴细胞制备方法同上,制备的脾淋巴细胞经相应的疫苗刺激后,作为效应细胞。实验组、靶细胞自发释放组、效应细胞自发释放组的OD值均需减去培养液背景OD值。靶细胞最大释放孔的OD值需要减去体积校正孔的OD值。杀伤率按下列公式计算:杀伤率/%=(实验组OD-效应细胞自发OD-靶细胞自发OD)/(靶细胞最大OD-靶细胞自发OD)×100%。
1.2.6 对血管生成作用的研究-皮内免疫模型 4-5周龄ICR小鼠12只,随机分成4组,分别为PBS对照组、OK432组,HUVECs组和 HUVECs-OK432免疫组,每组3只。按照前述预防性免疫方式进行4次免疫,第4次免疫结束后1周于小鼠腹部皮内接种EAC肿瘤细胞。在肿瘤细胞接种前1 d,将各组免疫后小鼠的腹部的毛用手术刀片刮去。调整EAC肿瘤细胞浓度到1×109·L-1,在小鼠腹部表皮和真皮之间注射肿瘤细胞悬液,每只小鼠选3个点注射,每个点注射50μl(每个点含5×104肿瘤细胞)。皮内接种肿瘤细胞后,每天观察肿瘤情况。当瘤块鼓起约5 mm大小时(约7 d左右),处死动物,小心剥离其腹部外层皮肤。在光学显微镜低倍镜下观察肿瘤块附近以及内部的血管分布,计数1 cm2区域内的所有微血管数,包括主血管和分支血管。
1.2.7 疫苗安全性考察 小鼠按前述预防性免疫程序免疫4次,第4次免疫1周后处死所有小鼠,无菌取各组小鼠心、肝、脾、肺、肾,10%的福尔马林液固定,石蜡包埋,4μm组织切片,常规HE染色,观察疫苗对脏器是否存在明显毒副作用(200×)。
2 实验结果
2.1 预防性动物实验结果 动物实验结果如Fig 1所示:与 PBS对照组相比,HUVECs(P<0.05)和HUVECs-OK432(P<0.05)免疫组小鼠的肿瘤生长速度明显减慢,且HUVECs-OK432组肿瘤的生长速度与HUVECs组相比也明显减慢(P<0.05)。接种肿瘤后3周,剖瘤,瘤重的结果与肿瘤生长情况相一致。HUVECs和 HUVECs-OK432组小鼠平均瘤重明显低于PBS组(P<0.05),且HUVECs-OK432组肿瘤的瘤重明显小于HUVECs组(P<0.05),PBS、OK432、HUVECs和HUVECs-OK432四组小鼠的瘤重分别为(2.77±0.41)g、(2.60±0.47)g、(1.56±0.31)g、(0.63±0.29)g。
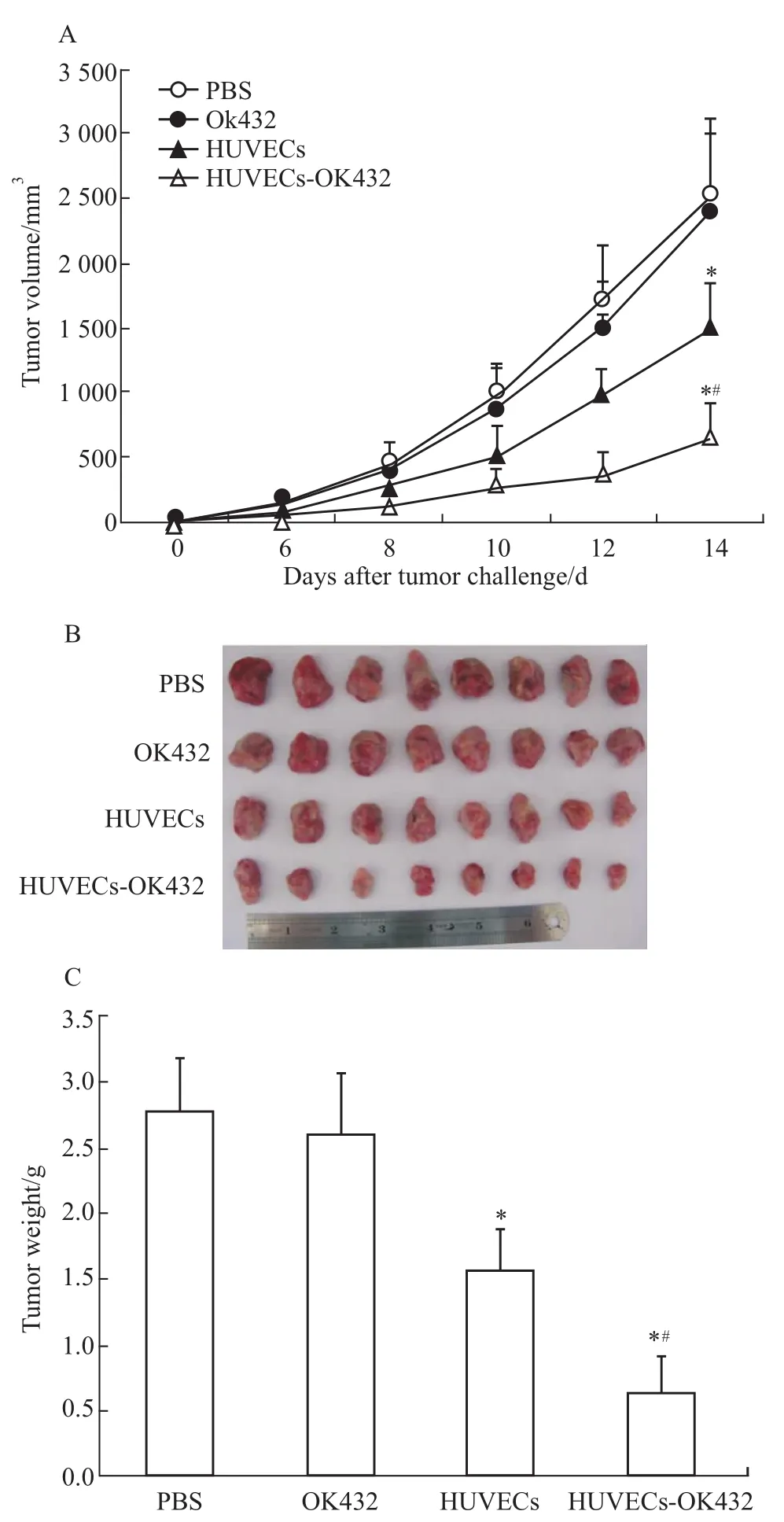
Fig 1 Prophylactic antitumor effect induced by HUVECs-OK 432 in subcutaneous EAC-bearing m iceA:In vivo measurement of tumor growth;B:Solid tumors excised from mice;C:Weight of tumors.*P<0.05 vs PBS;#P<0.05 vs HUVECs.
2.2 抗体检测 如Fig 2所示,HUVECs和HUVECs-OK432组免疫小鼠的血清中IgG抗体的水平随着免疫次数的增多逐渐升高,在第5周时接近顶峰,与PBS组相比较差异有显著性(P<0.05)。相比较HUVECs组,HUVECs-OK432组抗体水平也有明显提高(P<0.05),而单独的OK432免疫未能诱发小鼠体内产生可检测的抗体。上述结果表明,OK432作为佐剂能有效协助HUVECs诱发更强烈的体液免疫应答。
2.3 T淋巴细胞增殖反应 T淋巴细胞增殖实验结果表明(Fig 3),相比较PBS对照组,HUVECs和HUVECs-OK432组小鼠脾淋巴细胞能够对体外HUVECs抗原刺激产生增殖反应(P<0.05),其中,HUVECs-OK432组小鼠脾淋巴细胞对体外HUVECs抗原刺激的增殖活性最强,和HUVECs组相比较差异也有显著性(P<0.05),接近于阳性对照ConA对其的刺激作用。
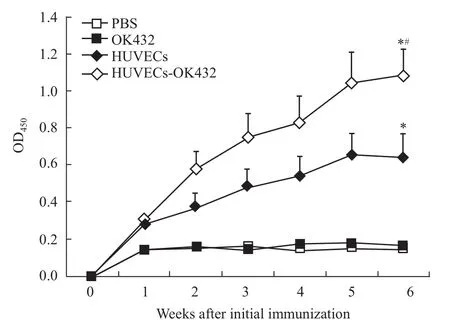
Fig 2 Characterization of anti-HUVEC antibodies*P<0.05 vs PBS;#P<0.05 vs HUVECs.
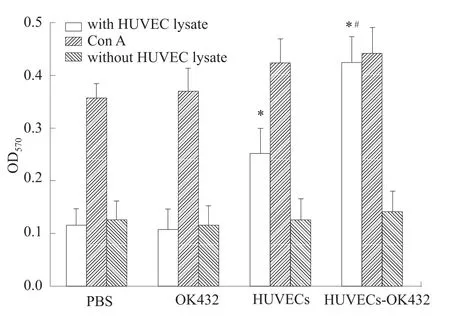
Fig 3 Effect of different vaccination on T lym phocytes proliferation*P<0.05 vs PBS;#P<0.05 vs HUVECs.
2.4 CTL实验 CTL实验结果如Fig 4所示,当靶细胞为HUVEC细胞时,HUVECs和HUVECs-OK432免疫组均能引起较强的CTL反应,并且随着效靶比的增大,效应细胞对靶细胞的杀伤力也增大。相比较HUVECs免疫组,HUVECs-OK432组效应细胞对靶细胞的杀伤能力更强(Fig 4A),而进一步的实验显示,所有免疫组小鼠的脾细胞均对EAC肿瘤细胞没有杀伤功能(Fig 4B)。以上的实验结果说明,OK432作为有效的佐剂能特异性的增强HUVEC疫苗对HUVEC细胞的杀伤能力。
2.5 抗血管生成实验-疫苗免疫对皮内肿瘤新生血管的抑制作用 如Fig 5所示,HUVECs和HUVECs-OK432疫苗免疫组肿瘤四周血管稀少,瘤内没有观察到大量的血管出血,而PBS对照组肿瘤有大量血液供应,瘤内呈血红色,显示瘤内血供丰富。与HUVECs组比较,HUVECs-OK432疫苗组血管数目明显降低(P<0.05)。各组血管数目分别为:PBS 87.56±18.97,OK432 80.23±19.12,HUVECs 45.78±9.87,HUVECs-OK432 20.35±6.35。
2.6 安全性检查 最后,我们对制备的HUVECs-OK432疫苗的安全性进行了考察。取动物的内脏器官(心、肝、脾、肺、肾),外观上各脏器色泽鲜亮,没有发现明显病变,也没有异常粘连物质。经10%甲醛溶液固定后,石蜡包埋等常规方法处理,4μm厚切片,并用HE染色,在光学显微镜下观察拍照。切片结果也未发现疫苗对动物各器官存在明显毒性。
3 讨论
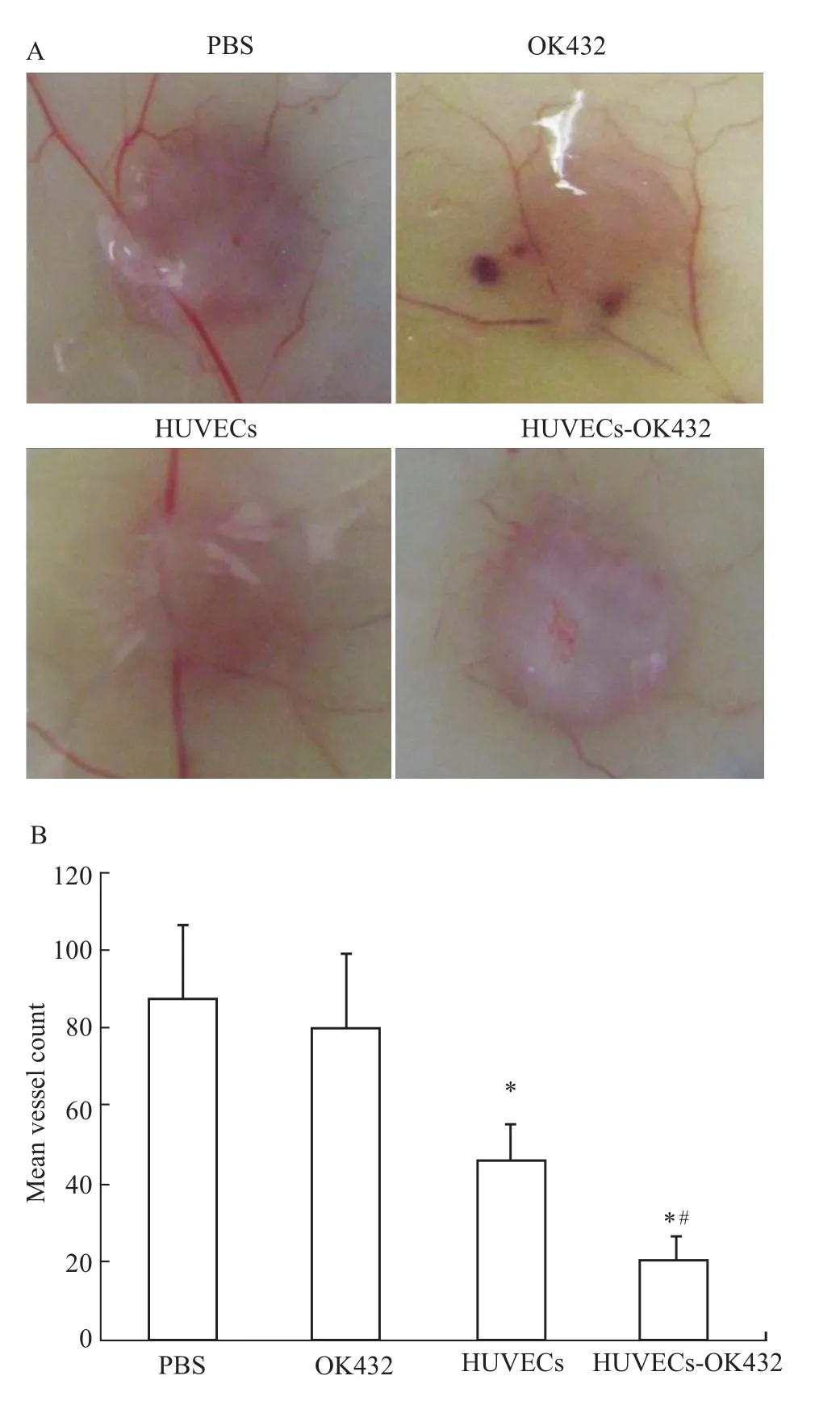
Fig 5 Effects of HUVECs-OK 432 immune response on tumor-induced angiogenesis*P<0.05 vs PBS;#P<0.05 vs HUVECs.
内皮细胞疫苗的抗肿瘤作用已经在临床试验中得到了初步证实,但是仍然不能完全令人满意。OK432作为一种免疫增强剂,已经较多的应用于肿瘤免疫治疗,并显示了良好的佐剂增强作用。在本实验中,我们以HUVECs作为抗原形式,OK432作为佐剂制备HUVECs-OK432疫苗,并考察了疫苗对EAC乳腺癌生长的抑制作用。实验结果显示:相比较单独的HUVEC免疫,HUVECs-OK432疫苗免疫诱导产生了更强的靶向肿瘤新生血管的免疫应答,从而大大抑制了EAC乳腺癌的生长,这说明添加合适的佐剂提高内皮细胞疫苗抗肿瘤疗效的策略是有效的,提示我们可以进一步的对免疫佐剂进行优化,从而提升HUVEC疫苗的抗肿瘤效率。
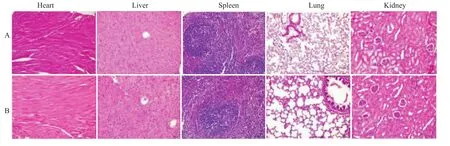
Fig 6 A general observation on toxicity A:PBS;B:HUVECs-OK432
复发和转移是乳腺癌治疗的一大难题,也是导致乳腺癌患者死亡的重要原因,越来越多的证据也显示肿瘤的转移和复发与肿瘤血管新生密切相关[11-13],在本实验中,我们用皮内肿瘤血管模型考察了HUVECs-OK432疫苗对肿瘤血管新生的影响。实验结果显示:和PBS阴性对照组相比,HUVECs-OK432免疫组肿瘤血管数目明显降低(20.35±6.35 vs87.56±18.97,P<0.05),这说明 HUVECs-OK432疫苗免疫有效抑制了肿瘤血管的新生。ELISA检测抗体水平和CTL杀伤实验的结果也进一步证实HUVECs-OK432疫苗诱导产生的靶向肿瘤血管的免疫反应是其发挥抗肿瘤药效的主要原因。采用疫苗主动免疫的方式,体内的免疫应答一旦被激发,可以在一段时间内维持高水平,从而可以有效克服传统的血管生成抑制剂过早停药引起的病情反跳,有望在预防肿瘤术后转移和复发上发挥更好的作用。
综上所述,本实验制备了一种OK432优化的HUVECs-OK432疫苗,该疫苗可以有效抑制鼠源EAC乳腺癌皮下移植瘤的生长,其抗肿瘤作用与高水平特异性的HUVEC抗体以及淋巴细胞的活化有关,此次研究为肿瘤治疗提供了一种有特色的HUVEC疫苗的肿瘤治疗方案,希望也能为更多的肿瘤临床治疗方案提供思路和借鉴。
参考文献:
[1] Okaji Y,Tsuno N H,Saito S,etal.Vaccines targeting tumor angiogenesis-a novel strategy for cancer immunotherapy[J].Eur J Surg Oncol,2006,32(4):363-70.
[2] Chen X Y,Zhang W,Zhang W,et al.Vaccination with viable human umbilical vein endothelial cells preventsmetastatic tumors by attack on tumor vasculature with both cellular and humoral immunity[J].Clin Cancer Res,2006,12(19):5834-40.
[3] Okaji Y,Tsuno N H,Kitayama J,etal.Vaccination with autologous endothelium inhibits angiogenesis and metastasis of colon cancer through autoimmunity[J].Cancer Sci,2004,95(1):85-90.
[4] Tanaka M,Tsuno N H,Fujii T,etal.Human umbilical vein endothelial cell vaccine therapy in patients with recurrent glioblastoma[J].Cancer Sci,2013,104(2):200-5.
[5] Wei Y Q,Wang Q R,Zhao X,et al.Immunotherapy of tumors with xenogeneic endothelial cells as a vaccine[J].Nat Med,2000,6(10):1160-6.
[6] Okaji Y,Tsuno N H,Tanaka M,et al.Pilot study of anti-angiogenic vaccine using fixed whole endothelium in patients with progressivemalignancy after failure of conventional therapy[J].Eur JCancer,2008,44(3):383-90.
[7] Okamoto M,Furuichi S,Nishioka Y,etal.Expression of toll-like receptor 4 on dendritic cells is significant for anticancer effect of dendritic cell-based immunotherapy in combination with an active component of OK-432,a streptococcal preparation[J].Cancer Res,2004,64(15):5461-70.
[8] Fujimoto T,Duda R B,Szilvasi A,et al.Streptococcal preparation OK-432 is a potent inducer of IL-12 and a T helper cell 1 dominant state[J].J Immunol,1997,158(12):5619-26.
[9] Xu M L,Xing Y,Zhou L,et al.Improved efficacy of therapeutic vaccination with viable human umbilical vein endothelial cells against murine melanoma by introduction of OK432 as adjuvant[J].Tumour Biol,2013,34(3):1399-408.
[10]Xu M L,Zhou L,Zhang P,etal.Enhanced antitumor efficacy by combination treatmentwith a human umbilical vein endothelial cell vaccine and a tumor cell lysate based vaccine[J].Tumour Biol,2013,34(5):3173-82.
[11]王秀峰,周钱梅,苏式兵.黄芩素抑制人乳腺癌细胞侵袭和迁移的实验研究[J].中国药理学通报,2010,26(6):745-50.
[11]Wang X F,Zhou QM,Su SB.Experimental study on Baicalein inhibiting the invasion and migration of human breast cancer cells[J].Chin Pharmacol Bull,2010,26(6):745-50.
[12]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl JMed,1971,285(21):1182-6.
[13]Folkman J.What is the evidence that tumors are angiogenesis dependent?[J].JNatl Cancer Inst,1990,82(1):4-6.

