EGCG通过抑制p75NTR通路对APP/PS1小鼠学习记忆障碍的改善作用
杨时伦,刘明妍,钟 欣,杜 可,姚维范,赵海山,魏敏杰
(中国医科大学药学院药理学教研室,辽宁沈阳 110001)
阿尔采末病(Alzheimer’s disease,AD)是以进行性认知障碍为其主要特征的神经系统退行性疾病,其典型的病理改变为神经细胞间出现大量以β-淀粉样肽(β-amyloid,Aβ)为核心的老年斑(senile plaques,SP)及神经元丢失等[1-2]。研究表明,β-淀粉样肽前体蛋白(β-amyloid precursor protein,APP)在β-分泌酶的作用下水解产生大量Aβ沉积,Aβ的大量沉积通过氧化应激、钙超载、细胞调亡等方式启动了神经细胞发生退行性改变,出现AD样病变[3-4]。而神经细胞生存能力降低和细胞凋亡是导致AD的功能退化和神经变性的基础和最后转归,p75NTR是神经生长因子(NGF)的低亲和力受体,主要介导神经细胞的凋亡,已有文献报道,p75NTR在AD脑组织中高表达。而当p75NTR信号通路被活化时,将触发凋亡相关JNK通路,并通过影响其下游凋亡相关蛋白的表达,从而最终导致神经元退化、凋亡以及学习记忆障碍[4-7]。因此,发现一种能够抑制AD脑内p75NTR信号通路的活化,且可有效改善AD症状的新药,并对其进行相关机制的探讨,对于深入研究AD具有较大的意义。
(-)表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶的一种主要多酚成分,具有抗氧化应激、抗炎和抗癌等作用[8]。已有报道EGCG在体外对3-HK诱导的人神经母细胞瘤SHSY5Y细胞,转染瑞典型人类APP基因突变的啮齿类神经元样 N2a细胞,APP过表达 TgAPPsw line 2576单转基因小鼠原代神经细胞,以及对D-半乳糖诱导的AD小鼠、TgAPPsw line 2576单转基因小鼠、PS2单转基因小鼠具有神经保护作用[9],但尚未见有关EGCG通过调节NGF相关TrkA/p75NTR平衡发挥抗AD作用的报道。本研究首次以APP/PS1双转基因小鼠为研究对象研究EGCG的抗AD作用,并从EGCG抑制p75NTR信号通路的角度,探讨其改善APP/PS1转基因小鼠学习记忆障碍及抑制其脑内神经细胞凋亡的可能机制。
1 材料与方法
1.1 实验动物 C57 BL/6J小鼠10只,♂♀各半,9月龄,(21±4)g;APP/PS1转基因小鼠 20只,♂♀各半,9月龄,体质量(19±3)g,由中国医科大学实验动物中心提供。实验过程中的动物饲养及取材均遵守实验动物管理和保护的有关规定。
1.2 药物处理 对照组(WT组):9月龄C57 BL/6J小鼠10只,♂♀各半,每日等量于实验组的双蒸水灌胃,每日1次,连续灌胃4周;模型组(APP/PS1组):9月龄APP/PS1转基因小鼠10只,♂♀各半,每日等量于实验组的双蒸水灌胃,每日1次,连续灌胃4周;治疗组(EGCG-treated APP/PS1组):9月龄APP/PS1转基因小鼠10只,♂♀各半,每天按2 mg·kg-1体重灌胃0.02%的EGCG水溶液(EGCG,纯度>95%,购自Sigma公司),每日1次,连续灌胃4周。4周给药结束后,即可开始行为学试验,行为学试验结束后,处死动物,取皮质及海马,或组织固定。
1.3 行为学试验
1.3.1 避暗试验 4周给药结束后,参照Galeotti等[9]的方法,开始被动避暗试验,分为训练和正式试验两个阶段:训练前将小鼠头背着洞口放入明室(BA-200避暗自动测试仪,成都泰盟科技有限公司),先适应环境3 min,然后给暗室铜栅通以36 V电流,小鼠一进入暗室即受电击,其正确反应是回到明室,铜栅通电持续5 min,此为训练过程。24 h后对小鼠进行记忆测验,记录小鼠第1次进入暗室的时间,此为避暗潜伏期,并记录5 min内小鼠进入暗室的次数(即避暗错误次数),5 min内未进入暗室的小鼠其潜伏期按300 s计算。
1.3.2 Morris水迷宫试验 在被动避暗试验结束后,参照 Morris等[10]的方法,开始 Morris水迷宫试验(Morris水迷宫装置购自北京硕林苑生物科技有限公司)。参照Morris方法进行,分为训练期、定向航行试验和空间搜索试验3部分进行。训练期:在定向航行试验前1天,水池中不放置平台,使小鼠在水中自由游泳2 min,使其适应环境。定向航行试验:进行定向航行试验时,将平台放在固定的第二象限,不再移动。该试验训练小鼠每天4次,共5 d。训练时,将小鼠面向池壁从4个入水点分别放入水池,记录鼠入水到找到水下隐蔽平台并站立于其上所需时间,作为潜伏期(latency),用秒(s)表示,并记录从小鼠如水至找到平台通过路径的总长度,用厘米(cm)表示。小鼠找到平台后,让其在平台上站立30 s。入水后60 s若小鼠仍未能找到平台,则将其轻轻从水中引导拖上平台,并停留30 s,然后进行下一次训练。每只鼠从4个入水点分别放入水池为一次训练,两次训练之间间隔120 s。空间搜索试验:在定向航行试验结束后,也就是d 6,将平台撤去,使其在水中寻找原平台所在位置,共120 s,记录从小鼠第1次到达平台原来所在位置的时间(latency),用秒(s)表示,以及小鼠穿越原平台的次数,来评价小鼠记忆重现的能力。
1.3.3 自主活动试验 将小鼠放入自主活动箱中(ZZ-6小鼠自主活动测试仪,成都泰盟科技有限公司),记录小鼠10 min内自主活动次数(locomotivity)和站立次数(stand-up)。
1.4 TUNEL法检测小鼠脑组织中神经元形态和细胞凋亡水平 石蜡切片按照TUNEL细胞凋亡检测试剂盒(购自Roch公司)说明书进行,石蜡切片脱蜡、水化后,3%的H2O2室温处理10 min,TBS洗3次后,加20 mg·L-1蛋白酶K工作液37℃消化15 min,TBS洗后加入TUNEL反应体系混合液37℃反应2 h,封闭30 min;37℃下生物素化的抗地高辛抗体孵育30 min,过氧化物酶-DAB反应体系对凋亡细胞进行染色,观察各组每100个细胞TUNEL阳性细胞表达率(即凋亡指数)。
1.5 Fluoro-Jade B法检测小鼠脑组织中神经元退行性变化 石蜡切片脱蜡、水化后,无水乙醇脱水5 min,80%乙醇脱水5 min,70%乙醇脱水2 min,双蒸水漂洗2 min。浸入0.06%高锰酸钾溶液15 min后,转入双蒸水中漂洗2 min;然后浸入0.0004%FJB染液中反应30 min,再在蒸馏水漂洗1 min,反复3次,晾干后,二甲苯透明1 min,最后用中性树胶(DPX)封片。在荧光显微镜下采用蓝色滤色片(激发光波长为450~490 nm)观察并采集图像。观察各组每mm2FJB阳性细胞表达数。
1.6 W estern blot检测小鼠脑组织中相关蛋白表达 各组小鼠海马组织,放入预冷的RIPA Buffer裂解缓冲液[50 mmol·L-1Tris-HCl buffer pH 8.0 containing 150 mmol·L-1NaCl,1%NP-40,0.5%sodium deoxycholate,0.1%sodium dodecyl sulphate,购自碧云天生物技术研究所;0.1%phenylmethyl sulfonylfluoride(PMSF),购自 Roche公司]中,冰上匀浆后,4℃12 000×g×30 min,取上清,BCA法蛋白定量(BCA试剂盒,购自碧云天生物技术研究所)。每孔蛋白上样量50μg,SDS-PAGE电泳分离蛋白并电转移至PVDF膜上。5%脱脂奶粉或5%BSA的TBST中室温封闭2 h,一抗4℃过夜(兔抗p75ICD抗体(1∶500,cell signalling);兔抗 JNK2、Phospho-JNK2(FL)抗体 (1∶600,Santa Cruz Biotechnology),鼠抗 caspase-3(DO-1)抗体 (1∶500,Santa Cruz Biotechnology),兔 抗 或 鼠 抗 β-actin(1∶2 000,1∶2 000,Santa Cruz Biotechnology)室温孵育2 h,ECL显影(SuperECL Plus超敏发光液购自北京普利莱基因技术公司)。
1.7 数据处理 试验数据采用SPSS16.0统计分析软件包进行统计学处理,数据以s表示。组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用Turkey’s post hoc test法进行统计学分析;行为学试验中穿梭次数及错误次数,使用非参检验Kruskal-Wallis H test法进行统计学分析。
2 结果
2.1 EGCG有效改善APP/PS1小鼠的学习记忆障碍 为了考察EGCG对APP/PS1小鼠学习记忆能力的影响,我们分别采用被动避暗试验和Morris水迷宫试验来各组小鼠的与学习记忆相关的行为学改变。
首先,我们通过被动避暗试验分别对各组小鼠避暗潜伏期(Fig 1A)和进入暗室错误次数(Fig 1B)对各组小鼠学习记忆能力的影响进行了考察,发现EGCG可使APP/PS1小鼠的避暗潜伏期明显延长(P<0.01),进入暗室的次数明显减少(P<0.01),初步说明EGCG可改善APP/PS1转基因小鼠的学习记忆障碍。
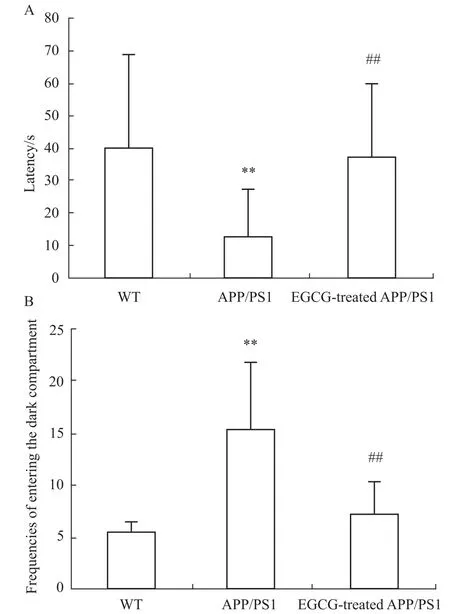
Fig 1 Effects of EGCG treatment on learning and memoryperformance in APP/PS1 m ice by passive avoidance test(n=10)A:the latency;B:the frequencies of entering the dark compartment;Resultswere expressed as values of latency and the frequencies of entering the dark compartment obtained from each group and analyzed by one-way ANOVA and Kruskal-Wallis H test,respectively.**P<0.01 vs WT group;##P<0.01 vs APP/PS1 group.
接着,我们又通过Morris水迷宫试验连续5 d考察定向航行试验中寻找平台潜伏期(Fig 2A)及寻找路径长度(Fig 2B)的变化发现,在定位巡航试验的d 1,各组小鼠的寻找平台潜伏期和路径长度差异无显著性(P>0.05);而经过d 2~5定位巡航试验的学习过程后,EGCG可使APP/PS1组小鼠寻找平台潜伏期和路径长度明显缩短(P<0.01),并呈现出明显的学习与记忆的获得曲线。在d 6撤去平台后的空间探索实验中,我们又考察了各组小鼠在原平台所在目的象限的停留时间和原平台所在位置的穿梭次数的差异对其记忆再现能力(Fig 3),发现EGCG可明显延长APP/PS1小鼠在目的象限的停留时间和穿梭次数(P<0.01),这进一步证明了EGCG可改善APP/PS1小鼠的学习记忆障碍。
最后,应用自主活动试验来考察各组小鼠自主活动次数(Fig 4A)和站立次数(Fig 4B)的差异。结果显示,各组小鼠10 min内站立次数与自主活动次数差异均无显著性(P>0.05),这提示APP/PS1小鼠的活动能力未受影响,上述行为学指标的改变确实是由于学习记忆障碍所引起的,而并非由于小鼠活动能力的改变而引起的。
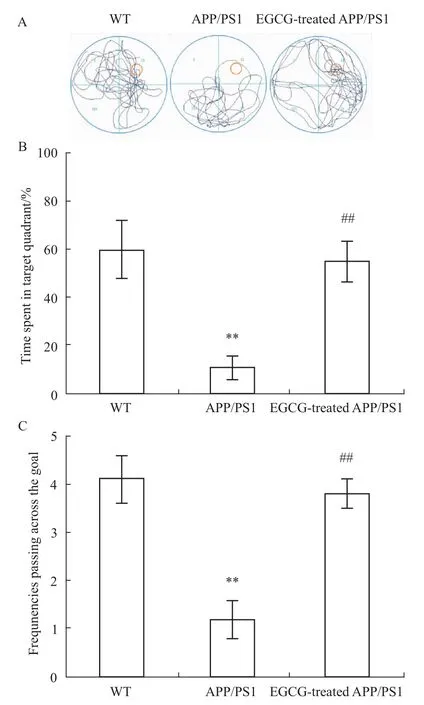
Fig 3 Effects of EGCG treatment on learning and memory performance in APP/PS1 m ice by probe trial of M orriswater maze(n=10)A:time spent in targetquadrant;B:frequencies passing through the goal;Results were expressed asmean±SD values of the time spent in target quadrantand the frequenciespassing through the goal obtained from each group and analyzed by one-way ANOVA and Kruskal-Wallis H test,respectively.**P<0.01 vs WT group;##P<0.01 vs APP/PS1 group.
2.2 EGCG明显抑制APP/PS1转基因小鼠海马的神经细胞凋亡 本课题组前期工作已经证实,EGCG可明显降低Aβ1-40和APP蛋白表达水平,而也有研究证明Aβ1-40和APP的沉积具有神经细胞毒性,可诱导神经细胞发生凋亡[2-4]。因此,我们进一步以TUNEL法,就EGCG对APP/PS1小鼠海马中神经细胞凋亡水平进行了考察,发现EGCG可明显降低APP/PS1小鼠海马的TUNEL阳性细胞表达和凋亡指数(P<0.01,见Fig 5),这说明EGCG可明显抑制APP/PS1小鼠海马的神经细胞凋亡,发挥抗凋亡作用。
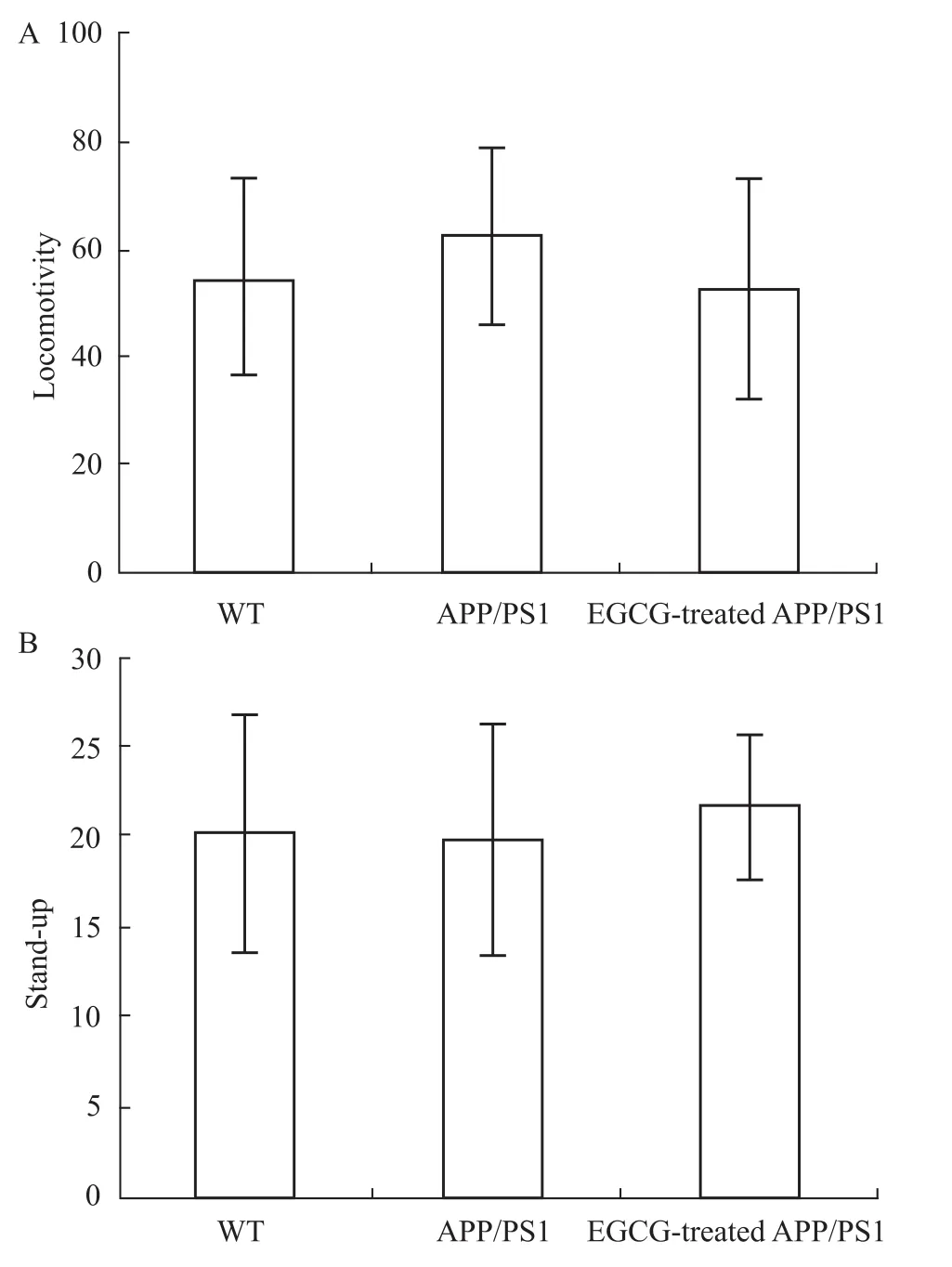
Fig 4 Effects of EGCG treatment on locomotivity performance in APP/PS1 m ice by navigation test of M orris water maze(n=10)A:locomotivity;B:stand-up;Results were expressed ass values of the data obtained from each group and analyzed by Kruskal-Wallis H test.
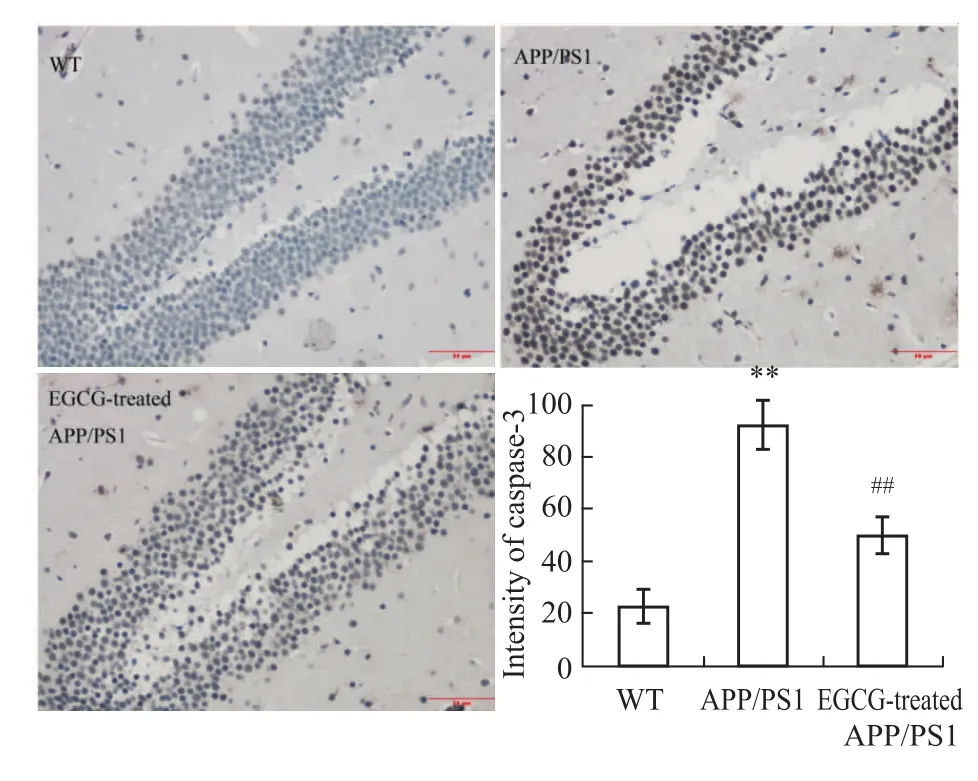
Fig 5 Effects of EGCG treatment on neuronal apoptosis in hippocam pus of APP/PS1 m ice by TUNEL staining(n=5)Results were expressed ass values of data obtained from each group and analyzed by one-way ANOVA.**P<0.01 vs WT group;##P<0.01 vs APP/PS1 group.
2.3 EGCG明显抑制APP/PS1转基因小鼠海马的神经细胞退行性改变 我们以TUNEL法发现了EGCG可抑制APP/PS1小鼠海马中神经细胞的凋亡水平,因此,我们进一步用特异性检测细胞退行性改变的Fluoro-Jade B法考察了EGCG对神经细胞退行性改变的影响。结果发现,EGCG可明显降低APP/PS1小鼠海马的 FJB阳性细胞表达量(P<0.01,见Fig 6),这说明EGCG明显抑制APP/PS1小鼠海马的神经细胞退行性变,发挥抗AD作用。
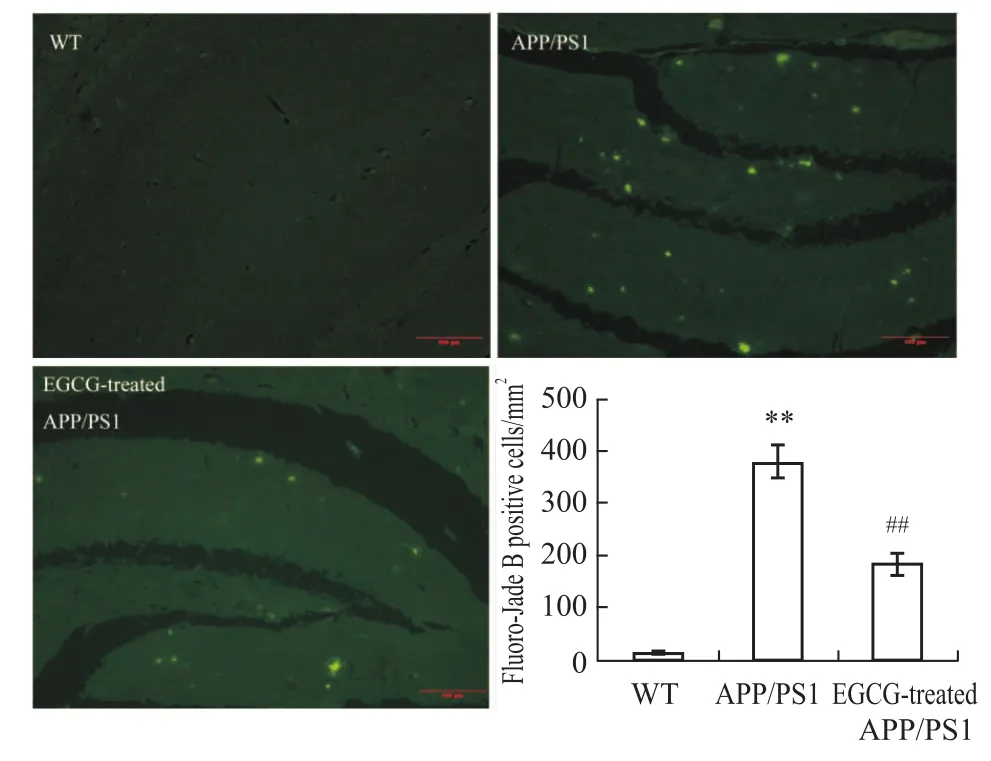
Fig 6 Effects of EGCG treatment on neurodegenerative levels in hippocam pus of APP/PS1 m ice by Fluoro-Jade B staining(n=3)Results were expressed values of the data obtained from each group and analyzed by one-way ANOVA.**P<0.01 vs WT group;##P<0.01 vs APP/PS1 group.
2.4 EGCG抑制p75NTR信号通路的平衡发挥其抗AD作用 如前所述,EGCG能明显抑制APP/PS1转基因小鼠海马内神经细胞凋亡及退行性改变,从而发挥神经保护作用。接下来,我们对EGCG是否通过调节APP/PS1转基因小鼠海马p75NTR信号通路而发挥其抗AD作用进行了考察。
本研究通过考察对EGCG对p75NTR信号通路及其下游底物的影响,发现EGCG可使APP/PS1组小鼠海马内p75NTR的剪切产物p75ICD表达水平明显降低,并明显降低其下游JNK2的磷酸化水平与凋亡相关蛋白p53和cleaved-caspase 3蛋白表达水平(P<0.01,见Fig 7),这表明EGCG可在激活 NGF相关TrkA通路的同时,抑制p75NTR通路的活化,继而减低p53与cleaved-caspase 3的表达,从而发挥抑制海马神经细胞凋亡、改善学习记忆的作用。
3 讨论
APP/PS1转基因小鼠具有脑内出现Aβ沉积时间早,且产生Aβ量多,同时多伴有胶质细胞增生,神经元丢失以及学习记忆功能障碍等的特点,能够较好地模拟出类似于AD患者的病理变化和行为学变化而倍受研究者重视,已成为研究AD发病机制及药物开发理想的动物模型。本研究首次通过调节脑内 p75NTR信号通路这一新的作用机制,探讨EGCG改善9月龄APP/PS1双转基因小鼠抗AD作用及其机制进行了研究。研究发现,EGCG可改善APP/PS1双转基因小鼠的学习记忆障碍(Fig 1~4),并明显抑制神经细胞凋亡及退行性改变(Fig 5,6),这提示着EGCG对APP/PS1双转基因小鼠具有抑制细胞凋亡、改善认知能力障碍等抗AD作用。
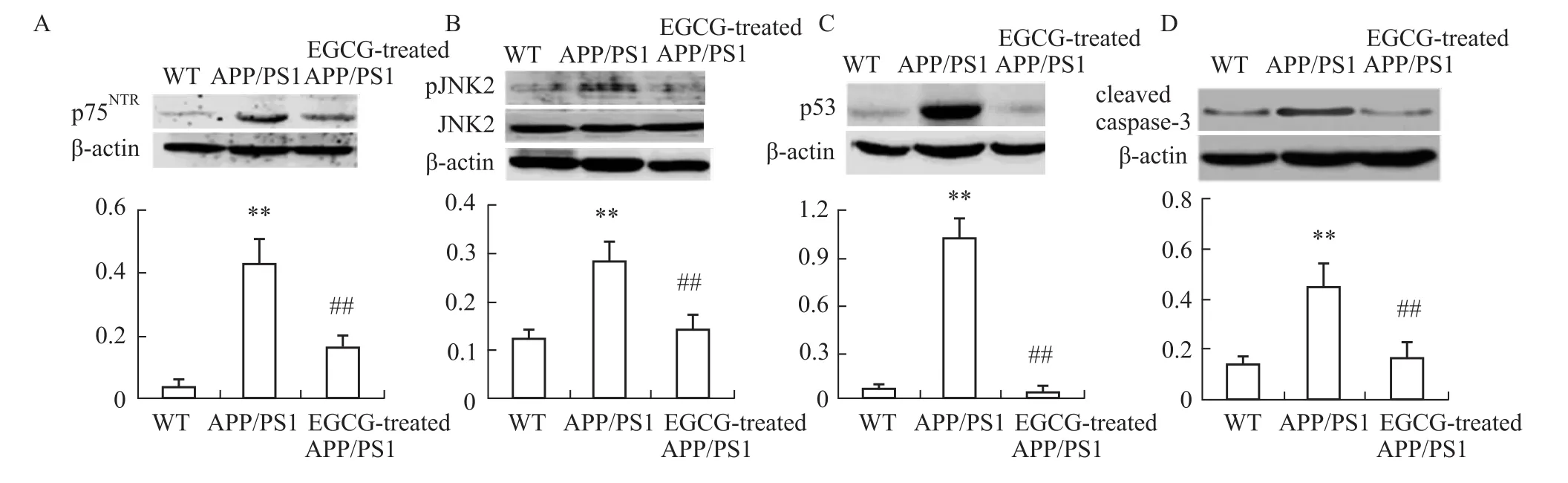
Fig 7 Effects of EGCG treatment on p75NTR-mediated JNK signaling in hippocampus of APP/PS1 m ice by W estern blot(n=3)A:p75ICDexpression level;B:the activation levels of JNK2;C:p53 expression level;D:cleaved-caspase3expression level;Quantification of protein blots was shown,β-actin levels were normalized to be a loading control.Each bar represents themean relative protein level of each group.Results were expressed as values of the data obtained from each group and analyzed by one-way ANOVA.**P<0.01 vs WT group;##P<0.01 vs APP/PS1 group.
有研究发现,p75NTR在许多中枢神经系统疾病中表达增高并参与神经元的凋亡,如AD、多发性硬化症、肌萎缩性侧索硬化、脊髓损伤和脑缺血等。而且,也有研究报道[14]Aβ直接与 p75NTR结合,在多个细胞培养株中诱导凋亡,尤其是诱导与AD有关的神经元细胞凋亡。聚集的Aβ1-40和Aβ1-42会促进c-jun磷酸化,作为p75NTR介导的细胞凋亡的早期事件。p75NTR首先在细胞外被剪切产生一个20 ku的细胞内区域(p75ICD),p75ICD可易位到细胞核,这一过程伴随着延缓的凋亡[47]。这提示p75NTR可介导神经细胞凋亡,并与Aβ的沉积和学习记忆密切相关[5]。在对anti-NGF AD11模型小鼠的研究发现,p75NTR受体的激活可诱导神经细胞导致其发生凋亡,进而发生认知障碍,这提示着p75NTR介导的信号通路在神经细胞凋亡中发挥了重要的作用,参与AD发生发展调控。因此,本研究考察了EGCG对p75NTR通路的作用,发现EGCG可下调p75NTR的剪切活性,抑制p75NTR通路的活化,进而抑制其下游JNK通路,并使其下游凋亡相关蛋白p53和cleaved-caspase 3表达降低(Fig 7),从而发挥抗凋亡的作用。
综上结果所示,EGCG主要通过抑制p75NTR通路及其介导的下游JNK通路及其凋亡相关下游底物,抑制神经细胞凋亡及退行性改变,改善学习记忆障碍,发挥抗AD作用。
参考文献:
[1] LesnéS,Koh M T,Kotilinek L,et al.A specific amyloid-beta protein assembly in the brain impairsmemory[J].Nature,2006,440(7082):352-7.
[2] Hsiao K,Chapman P,Nilsen S,et al.Correlative memory deficits,Abeta elevation,and amyloid plaques in transgenic mice[J].Science,1996,274(5284):99-102.
[3] Johnson EM Jr.Possible role of neuronal apoptosis in Alzheimer′s disease[J].Neurobiol Aging,1994,15(Suppl2):S187-9.
[4] O′Brien R J,Wong PC.Amyloid precursor protein processing and Alzheimer′s disease[J].Annu Rev Neurosci,2011,34:185-204.
[5] Colafrancesco V,Villoslada P.Targeting NGF-pathway for developing neuroprotective therapies formultiple sclerosis and other neurological diseases[J].Arch Ital Biol,2011,149(2):183-92.
[6] Saura CA,Valero J.The role of CREB signaling in Alzheimer’s disease and other cognitive disorders[J].Rev Neurosci,2011,22(2):153-69.
[7] Song W,Volosin M,Cragnolini A B,et al.ProNGF induces PTEN via p75NTRto suppress Trk-mediated survival signaling in brain neurons[J].JNeurosci,2010,30(46):15608-15.
[8] Wu C D,Wei G X.Tea as a functional food for oral health[J].Nutrition,2002,18(5):443-4.
[9] Galeotti N,Ghelardini C,Bartolini A.Role of5-HT4 receptors in themouse passive avoidance test[J].JPharm Exp Ther,1998,286(3):1115-21.
[10]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].JNeurosciMethods,1984,11(1):47-60.
[11]Lee S J,Lee K W.Protective effect of(-)-epigallocatechin gallate against advanced glycation endproducts-induced injury in neuronal cells[J].Biol Pharm Bull,2007,30(8):1369-73.
[12]Freedman SB,Morris R G.A learing deficit related to age and beta-amyloid plaques in a mouse model of Alzheimer′s disease[J].Nature,2000,408(6815):975-9.
[13]Chu J,PraticòD.5-lipoxygenase as an endogenousmodulator of amyloidβformation in vivo[J].Ann Neurol,2011,69(1):34-46.
[14]Song W,Volosin M,Cragnolini A B,et al.ProNGF induces PTEN via p75NTRto suppress Trk-mediated survival signaling in brain neurons[J].JNeurosci,2010,30(46):15608-15.
[15]Fortress A M,BuhusiM,Helke K L,Granholm A C.Cholingergic degeneration and alterations in the TrkA and p75NTRbalance as a result of pro-NGF injection into aged rats[J].J Aging Res,2011,2011:460543.

