胱硫醚-β-合酶/硫化氢系统在鱼藤酮诱导PC12细胞损伤中的变化
许 岩,马 娜,邓树泳,王金全,冯鉴强,孟金兰
(1.南方医科大学中西医结合医院外三科,广东广州 510315;2.广东药学院基础学院生理学系,广东广州 510006;3.中山大学中山医学院生理学教研室,广东广州 510080)
帕金森病(Parkinson’s disease,PD)又称为震颤性麻痹,是神经退行性疾病之一,在老年人群中多发。其特征性病理改变为黑质多巴胺(DA)能神经元进行性变性和死亡,其病因目前仍在不断探索中。
研究已证实,硫化氢(hydrogen sulfide,H2S)代谢异常参与阿尔采末病(AD)[1]、Down′s综合症[2]、中风[3]等中枢神经系统疾病的发生发展。新近研究表明,在6-羟基多巴胺制备的PD模型鼠中检测到黑质内源性H2S明显减少,标记DA能神经元的酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性细胞数量及 TH蛋白表达明显下降[4]。提示,内源性H2S的生成障碍也参与了 PD的发生。1995年Awata等[5]证实了胱硫醚-β-合酶(cystathionine-β-synthase,CBS)是脑内源性H2S生成的主要酶。那么,在PD发生发展过程中内源性CBS/H2S系统动态变化如何尚未明瞭。
研究证实,鱼藤酮(rotenone)是线粒体呼吸链复合物I的抑制剂具有DA能神经元毒性[6],是PD发生及发展中一种肯定的环境危险因素。研究人员发现,将大鼠长期、慢性暴露于鱼藤酮时,会产生类似于人类PD行为学和病理学的改变[7]。目前,体外应用鱼藤酮复制PD细胞模型也得到了广泛应用,在该模型中动态研究PD进展过程中内源性CBS/H2S系统的变化尚未见报道。
因此,本研究拟以鱼藤酮诱导PC12细胞(来源于大鼠嗜铬细胞瘤细胞株,从形态结构及功能方面均具有神经元的特征)作为PD细胞模型,动态追踪研究鱼藤酮诱导PD细胞模型中CBS蛋白表达及活性、内源性H2S的生成、细胞毒性与氧化应激的变化,以阐明PD进展过程中内源性CBS/H2S系统的动态变化,为探索PD发病机制提供新颖的实验资料。
1 材料与方法
1.1 主要试剂 鱼藤酮购自Sigma-Aldrich公司(St Louis,MO,USA);细胞计数试剂盒-8(Cell Counter Kit-8,CCK-8)由 Dojindo公司提供(Kyushu,Japan);DMEM培养基、胎牛血清购自Gibco BRL公司(Calsbad,CA,USA);GSH试剂盒购自 Beyotime Biotech(Shanghai,China)公司;β-actin、BCA蛋白定量试剂盒购自 Kangchen Biotech(Shanghai,China)公司;CBS抗体购自Cell Signaling公司 。
1.2 细胞培养 PC12细胞培养于10%的胎牛血清DMEM培养基中,在37℃,5%CO2培养箱内培养。细胞以0.25%的胰蛋白酶消化,每2~3 d传代1次。在细胞对数生长期进行药物处理。
1.3 实验分组 ① 空白对照组(control),在细胞培养体系中不加入任何药物;②鱼藤酮组,在细胞培养体系中加入1.5μmo l·L-1鱼藤酮分别处理PC12细胞 6、12、24、48 h观察相关指标变化。
1.4 细胞存活率的检测 取对数生长期细胞,以1×104/孔接种于96孔板,在37℃、5%CO2条件下培养过夜后,各组细胞分别与CCK-8(每孔100μl加10μl CCK-8)孵育4 h,随后在酶联免疫检测仪测定每孔的吸收值(450 nm波长),按公式:存活率/%=(实验组OD-空白对照组OD)/(正常对照组OD-空白对照组OD)×100%,求出实验组的存活率,重复3次,进行统计分析。
1.5 细胞内GSH含量检测 按照碧云天生物技术研究所提供的谷胱甘肽检测试剂盒说明书进行。PC12细胞接种与35 mm培养皿内,当细胞生长至80%融合时给予不同条件的培养基。处理结束后,用0.5%TritonX-100溶液裂解细胞。细胞裂解液经BCA法进行蛋白定量后,检测GSH的含量。GSH可与 5,5′-联硫-2,2′-双硝基苯甲酸(DTNB)反应生成黄色的5-巯基-2-硝基苯甲酸(TNB)。因而,黄色溶液的深浅可以间接反映GSH含量的高低。黄色溶液的强度可用酶标仪记录412 nm波长处的吸光度以进行定量分析。
1.6 内源性胱硫醚-β-合酶(CBS)活性检测 将细胞裂解产物经蛋白定量后,加入预先配制好的反应体系[100 mmol·L-1磷酸钾缓冲液(pH=7.4)、10 mmol·L-1左旋 -半胱氨酸、2 mmol·L-15′-磷酸吡哆醛]中。使其占反应体系的10%,移至反应瓶,吸取1%醋酸锌0.5 ml吸收液加入中央室。转移锥形瓶至37℃水浴摇床中,摇荡反应90 min后,在反应体系中加入50%三氯醋酸0.5 ml终止反应后继续在37℃水浴反应60 min。将中央室的内容物转移后加入7.2 mol·L-1含盐酸对苯二胺的盐酸溶液0.5 ml,加入1.2 mol·L-1含三氯化铁的盐酸溶液0.4 ml,于20 min后测670 nm波长处的吸光度值。
1.7 内源性H2S含量的检测 取310μl经蛋白定量后的细胞裂解液加入2%(W/V)醋酸锌30μl;20%(W/V)三氯醋酸60μl;然后再加入 20 mmol·L-1二甲基对苯二胺硫酸盐(7.2 mol·L-1HCl)40 μl和 30 mmol·L-1(1.2 mol·L-1HCl)FeCl340 μl,迅速合上EP管振荡数下后,转移至37℃生化培养箱静置10min;高速离心12 000 r·min-110 min;分光光度计检测670 nm处吸光度。
1.8 W estern blot法检测蛋白的表达 PC12细胞接种于直径为35 mm的培养皿内,各处理因素结束后,收集细胞并用细胞裂解液在冰上将细胞裂解,10 000×g、4℃离心15 min,上清液即为所提取的蛋白。将提取的蛋白样品用BCA蛋白定量试剂盒进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF上。用5%的脱脂奶粉(TBS-T配置)室温封闭1 h,而后与CBS一抗(1∶1 000)共孵育,4℃轻摇过夜。TBST洗3次,加入相应的二抗,室温孵育1 h。为了观察蛋白的量,用β-actin作为总蛋白的内参照。PVDF膜经TBS-T漂洗3次,每次5 min,免疫信号用增强型化学发光法(ECL)曝光到X光胶片上。将X光胶片扫描后,用ImageJ 1.41o软件(NIH,Bethesda,MD,USA)进行定量分析。
1.9 统计学处理 实验数据经SPSS 13.0统计软件进行统计分析,数据用表示,组间比较用one-way ANOVA方法。
2 结果
2.1 鱼藤酮对PC12细胞内源性CBS表达的影响
Western blot法检测内源性H2S合成酶CBS的表达,结果如Fig 1显示,应用1.5μmol·L-1鱼藤酮处理PC12细胞不同时间(6~48 h),与对照组相比,鱼藤酮处理6和12 h组,CBS的表达明显升高,其中6 h组CBS表达达高峰;而随损伤时间延长,处理24 h组CBS的表达反而明显降低,48 h组CBS的表达降至更低水平。表明鱼藤酮轻度损伤可上调CBS的表达,而重度损伤则抑制CBS的表达。
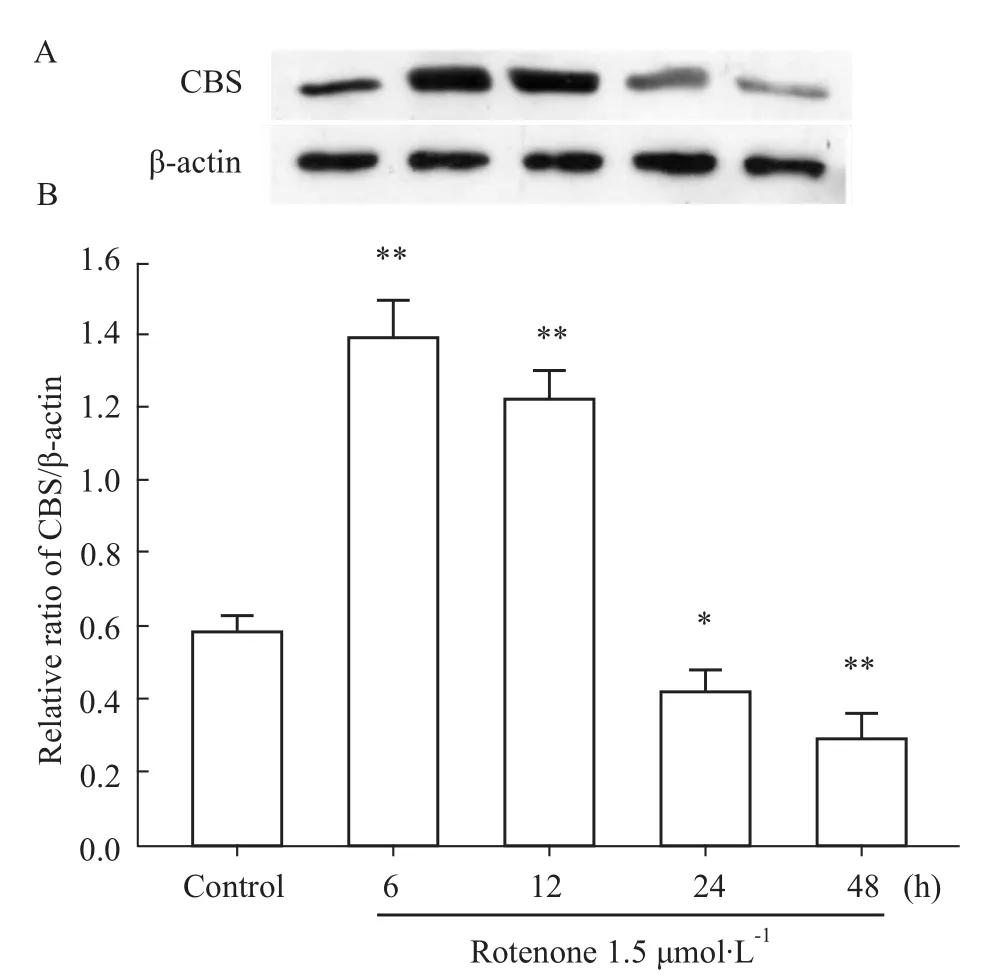
Fig 1 Effect of rotenone on CBS expression in PC12 cellsPC12 cellswere treated with rotenone for different time(6,12,24 and 48h).Western blot analysis was used to detect CBS expression.A:shows the changes in levelsof CBSexpression in the indicated groups.B:shows the data of denstiometric analysis for the changes in CBS expression.*P<0.05,**P<0.01 vs control group.
2.2 鱼藤酮对PC12细胞内源性CBS活性的影响
检测 CBS活性显示(Fig 2),PC12细胞经1.5 μmol·L-1鱼藤酮处理不同时间(6~48 h),CBS的活性呈现先升高后降低的趋势。鱼藤酮处理6 h组CBS的活性达到高峰;但随处理时间延长,24 h处理组CBS活性明显降低,48 h处理组CBS活性降至更低。这些结果表明,鱼藤酮轻度损伤可刺激CBS活性升高,而重度损伤则抑制CBS的活性。
2.3 鱼藤酮对PC12细胞H2S生成的影响 PC12细胞经1.5μmol·L-1鱼藤酮处理不同时间,6 h组和12 h组H2S含量均增加;但随处理时间延长,细胞内H2S含量出现明显降低,与正常对照组相比差异有统计学意义(P<0.01)(Fig 3)。结果表明,鱼藤酮轻度损伤诱导H2S生成增加,而重度损伤则抑制PC12细胞H2S的生成。
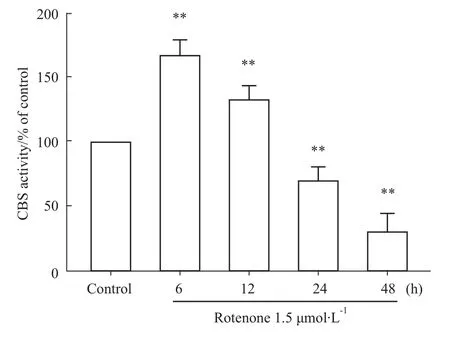
Fig 2 Effect of rotenone on CBS activity in PC12 cellsPC12 cells were treated with rotenone for different time(6,12,24 and 48h).CBSactivity wasmeasured in reaction flask.**P<0.01 vs control group.
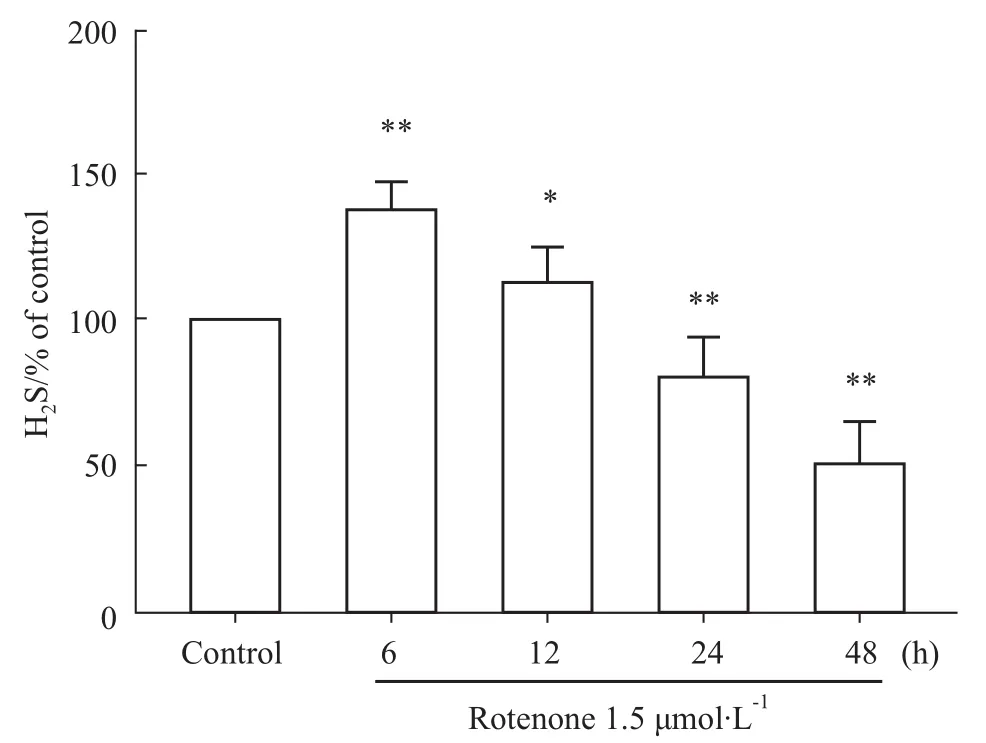
Fig 3 Effect of rotenone on H2 S production in PC12 cellPC12 cellswere treated with rotenone for different time(6,12,24 and 48h).*P<0.05,**P<0.01 vs control group.
2.4 鱼藤酮对PC12细胞存活率的影响 应用1.5 μmol·L-1鱼藤酮作用不同时间(6~48 h),随着作用时间延长,PC12存活率逐渐降低,与对照组相比差异有统计学意义(P<0.01)(Fig 4)。表明鱼藤酮可时间依赖性的诱导PC12细胞毒性损伤。
2.5 鱼藤酮对PC12细胞内GSH的影响 通过检测PC12细胞内GSH含量显示(Fig 5),1.5μmol·L-1鱼藤酮处理PC12细胞不同时间(6~48 h),可使胞内GSH的含量时间依赖性地降低。此结果提示,鱼藤酮诱导了氧化应激反应导致PC12细胞损伤。

Fig 4 Effect of rotenone on viability of PC12 cellsPC12 cellswere treated with 1.5μmol·L-1 rotenone for different time(6,12,24 and 48h).Cell viability wasmeasured by CCK-8 assay.*P<0.05,**P<0.01 vs control group.
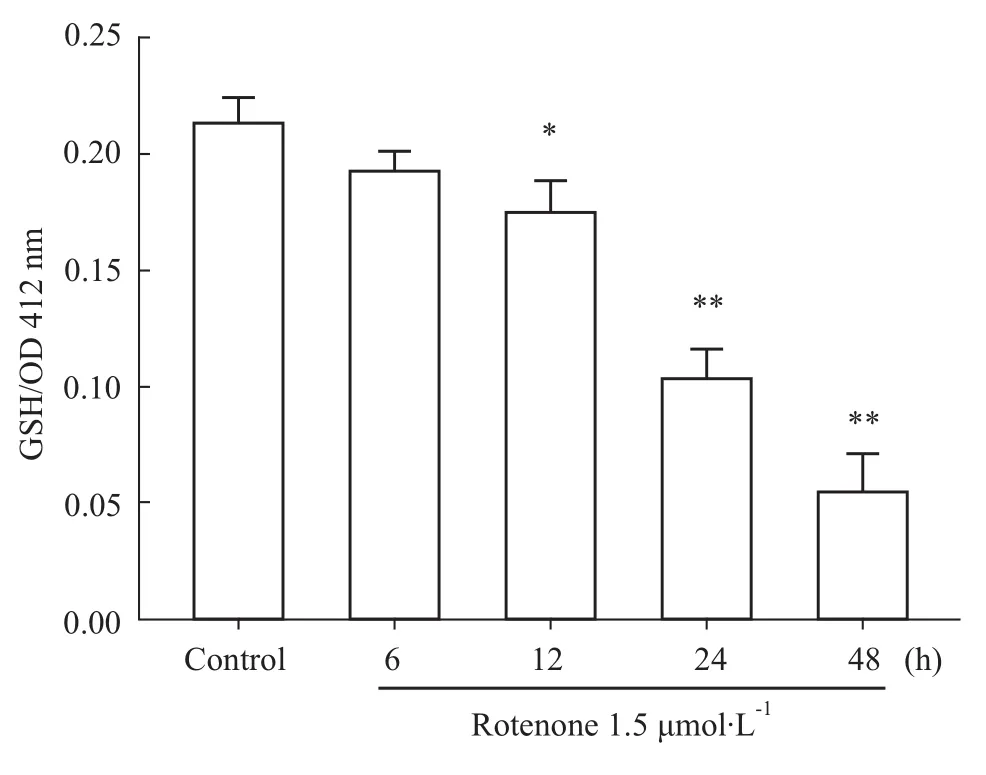
Fig 5 Effect of rotenone on GSH level in PC12 cellsPC12 cells were treated with rotenone for different time(6,12,24 and 48h).*P<0.05,**P<0.01 vs control group.
3 讨论
H2S作为一种信号传导分子,在神经系统中扮演着十分重要的角色,越来越多的研究提示,生理浓度的H2S对神经细胞具有保护作用,而当其浓度过高或过低时,则与神经系统疾病的发生密切相关。近年来研究发现内源性 H2S在 AD[8]、脑卒中[9]及缺血/再灌注脑损伤[10]等神经系统疾病的发病过程中起着重要作用。
PD是一种神经退行性病变,其主要症状包括运动迟缓、肌张力增高、静止性震颤以及步态和姿势不稳,但病因至今未明。Hu等[4]研究发现在用6-OHDA诱导的帕金森样大鼠中,其黑质和纹状体内H2S水平明显下降。而NaHS全身用药能明显的延缓运动功能障碍以及酪氨酸羟化酶阳性神经元丢失的进程。提示,内源性H2S含量减少参与了PD的发病过程,外源性H2S具有抗6-OHDA毒性损伤的神经保护作用。然而该研究尚缺乏对PD进展过程中内源性H2S相关指标的动态检测。
内源性H2S在哺乳动物体内的产生有3条途径,其中两条是5′-磷酸吡哆醛的酶依赖途径,即:胱硫醚-β-合成酶(cystathionine-4β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)途径[11]。CBS和CSE的表达是组织特异性的。1995年Awata等[5]的实验证实了脑内源性H2S的酶学产生机制,发现在脑内只有CBS的转录表达,而没有CSE。此后Abe等[12]进一步用Northern印迹法分析证实了CBS在脑内的转录表达(海马、小脑、大脑皮层、脊髓脑内段),但没有发现CSEmRNA。同时证实CBS在海马高度表达,CBS抑制剂可降低脑内H2S的产生,而CBS激活剂可增加H2S的产生[13],进一步确定 CBS是脑中产生 H2S的主要酶[11,14]。那么,在PD进展过程中脑内源性H2S生成酶CBS的动态变化如何?尚未见报道。
为了明确内源性CBS/H2S系统在PD进展过程中的变化,本实验在鱼藤酮体外诱导PD细胞模型中,动态观察了内源性 CBS/H2S系统在鱼藤酮对PC12细胞损伤中的变化。本实验观察到,鱼藤酮时间依赖性的抑制PC12细胞存活率的同时,细胞内CBS的表达及活性出现先升高后降低的动态变化,内源性H2S含量的检测结果也呈现出先增加后减少的动态变化。尹蔚兰等[15]应用甲醛损伤PC12细胞则发现,甲醛剂量依赖性的抑制CBSmRNA的表达及活性,减少内源性H2S的生成。结果的不一致可能与诱导损伤的因素不同有关。本实验也观察到,随着鱼藤酮细胞毒性作用的加重,PC12细胞内谷胱甘肽(glutathione,GSH)的含量也逐渐降低,而氧化损伤正是PD发生的重要病理机制之一。
已证实H2S可以抑制次氯酸[16]和过氧化亚硝酸盐[17]等诱导的氧化应激损伤,发挥神经细胞的保护作用。结合本实验结果推测,在轻度损伤时,内源性CBS适应性表达和活性升高,使内源性H2S的生成增加,以对抗鱼藤酮诱导的氧化应激细胞损伤作用;而在严重损伤的情况下,鱼藤酮抑制了CBS的表达及活性,导致内源性H2S生成明显减少,增加了PC12细胞对鱼藤酮刺激的敏感性,最终导致细胞损伤。但关于CBS/H2S系统与鱼藤酮诱导细胞损伤间的具体关系有待实验进一步证明。本文为深入阐明PD的发病机制提供了有意义的实验依据。
参考文献:
[1] Eto K,Asada T,Arima K,etal.Brain hydrogen sulfide is severely decreased in Alzheimer′s disease[J].Biochem Biophys Res Commun,2002,293(5):1485-8.
[2] Kamoun P,BelardinelliM C,ChabliA,etal.Endogenous hydrogen sulfide overproduction in Down syndrome[J].Am JMed Genet A,2003,116(3):310-1.
[3] Qu K,Chen C P,Halliwell B,et al.Hydrogen sulfide is amediator of cerebral ischemic damage[J].Stroke,2006,37(3):889-93.
[4] Hu L F,Lu M,Tiong C X,et al.Neuroprotective effects of hydrogen sulfide on Parkinson′s disease ratmodels[J].Aging Cell,2010,9(2):135-46.
[5] Awata S,Nakayama K,Suzuki I,et al.Changes in cystathionine gamma-lyase in various regions of rat brain during development[J].Biochem Mol Biol Int,1995,35(6):1331-8.
[6] 宋扬文,陈 忻,张 楠,等.黄芩苷抑制鱼藤酮帕金森病大鼠黑质铁积聚及作用机制[J].中国药理学通报,2011,27(12):1740-4.
[6] Song YW,Chen X,Zhang N,et al.Inhibition on iron deposition in SN in PD rats by baicalin and itsmechanism[J].Chin Pharmacol Bull,2011,27(12):1740-4.
[7] Betarbet R,Sherer T B,MacKenzie G,et al.Chronic systemic pesticide exposure reproduces features of Parkinson′s disease[J].Nat Neurosci,2000,3(12):1301-6.
[8] Morrison L D,Smith D D,Kish S J.Brain S-adenosylmethionine levels are severely decreased in Alzheimer′s disease[J].JNeurochem,1996,67(3):1328-31.
[9] Wong P T,Qu K,Chimon G N,et al.High plasma cyst(e)ine levelmay indicate poor clinical outcome in patients with acute stroke:possible involvement of hydrogen sulfide[J].J Neuropathol Exp Neurol,2006,65(2):109-15.
[10]Ren C,Du A,Li D,et al.Dynamic change of hydrogen sulfide during global cerebral ischemia-reperfusion and its effect in rats[J].Brain Res,2010,1345,197-205.
[11]Stipanuk M H,Beck PW.Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat[J].Biochem J,1982,206(2):267-77.
[12]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator[J].JNeurosci,1996,16(3):1066-71.
[13]Patel P,Vatish M,Heptinstall J,et al.The endogenous production of hydrogen sulphide in intrauterine tissues[J].Reprod Biol Endocrinol,2009,7,10.
[14]Wang R.Two′s company,three′s a crowd:can H2S be the third endogenous gaseous transmitter[J]?FASEB J,2002,16(13):1792-8.
[15]尹蔚兰,何剑琴,方恒荣,等.甲醛对PC12细胞内源性H2S生成的影响[J].中国药理学通报,2011,27(7):957-60.
[15]Yin W L,He JQ,Fang H R,et al.Effect of formaldehyde on endogenous hydrogen sulfide production in PC12 cells[J].Chin Pharmacol Bull,2011,27(7):957-60.
[16]Whiteman M,Cheung N S,Zhu Y Z,etal.Hydrogen sulphide:a novel inhibitor of hypochlorous acid-mediated oxidative damage in the brain?[J].Biochem Biophys Res Commun,2005,326(4):794-8.
[17]Whiteman M,Armstrong JS,Chu SH,et al.The novel neuromodulator hydrogen sulfide:an endogenous peroxynitrite′scavenger′?[J].JNeurochem,2004,90(3):765-8.

