雾化吸入灭活草分枝杆菌降低哮喘小鼠核因子κB及细胞间黏附分子1的表达*
吕盛秋,李超乾,明莫瑜,罗智熹
(广西医科大学第一附属医院呼吸内科,广西南宁 530021)
雾化吸入灭活草分枝杆菌降低哮喘小鼠核因子κB及细胞间黏附分子1的表达*
吕盛秋,李超乾△,明莫瑜,罗智熹
(广西医科大学第一附属医院呼吸内科,广西南宁 530021)
目的:研究雾化吸入灭活草分枝杆菌对支气管哮喘小鼠气道炎症,以及哮喘肺组织中核因子κB (NF-κB)、细胞间黏附分子1(ICAM-1)和血管细胞黏附分子1(VCAM-1)的影响,探讨雾化吸入灭活草分枝杆菌防治哮喘的机制。方法:将24只雄性BALB/c小鼠按随机数字表法分为3组,每组8只:正常对照组(A)、哮喘模型组(B)和治疗组(C)。以鸡卵清蛋白致敏制造小鼠支气管哮喘模型。C组在激发后给予雾化吸入灭活草分枝杆菌治疗5 d,每天1次。各组动物处死后提取肺组织和支气管肺泡灌洗液(BALF)。进行病理HE染色及AB-PAS染色观察气道炎症浸润及黏液分泌情况,并行病理半定量分析。对BALF中炎症细胞进行分类计数。实时荧光定量PCR检测肺组织NF-κB、ICAM-1和VCAM-1的mRNA表达水平。结果:治疗组嗜酸性粒细胞比例低于模型组(P <0.05),气道炎症病变及黏液分泌情况较模型组减轻(P<0.05,P<0.01)。哮喘模型组的肺组织中NF-κB mRNA含量与正常组相比显著升高(P<0.01),而治疗组肺组织中的NF-κB mRNA含量明显低于模型组(P<0.05);模型组的ICAM-1 mRNA水平比正常组高(P<0.05),但治疗后明显降低(P<0.01);VCAM-1的mRNA水平在各组间无显著差异。相关性检验发现小鼠肺组织中VCAM-1的mRNA与ICAM-1的mRNA呈明显正相关(r=0.84,P <0.01),但NF-κB的mRNA与ICAM-1的mRNA、VCAM-1的mRNA无明显相关性(均P>0.05)。结论:雾化吸入草分枝杆菌对支气管哮喘小鼠气道炎症及黏液分泌有抑制作用;NF-κB参与哮喘发病过程,雾化吸入灭活草分枝杆菌降低哮喘小鼠的NF-κB水平。同时雾化吸入灭活草分枝杆菌可降低黏附分子尤其是ICAM-1的表达,是其控制炎症的另一个重要机制。
哮喘;灭活草分枝杆菌;NF-κB;细胞黏附分子
支气管哮喘是全球一个主要卫生问题。随着它的发病率和死亡率上升,糖皮质激素治疗支气管哮喘应用日益广泛,经常引起许多副作用,有必要开发具有更高疗效和更少副作用的新药。我们之前的研究发现灭活草分枝杆菌作为免疫调节剂能减轻支气管哮喘气道炎症,雾化吸入灭活草分枝杆菌可能作为一种方便安全、副作用少的支气管哮喘治疗方法[1]。而关于雾化吸入灭活草分枝杆菌治疗支气管哮喘的机制的研究仍在进行。
核因子κB(nuclear factor-kappa B,NF-κB)是一种调控基因表达的DNA结合蛋白,它位于Toll样受体(Toll-like receptors,TLRs)下游信号通路的枢纽位置,可通过调控细胞因子和黏附分子基因的表达,参与机体的各种炎症和免疫反应[2]。动物实验已证实TLR4/NF-κB可能参与哮喘大鼠气道炎症和气道重构[3],灭活草分枝杆菌可通过上调TLR2和TLR4的表达调节支气管哮喘的免疫失衡[4-5]。由此我们猜测位于下游的NF-κB亦会参与灭活草分枝杆菌治疗支气管哮喘的过程。而细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)参与调节炎症反应、免疫应答反应,是被研究最多的黏附分子。有报道称炎症细胞浸润主要是通过黏附分子的表达使白细胞向上皮细胞黏附增强所致[6]。肺气道上皮黏附分子如ICAM-1和VCAM-1上调常伴有炎症细胞浸润,是各种气道炎症性疾病发病机制的关键[7]。黏附分子的表达与NF-κB的活化有何关系?雾化吸入灭活草分枝杆菌是否可以降低哮喘肺组织中黏附分子的表达?是否通过NF-κB信号通路来降低哮喘小鼠肺组织中的ICAM-1和VCAM-1从而减轻哮喘炎症及黏液分泌?本实验拟通过检测哮喘小鼠肺组织中NF-κB、ICAM-1和VCAM-1的表达及雾化吸入灭活草分枝杆菌对其表达的影响,为阐明雾化吸入灭活草分枝杆菌治疗支气管哮喘的作用机制提供依据。
材料和方法
1 主要试剂与仪器
鸡卵清蛋白(ovalbumin,OVA;Sigma),氢氧化铝粉(分析纯,成都科龙化工试剂厂),草分枝杆菌F. U.36注射液(成都金星健康药业有限公司),瑞氏染色液,病理图像分析系统(Leica),Trizol Reagent(Invitrogen),逆转录试剂盒(Invitrogen),NF-κB、ICAM-1、VCAM-1和β-actin引物(上海生工公司),SYBR qPCR Mix(Toyobo),real-time PCR仪(Applied Biosystems),NanoDrop 2000超微量分光光度计(Nano-Drop),高速低温离心机(Eppendorf 5810R),超声雾化器WH-2000(广东粤华医疗器械厂),自制雾化吸入箱。1%戊巴比妥钠、10%甲醛、生理盐水、磷酸盐缓冲液(phosphate-buffered solution,PBS)等。
2 方法
2.1 小鼠支气管哮喘模型制作及分组健康雄性SPF级BALB/c小鼠,由广西医科大学实验动物中心提供,鼠龄6~8周,体重18~22 g,随机数字表法分为正常对照组(A组)、哮喘模型组(B组)和治疗组(C组),每组8只。模型组和治疗组均给予OVA制作小鼠哮喘模型;治疗组在造模成功后给予灭活草分枝杆菌雾化吸入,具体方法是:用OVA行腹腔注射致敏和雾化吸入激发建立哮喘模型,参照文献[8]略有改进,每只小鼠腹腔注射25 μg OVA和1 mg氢氧化铝(混合于0.2 mL PBS中),于第1天、第8天和第15天分别注射。OVA致敏后,于第22天开始激发,将小鼠置于自制20 cm×30 cm×20 cm密闭容器中,给予2%OVA·PBS 20 mL雾化吸入刺激,每天1次,每次20 min,连续7 d。正常对照组以PBS代替致敏原注射和雾吸刺激。治疗组在激发第7天后给予灭活草分枝杆菌溶液雾化吸入治疗,每天1次,治疗5 d。各组在末次激发后24 h内处死小鼠并取材。
2.2 标本收集小鼠于激发后24 h经眼球取血放血后行气管内插管,仰卧固定,用气管留置针行气管插管,缝线固定,以每次4℃0.5 mL PBS灌洗,缓慢注入肺内,轻柔回吸收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),反复注入、回抽3次,回收率>80%,BALF用EP管回收于冰上备用。打开胸腔,分离支气管肺组织,右肺迅速置入液氮冷冻后,保存在-80℃冰箱用于real-time PCR检测。左肺通过气管插管灌注10%甲醛使肺膨胀进行内固定,取出左肺组织浸入10%甲醛固定,24 h后漂洗、乙醇梯度脱水,经石蜡包埋,沿左肺门斜形平行切取肺组织切片,切片厚4 μm,行苏木精-伊红(hematoxylin-eosin,HE)及阿辛蓝(Alcian blue,AB)-过碘酸-雪夫(periodic acid-Schiff,PAS)染色。
2.3 支气管肺泡灌洗液细胞分类计数将BALF 4℃、1 500 r/min离心10 min,弃上清,取沉淀涂片行瑞氏-姬姆萨法染色,计数细胞总数,根据细胞形态特征和染色特点油镜下计数200个炎症细胞进行分类计数。
2.4 病理组织学检查和评分肺组织HE和PAS染色,光镜下观察大体组织病变和气道炎症细胞浸润、气道黏膜充血水肿情况、气道杯状细胞及气道黏液分泌情况。参照文献[9]的方法确定支气管周围炎症细胞浸润程度和计数杯状细胞着色、黏液分泌情况,进行病理半定量分析。评分如下:气道周围无炎症细胞(0分);少许炎症细胞(1分);较多分布不均的炎症细胞(2分);大量分布较均匀炎症细胞,少见聚集成团(3分);大量炎症细胞聚集成团(4分)。气道上皮无杯状细胞(0分);轻度上皮着色,杯状细胞<25%(1分);中度上皮着色,杯状细胞25%~50%(2分);重度上皮着色,杯状细胞50%~75%(3 分);上皮着色成团,杯状细胞>75%(4分)。
2.5 实时荧光定量PCR检测NF-κB、ICAM-1和VCAM-1 mRNA表达采用Trizol试剂提取肺组织总RNA,NanoDrop 2000超微量分光光度计检测浓度及A260/A280比值。按逆转录盒操作说明,将总RNA逆转录制备cDNA,-20℃保存。而后取2 μL cDNA作为反应模板,用SYBR Green核酸染料进行荧光定量PCR检测,β-actin为内参照。β-actin上游引物5'-AATTCCATCATGAAGTGTGA-3',下游引物5'-ACTCCTGCTTGCTGATCCAC-3',扩增产物200 bp;NF-κB上游引物5'-TCCGGGAGCCTCTAGTGAGAA-3',下游引物5'-TCCATTTGTGACCAACTGAACGA-3',扩增产物103 bp;ICAM-1上游引物5'-AACTGTGGCACCGTGCAGTC-3',下游引物5'-AGGGTGAGGTCCTTGCCTACTTG-3',扩增产物116 bp;VCAM-1上游引物5'-GCCACCCTCACCTTAATTGCTATG-3',下游引物5'-TGTGCAGCCACCTGAGATCC-3',扩增产物158 bp。PCR反应条件:β-actin(95℃30 s,95℃5 s,60℃31 s,40个循环);NF-κB(95℃30 s,95℃5 s,60℃31 s,40个循环);ICAM-1(95℃30 s,95℃5 s,60 ℃31 s,40个循环);VCAM-1(95℃30 s,95℃5 s,62℃31 s,40个循环)。反应结束后,记录每个样品管中的荧光强度增加到荧光阈值所对应的扩增循环数(Ct)。以β-actin为内参照,采用相对定量方法对所有样本进行归一化处理,计算目的基因mRNA的相对含量(目的基因mRNA/β-actin mRNA),再进行各组样品间相对量的比较。
3 统计学处理
数据以均数±标准误(mean±SEM)表示,采用SPSS 16.0软件分析。用One-way ANOVA比较组间差异,用SNK-q检验进行两两比较。病理半定量结果采用非参数秩和检验(Kruskal-Wallis检验)。采用Pearson或Spearmen相关性检验进行相关性分析。以P<0.05为差异有统计学意义。
结果
1 动物的哮喘症状表现
模型组小鼠在雾化激发时,出现躁动不安、抓耳挠腮、前肢短缩、打喷嚏、呼吸急促,甚至大小便失禁及腹肌强直等哮喘反应。正常对照组小鼠行为无以上反应,表现正常。
2 BALF中的细胞分类计数
模型组BALF中细胞总数、嗜酸性粒细胞、淋巴细胞和中性粒细胞比例增高,与正常对照组比较,差异显著(均P<0.01);治疗组细胞总数、嗜酸性粒细胞比例较哮喘模型组降低,差异显著(P<0.01或P<0.05),见表1。

表1 各组支气管肺泡灌洗液细胞分类计数Table 1.Cell counts in BALF of every group(Mean±SEM.n=8)
3 支气管肺组织病理观察
肺组织HE染色以及PAS染色可见,正常对照组气道上皮黏膜完整,纤毛排列整齐,基底膜及平滑肌层较薄,肺小血管内皮光滑,血管、气道周围无炎症细胞浸润,肺泡壁结构完整,杯状细胞少见,无黏液形成,见图1A1~2。哮喘组气道上皮细胞肿胀肥大,上皮不完整,黏膜皱襞增多,纤毛排列紊乱,甚至可见支气管黏膜断裂;细支气管及血管周围、肺泡腔、肺泡隔内大量炎症细胞浸润,以淋巴细胞和嗜酸性粒细胞为主,肺泡壁增厚,充血水肿,黏膜基底层明显增厚,平滑肌肥大增生。PAS染色可见气道上皮杯状细胞增生肥大,并有大量黏液形成,可见黏液栓,上皮脱落不完整,见图1B1~2。治疗组炎症浸润减轻,支气管管腔通畅,黏膜层完整,上皮细胞排列正常,PAS染色见杯状细胞及管腔内黏液分泌明显减少,见图1C1~2。气道炎症细胞浸润程度及黏液分泌情况病理评分半定量结果经非参数秩和检验示:模型组与对照组比较,差异显著(均P<0.01)。治疗组与模型组比较,差异显著(P<0.05,P<0.01),见表2。
4 肺组织NF-κB、ICAM-1及VCAM-1 mRNA的表达
治疗组肺组织NF-κB和ICAM-1 mRNA表达水平较哮喘模型组低,差异显著(P<0.05,P<0.01),治疗组肺组织VCAM-1 mRNA的表达水平较哮喘模型组低,但无显著差异(P>0.05),见图2。

Figure 1.Histological study of the lung tissues(HE and ABPAS staining,×400).A1~2:normal group;B1~2:OVA asthma model group;C1~2:inactivated Mycobacterium phlei-treated group.图1 小鼠肺组织HE染色和PAS染色
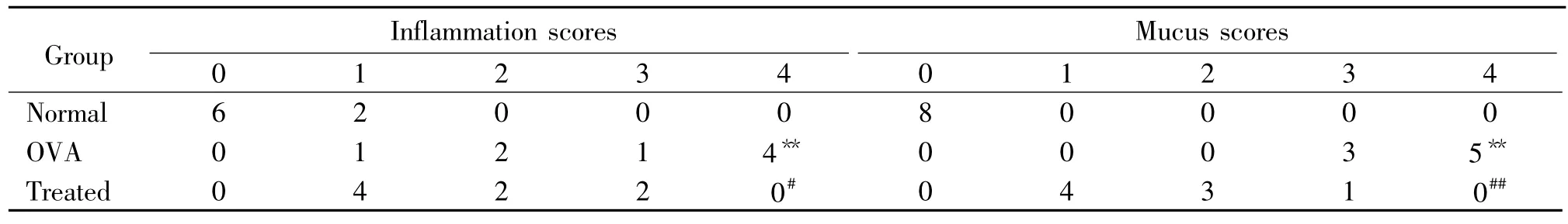
表2 气道炎症浸润及黏液分泌病理半定量评分Table 2.Pathological semi-quantitative scores of airway inflammation and mucus production(n=8)

Figure 2.The mRNA expression of ICAM-1,VCAM-1 and NF-κB in the lung tissues detected by real-time PCR.Mean±SEM.n=8.*P<0.05 vs normal group;#P<0.05,##P<0.01 vs OVA group.图2 实时荧光定量PCR测定ICAM-1、VCAM-1和NF-κB mRNA的表达
相关性检验:(1)NF-κB分别与炎症病理半定量分数、黏液分泌半定量分数呈显著正相关(rs= 0.62,P<0.01;rs=0.76,P<0.01),NF-κB mRNA还与BALF中的嗜酸性粒细胞数百分比呈显著正相关(r=0.70,P<0.01);(2)NF-κB、ICAM-1与VCAM-1分别与BALF细胞总数呈正相关(r=0.72,P<0.01;r=0.55,P<0.05;r=0.56,P<0.05); (3)NF-κB分别与ICAM-1、VCAM-1无明显相关性(均P>0.05),ICAM-1与VCAM-1呈显著正相关(r=0.84,P<0.01)。
讨论
哮喘是由多种炎症细胞、细胞因子和炎症介质参与的气道炎症性疾病。ICAM-1和VCAM-1均属于免疫球蛋白超家族黏附分子,对过敏性炎症的嗜酸性粒细胞积聚有重要的促进作用[10]。草分枝杆菌是一种免疫调节剂,吸入灭活草分枝杆菌在哮喘防治中具有抗炎作用[4],本实验中雾化吸入灭活草分枝杆菌有效降低哮喘导致的小鼠肺泡灌洗液中嗜酸性粒细胞数升高并减轻其气道炎症浸润程度及黏液分泌。再次证明雾化吸入灭活草分枝杆菌成功减轻哮喘小鼠的气道炎症,据此我们猜测其调节黏附分子的表达的能力可能是控制炎症的一个重要的机制。
众所周知,白细胞的迁移高度依赖内皮细胞所表达的黏附分子的结构,另外部分白细胞表现出特异的组织靶向也取决于组织表面表达黏附分子的结构[11]。Andersson等[12]发现人脐静脉血管内皮细胞ICAM-1表达增加具有促进炎症细胞向肺组织迁移的潜能。另外,ICAM-1在内皮细胞与白细胞相互作用、白细胞向炎症部位迁移以及抗原呈递细胞间的相互作用中至关重要,它可作为抗原呈递细胞刺激T淋巴细胞活化,还可作为细菌性发病机制的辅助因子[13]。Lee等[7]的研究也发现在哮喘小鼠中ICAM-1和VCAM-1水平升高,并调节炎症细胞迁移。体内外的研究证实肺泡上皮ICAM-1的表达增加可以提高中性粒细胞和巨噬细胞的黏附,并且对过敏性炎症的嗜酸性粒细胞积聚有重要的促进作用[10,14],可见细胞黏附分子是肺部炎症疾病募集白细胞的重要介质。本实验中哮喘组肺组织的黏附分子水平特别是ICAM-1明显升高,并且ICAM-1、VCAM-1与BALF中细胞总数呈正相关,黏附分子积极参与支气管哮喘气道炎症发生过程,可能有促进炎症的作用。而雾化吸入灭活草分枝杆菌治疗后肺组织的黏附分子特别是ICAM-1水平显著降低,因此雾化吸入灭活草分枝杆菌可通过降低黏附分子尤其是ICAM-1的表达来参与控制炎症,是其控制炎症的一个重要机制。但是,使支气管肺组织黏附分子上调的机制又是什么呢?
近年发现,NF-κB在哮喘气道炎症中的作用亦十分关键。在哮喘的气道炎症反应中,IL-1β、TNF-α、IL-8、单核细胞趋化蛋白1、ICAM-1、粒-单细胞集落刺激因子和诱导型一氧化氮合酶等众多细胞因子和炎症介质在基因转录水平上均受NF-κB调控,NF-κB活化后这些细胞因子和介质的基因表达和蛋白分泌均增高[15]。目前研究证实,在哮喘患者和哮喘的动物模型中,肺组织和气道上皮细胞、肺泡巨噬细胞的NF-κB活性增高。本实验哮喘小鼠肺组织中的NF-κB水平较正常小鼠明显升高,经灭活草分枝杆菌治疗后NF-κB水平显著下降,哮喘炎症减轻,哮喘小鼠肺组织中NF-κB mRNA与嗜酸性粒细胞数百分比、气道炎症浸润及黏液分泌呈显著正相关,NF-κB的活化可能促进哮喘小鼠气道炎症。灭活草分枝杆菌治疗哮喘的机制与降低NF-κB水平有关。NF-κB的水平或许可以作为评判疾病严重程度或评估疗效的一个替代指标。
NF-κB信号通路参与哮喘中气道平滑肌细胞增殖[16]。同时,在细胞水平的研究发现通过抑制MAPKs和Akt氧化磷酸化,抑制NF-κB活化,从而抑制TNF-α诱导人支气管上皮细胞ICAM-1和VCAM-1的产生,减少单核细胞和嗜酸性粒细胞向支气管上皮细胞黏附,说明气道炎症中ICAM-1和VCAM-1的表达水平与NF-κB/MAPK/Akt依赖性信号通路有关[17-18]。之前我们猜测雾化吸入灭活草分枝杆菌可通过NF-κB信号途径降低黏附分子表达从而减轻哮喘炎症,而本实验却发现NF-κB与ICAM-1、VCAM-1均无明显相关性。原因可能是除NF-κB外,还存在其它转录因子或信号途径如Sp1、GATA、PKC、STAT1等相关机制的参与影响哮喘中黏附分子的表达,以致灭活草分枝杆菌不能通过NF-κB信号途径完全抑制哮喘导致的黏附分子的升高,也有可能是各信号途径相关机制在哮喘不同时期对其影响程度有所差异,此间机制仍待进一步研究。
[1]Ming M,Li C,Luo Z,et al.Effect of inhaled inactivated Mycobacterium phlei in children with moderate asthma [J].Immunotherapy,2013,5(2):191-197.
[2]Blackwell TS,Christman JW.The role of nuclear factorkappa B in cytokine gene regulation[J].Am J Respir Cell Mol Biol,1997,17(1):3-9.
[3]韦江红,莫碧文,黄剑伟.Toll样受体4/核因子-κB对哮喘大鼠气道炎症和重构的影响[J].中国病理生理杂志,2011,27(5):962-967.
[4]张景鸿,李超乾,郭素娟,等.雾化吸入灭活草分支杆菌减轻哮喘小鼠气道炎症及对Toll样受体2表达的影响[J].免疫学杂志,2012,8(1):19-23.
[5]姚斌,庞李张.草分枝杆菌F.U.36对哮喘小鼠调节性T细胞和TLR4表达的影响[J].中国当代儿科杂志,2011,13(11):917-920.
[6]Rosseau S,Selhorst J,Wiechmann K,et al.Monocytemigration through the alveolar epithelial barrier:adhesion molecule mechanisms and impact of chemokines[J].J Immunol,2000,164(1):427-435.
[7]Lee KS,Jin SM,Kim HJ,et al.Matrix metalloproteinase inhibitor regulates inflammatory cell migration by reducing ICAM-1 and VCAM-1 expression in a murine model of toluene diisocyanate-induced asthma[J].J Allergy Clin Immunol,2003,111(6):1278-1284.
[8]North ML,Khanna N,Marsden PA,et al.Functionally important role for arginase 1 in the airway hyperresponsiveness of asthma[J].Am J Physiol Lung Cell Mol Physiol,2009,296(6):L911-L920.
[9]Asano T,Kume H,Taki F,et al.Thalidomide attenuates airway hyperresponsiveness and eosinophilic inflammation in a murine model of allergic asthma[J].Biol Pharm Bull,2010,33(6):1028-1032.
[10]Nagata M,Sedgwick JB,Kita H,et al.Granulocyte macrophage colony-stimulating factor augments ICAM-1 and VCAM-1 activation of eosinophil function[J].Am J Respir Cell Mol Biol,1998,19(1):158-166.
[11]王袁园,周明辉,娄卫华.VCAM-1表达在上下呼吸道一致性的研究[J].临床耳鼻咽喉头颈外科杂志,2009,23(11):506-507.
[12]Andersson K,Shebani EB,Makeeva N,et al.Corticosteroids and montelukast:effects on airway epithelial and human umbilical vein endothelial cells[J].Lung,2010, 188(3):209-216.
[13]Hubbard AK,Rothlein R.Intercellular adhesion molecule-1(ICAM-1)expression and cell signaling cascades [J].Free Radic Biol Med,2000,28(9):1379-1386.
[14]Beck-Schimmer B,Madjdpour C,Kneller S,et al.Role of alveolar epithelial ICAM-1 in lipopolysaccharide-induced lung inflammation[J].Eur Respir J,2002,19 (6):1142-1150.
[15]Barnes PJ,Adcock IM.NF-kappa B:a pivotal role in asthma and a new target for therapy[J].Trends Pharmacol Sci,1997,18(2):46-50.
[16]许淑云,徐永健,张珍祥,等.核因子κB在蛋白激酶C诱导哮喘模型大鼠气道平滑肌细胞增殖中的作用[J].中国病理生理杂志,2007,23(11):2217-2221.
[17]Jung J,Ko SH,Yoo DY,et al.5,7-Dihydroxy-3,4,6-trimethoxyflavone inhibits intercellular adhesion molecule 1 and vascular cell adhesion molecule 1 via the Akt and nuclear factor-κB-dependent pathway,leading to suppression of adhesion of monocytes and eosinophils to bronchial epithelial cells[J].Immunology,2012,137(1):98-113.
[18]Jang JH,Yang ES,Min KJ,et al.Inhibitory effect of butein on tumor necrosis factor-α-induced expression of cell adhesion molecules in human lung epithelial cells via inhibition of reactive oxygen species generation,NF-κB activation and Akt phosphorylation[J].Int J Mol Med,2012,30(6): 1357-1364.
Inhalation of inactivated Mycobacterium phlei down-regulates expression of nuclear factor-kappa B and intercellular adhesion molecule-1 in asthmatic mice
LÜ Sheng-qiu,LI Chao-qian,MING Mo-yu,LUO Zhi-xi
(Department of Respiratory Medicine,The First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China.E-mail:2534776680@qq.com)
AIM:To investigate the effect of inhalation of inactivated Mycobacte-rium phlei on the expression of nuclear factor-kappa B(NF-κB),intercellular adhesion molecule(ICAM)-1 and vascular cell adhesion molecule (VCAM)-1 in the lung tissues of asthmatic mice.METHODS:Male BALB/c mice(n=24)were randomly divided into normal control group(A),asthmatic model group(B),and inactivated Mycobacterium phlei inhalation group(C).Asthmatic model was made by inhalation of chicken ovalbumin.The mice in group C were treated with inactivated Mycobacterium phlei for 5 d.The lung tissues and bronchoalveolar lavage fluid(BALF)were harvested.HE and AB-PAS staining were used to measure the lung inflammation and mucus production.The inflammatory cells in the BALF were counted.The mRNA expression of NF-κB,ICAM-1 and VCAM-1 was detected by real-time fluorescence quantitative PCR.RESULTS:Mycobacterium phlei treatment alleviated lung inflammation,attenuated mucus production,and reduced the percentage of eosinophils in the BALF.The mRNA levels of NF-κB and ICAM-1 were significantly decreased after treated with Mycobacterium phlei.However,no significant difference of VCAM-1 mRNA expression was found before and after treatment.The cor-relation between NF-κB mRNA and ICAM-1 mRNA,and between NF-κB mRNA and VCAM-1 mRNA was not found.CONCLUSION:Inhalation of inactivated Mycobacterium phlei attenuates asthmatic airway inflammation.NF-κB participates in the pathogenesis of asthma.NF-κB signal pathway may be associated with the therapeutic mechanism.Another important mechanism is the reduction of adhesion molecule expression.
Asthma;Inactivated Mycobacterium phlei;NF-kappa B;Cell adhesion molecules
R363
A
10.3969/j.issn.1000-4718.2014.02.025
1000-4718(2014)02-0333-06
2013-09-14
2013-11-26
国家自然科学基金资助项目(No.81360007)
△通讯作者Tel:0771-5358397;E-mail:2534776680@qq.com

