Box-Behnken响应面法优化他克莫司传递体制备工艺*
雷伟,余楚钦,林华庆,周小圆
(广东药学院,广东省药物新剂型重点实验室,广州 510006)
·药物制剂与药品质量控制·
Box-Behnken响应面法优化他克莫司传递体制备工艺*
雷伟,余楚钦,林华庆,周小圆
(广东药学院,广东省药物新剂型重点实验室,广州 510006)
目的 确定他克莫司传递体的最优处方工艺。方法以包封率、粒径作为响应值,采用Box-Behnken响应面法优化处方,并评价其理化性质。结果最优处方工艺是药脂比为0.06,聚山梨酯80∶蛋黄卵磷脂为0.31,超声时间9.5 min,制备的传递体包封率为85.930%,粒径为101.8 nm,具备一定的体外形变能力和稳定性。结论Box-Behnken响应面法能准确地优化他克莫司传递体的处方工艺。
他克莫司;传递体;Box-Behnken响应面法;制备工艺
他克莫司(tacrolimus,FK506)软膏(商品名:普特彼®)于2002年被批准用于治疗中到重度特应性皮炎[1]。但由于FK506的强亲脂性(油水分配系数logP=3.96±0.83)、大分子量(相对分子质量822.05)及其环状分子结构,软膏中的药物主要潴留在皮肤角质层中,无法到达深层皮肤组织发挥药效[2]。传递体(transfersomes)由德国学者GREGOR等[3]首次提出,它是将表面活性剂(如聚山梨酯80、胆酸钠等)加入普通脂质体材料中制成具有很强的自身形变能力,可穿透比它本身小数倍的皮肤孔道的类脂质体。笔者在本实验中将FK506包裹于传递体中,采用Box-Behnken响应面法以较少的实验次数和较短的时间[4]对他克莫司传递体的处方工艺参数进行全面有效的优化,同时考察其体外变形能力及稳定性,为以后他克莫司传递体经皮渗透研究打下基础。
1 仪器与试药
1.1 仪器 Ultimate 3000高效液相色谱仪(美国Dinonex公司),超声波细胞粉碎仪(宁波新芝生物科技股份有限公司),JEM-1400透射电镜(日本JEOL电子公司),DelsaTMNano C粒径仪(美国Beckman Coulter有限公司),LSP01-1A单推注射泵(兰格注射泵有限公司)。
1.2 试药 他克莫司对照品(上海同田生物技术股份有限公司,纯度:99.4%,批号:12033031),他克莫司原料药(华东医药有限公司,纯度:98.0%,批号:091001),蛋黄卵磷脂(Lipoid E80,PC,上海东尚生物科技有限公司提供,批号:F20100021),其余试剂均为分析纯。
2 方法与结果
2.1 他克莫司传递体的制备 采用薄膜蒸发-探头式超声分散法制备。称取处方量蛋黄卵磷脂、聚山梨酯80(分析纯)、他克莫司置于圆底烧瓶,无水乙醇溶解完全,35℃水浴旋转挥干乙醇使成均一类脂薄膜。然后往圆底烧瓶中加入pH6.5 PBS水合介质20 mL,旋转洗膜1 h,冰水浴下探头式超声处理(超声2 s,停2s),孔径0.20 μm微孔滤膜过滤,即得到带淡蓝色乳光的传递体混悬液。
2.2 传递体的含量和包封率测定
2.2.1 含量测定方法 色谱柱:Agilent公司ZORBAX SB-C8(4.6 mm×250 mm,5 μm);流动相:0.1%磷酸∶乙腈(40∶60);柱温:60℃;检测波长:210 nm;流速:1.0 mL·min-1;进样量:20 μL。
取他克莫司对照品20 mg精密称定,置20 mL量瓶,配成贮备液,吸取贮备液1 mL,用流动相稀释至10 mL,得100 μg·mL-1对照品溶液,调节进样体积分别为1,2,5,10,40,80 μL,以峰面积(A)对质量浓度(C)作线性回归,得回归方程为A=0.285 1C-0.516 7,r=0.999 8,在5~400 μg·mL-1浓度范围内具有良好的线性关系。精密吸取空白传递体1.0 mL置于10 mL量瓶,依次加入贮备液0.8,1.0,1.2 mL,甲醇破乳,每个浓度平行配置3份,测得80,100, 120 μg·mL-1回收率,结果均在95%~105%范围内, RSD均<2%。取他克莫司传递体混悬液1 mL置于10 mL量瓶,甲醇破乳,得供试品溶液,供试品溶液在12 h内稳定,日内精密度实验RSD值<2%(n=6), HPLC测定方法准确可靠。

2.3 Box-Behnken响应面法优化处方工艺
2.3.1 优化实验设计 采用Box-Behnken响应面法优化他克莫司传递体制备的处方工艺。采用Design-Expert®设计软件,以包封率(Y1,%)、粒径(Y2,nm)为优化指标,根据预实验及最高或最低条件下制备传递体的可行性,选取药脂比(药物∶PC,X1,质量比)、聚山梨酯80∶PC(X2,质量比)、超声时间(X3,min)作为考察对象,3个设计水平代码分别为0,+1,-1,设计3因素、3水平、17个实验点的响应面优化实验,响应面因素水平见表1。
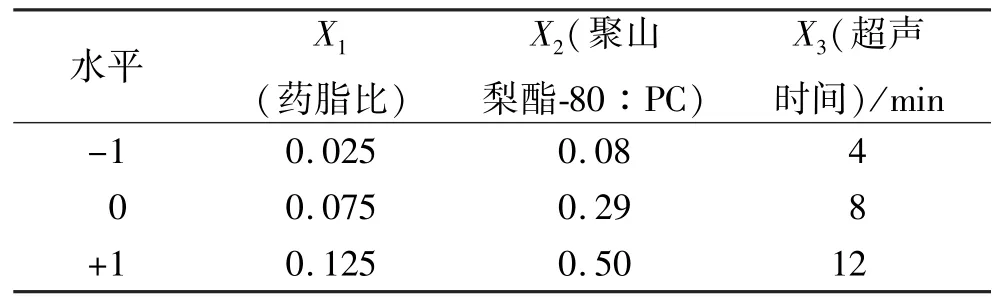
表1 响应面因素水平表Tab.1 Factors and levels of response surface method
2.3.2 回归模型拟合及预测 对包封率(Y1)、粒径(Y2)进行回归分析,建立多元二次回归模型:Y=b0+ b1X1+b2X2+b3X3+b12X1X2+b13X1X3+b23X2X3+其中,Y为响应值;b0为常数项, b1、b2、b3为线性系数,b12、b13、b23为相互项系数,b11、b22、b33为平方项系数。
根据回归模型,绘制三维效应面图,从每一个效应面均可以得到一个较优的实验条件范围,几个较优的实验条件进一步重叠,即可获得最优条件。
2.3.3 结果验证 根据优化设计获得的最优条件制备3批样品,将指标的实验值与预测值进行比较,计算偏差。17次实验设计表及响应值见表2。
2.4 形态观察 将优化得到的传递体混悬液用PBS稀释10倍,滴到铜网上,放置约1 min以便使传递体吸附,用滤纸吸去多余液体,用2%磷钨酸溶液负染1 min,滤纸吸去多余染色液,干燥后用透射电子显微镜观察传递体形态。
2.5 粒径分布测定 粒径测定使用Beckerman粒径仪。传递体混悬液用PBS稀释1倍,测定温度为25℃。
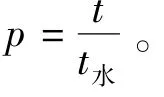
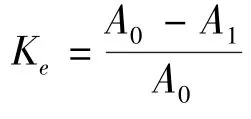
3 结果
3.1 优化实验结果及模型拟合 Box-Behnken响应面法实验设计方案及结果见表2,用Design-Expert 8.0.4版软件对结果进行分析,以包封率和粒径两个评价指标分别对3个因素进行多元二项式方程拟合,二项式方程分别为:
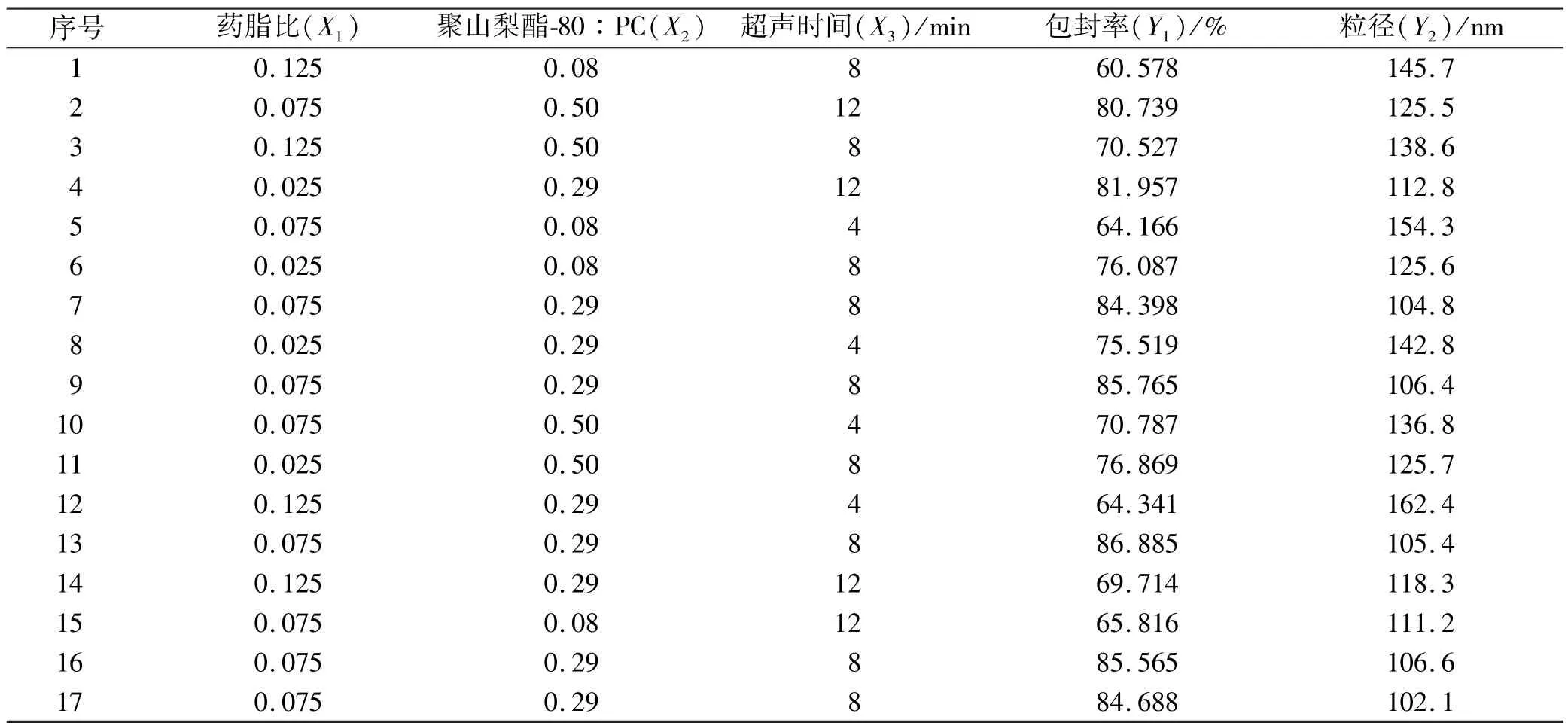
表2 Box-Behnken响应面法设计方案及结果Tab.2 Designs and results of Box-Behnken response surface method

3.2 效应面优化及预测 根据拟合方程绘制描述各因素与指标之间关系的效应曲面,结果见图1。从效应面的最高点可以看出所选范围存在极值,可以直观地判断各因素的最优范围。他克莫司为亲脂性药物,主要分布于脂质体膜的双分子层结构中,固定超声8 min,随着药脂比逐渐增大,包封率相应增大,药物在传递体中的分布逐渐达到饱和状态,继续增加药物,超出磷脂的承载能力,使传递体的双层结构破坏,传递体容易发成融合,包封率降低,粒径增大,优化的药脂比范围为0.03~0.08。聚山梨酯80作为表面活性剂,主要嵌插于传递体膜中,增强膜的流动性,使得膜弹性形变增大。一定浓度的聚山梨酯80可增加他克莫司在传递体混悬液中的溶解度,且使传递体具有较大的形变能力,易于破裂成小粒子,但随着表面活性剂浓度进一步增加,易形成混合胶团,降低对药物的包载能力,同时整个体系的粒径变大[8],聚山梨酯80∶PC值在0.25~0.40范围较适宜。粒径受超声时间长短影响最明显,超声时间越长,粒径越小,但同时也会引起传递体中药物的泄漏,导致包封率的降低,超声时间控制在8~11 min内,可得到适宜的粒径范围90~130 nm。

表3 二项式方程模型的显著性分析Tab.3 Significance analysis of binomial equation model

图1 各自变量与包封率、粒径的效应面图Fig.1 Response surfaces of entrapment efficiency and particle diameter with independent variables
使用Design-Expert 8.0.4版软件根据响应面曲线预测出他克莫司传递体的最优处方:X1=0.06、X2= 0.31、X3=9.5,即PC 0.800 g、他克莫司48 mg、聚山梨酯80 0.248 g、PBS 20 mL,超声处理9.5 min。按此处方分别制备3批传递体,其实验平均值与预测值的比较见表4,平均包封率85.930%,平均粒径101.8 nm,相对偏差均<5%,各实验值与预测值吻合良好,证明了用效应面法获得的优化区域比较准确。其中,偏差(%)=(实验值-预测值)/预测值×100%。
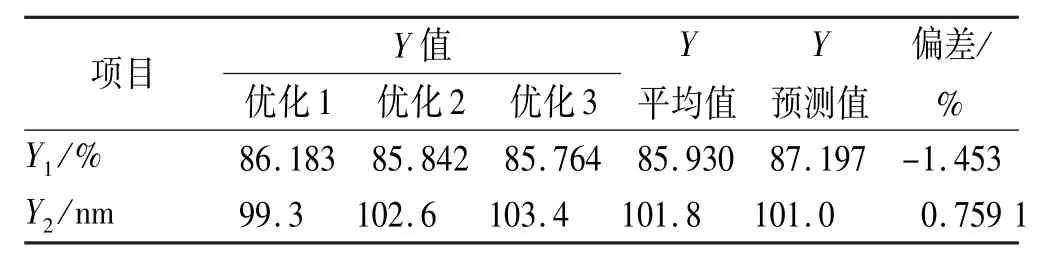
表4 优化实验结果验证Tab.4 Verification of response surface methodology n=3
3.3 传递体粒径及电镜观察结果 优化实验得到的传递体混悬液略带淡蓝色,粒径分布范围窄,呈正态分布,平均粒径101.8 nm,多分散性指数为0.299(图1)。透射电镜下呈椭圆形,有指纹状螺旋,具有明显的脂膜包裹形态(图2)。
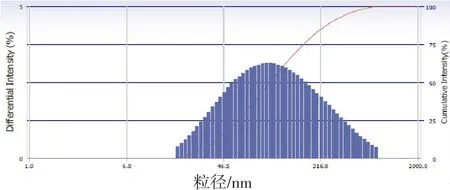
图2 他克莫司传递体的粒径分布图Fig.2 Size distribution of tacrolimus transfersomes
3.4 变形性 在0.2 MPa外力作用下,普通脂质体、传递体、水通过滤膜的时间分别为306,184和120 s,即P脂质体=2.550,P传递体=1.533,这说明,相比于普通脂质体,传递体中表面活性剂聚山梨酯80的存在可促进脂质体结构的变形,使之更易通过滤膜,为后期将传递体用作透皮转运载体,将大分子药物送入深层皮肤组织提供了体外实验依据。
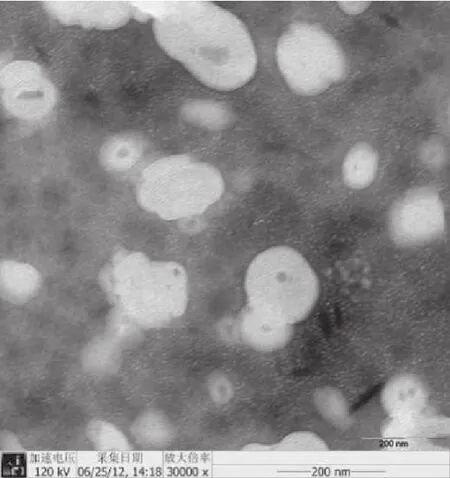
图3 他克莫司传递体的透射电镜照片(×30 000)Fig.3 TEM photograph of tacrolimus transfersomes at amplification of 30 000 times
3.5 加速稳定性 加速稳定性实验中,A0=0.486,A1=0.455,得Ke=0.0637,离心前后吸光度值变化很小,说明传递体混悬液具有一定的稳定性。
4 讨论
常用的包封率测定方法有葡聚糖凝胶柱层析法[9]、离心法[10]、透析法,这三种方法本实验中均有尝试。由于他克莫司难溶于水,用水洗脱时容易析出结晶,在凝胶柱中保留时间短,导致载药传递体与游离药物很难完全分离,该法不适宜用于他克莫司传递体包封率的测定。同时,采用超速冷冻离心法,4℃离心, (35 000 r·min-1,3 h),游离药物与载药传递体完全分离,包封率测定结果与透析法接近,但由于本实验室不具备超速冷冻离心机,综合考虑,最终选用透析法测定他克莫司传递体的包封率。
笔者在前期处方筛选实验中发现,不同的表面活性剂对传递体的影响不一。其中,包封率:聚山梨酯-80>胆酸钠>司盘-80,粒径:聚山梨酯-80≈胆酸钠>司盘-80。用司盘-80作为表面活性剂,传递体混悬液分层明显,超声分散后粒径仍然很大。ELMAGHRABY等[11]实验发现,不同表面活性剂的亲水亲油平衡值(HLB值)不同,在脂质相与水相的亲和分布能力也不一样,因而其与类脂质膜相互作用能力大小也有差异。司盘-80(HLB=4.3)亲脂性最强,与药物竞争性插于类脂质膜中,扰乱了脂质双分子层结构,容易造成类脂结构的破坏和药物的泄漏。不同表面活性种类是否会对传递体透皮性能产生影响,还需进一步考察研究。
[1] FLEISCHER J A B,ABRAMOVITS W,BRENEMAN D,et al.Tacrolimus ointment is more effective than pimecrolimus cream in adult patients with moderate to very severe atopic dermatitis[J].J Dermatolog Treat,2007,18(3):151-157.
[2] GOEBEL A S,NEUBERT R H,WOHLRAB J.Dermal targeting of tacrolimus using colloidal carrier systems[J].Int J Pharm,2011,404(1-2):159-168.
[3] CEVC G,BLUME G,SCHATZLEI A,et al.The skin:a pathway for systemic treatment with patches and lipid based agent carriers[J].Adv Drug Del Rev,1996,18(3):349-378.
[4] ABDUL A,AQIL M,KOHLI K,et al.Formulation and optimization of nanotransfersomes using experimental design technique for accentuated transdermal delivery of valsartan [J].Nanomedicine,2012,8(2):237-249.
[5] MURA P,MAESTRELLI F,GONZALEZ-RODRIGUEZ M L,et al.Development,characterization and in vivo evaluation of benzocaine-loaded liposomes[J].Eur J Pharm Biopharm,2007,67(1):86-95.
[6] KUMAR A,PATHAK K,BALI V.Ultra-adaptable nanovesicular systems:a carrier for systemic delivery of therapeutic agents[J].Drug Discov Today,2012,17(21-22):1233-1 241.
[7] 吴骏,朱家壁.阿昔洛韦脂质体的制备和稳定性的初步考察[J].药学学报,2003,38(7):552-554.
[8] JAIN S,JAIN P,UMAMAHESHWARI R B,et al.Transfersomes——a novel vesicular carrier for enhanced transdermal delivery:development,characterization,and performance evaluation[J].Drug Dev Ind Pharm,2003,29(9):1013-1026.
[9] BERGER N,SACHSE A,BENDER J,et al.Filter extrusion of liposomes using different devices:comparison of liposome size,encapsulation efficiency,and process characteristics [J].Int J Pharm,2001,223(1-2):55-68.
[10] XU Q,TANAKA Y,CZERNUSZKA J T,et al.Encapsulation and release of a hydrophobic drug from hydroxyapatite coated liposomes[J].Biomaterials,2007,28(16):2687-2694.
[11] ELMAGHRABY G M,WILLIAMS A C,BARRY B W.Oestradiol skin delivery from ultradeformable liposomes:refinement of surfactant concentration[J].Int J Pharm,2000,196 (1):63-74.
DOI 10.3870/yydb.2014.03.024
Optimized Preparation of Tacrolimus Transfersomes by Box-Behnken Response Surface Method
LEI Wei,YU Chu-qin,LIN Hua-qing,ZHOU Xiao-yuan
(Guangdong Pharmaceutical University,Guangzhou Provincial Key Laboratory of Advanced Drug Delivery,Guangzhou 510006,China)
Objective To determine the optimal process for the preparation of tacrolimus transfersomes.MethodsThe preparation of tacrolimus transfersomes was optimized via the Box-Behnken response surface method with entrapment efficiency and diameters as responding indicators,and their physicochemical properties were evaluated.ResultsThe optimized technical parameters were as follows:drug-lipid as 0.06;polysorbate80-PC as 0.31;ultrasonic for 9.5 min.The encapsulation efficiency and diameters of the optimized tacrolimus transfersomes were 85.930%and 101.8 nm,respectively.Tacrolimus transfersomes had a certain deformation ability and stability.ConclusionBox-Behnken response surface method could accurately optimize the preparation of tacrolimus transfersomes.
Tacrolimus;Transfersomes;Box-Behnken response surface method;Optimized preparation
R979.5;TQ460.1
A
1004-0781(2014)03-0355-06
2013-02-19
2013-03-20
*药物制剂关键技术研发及产业化示范(2008A1-E4101)
雷伟(1989-),女,湖北荆州人,在读硕士,主要研究方向:药物新剂型与新技术。电话:020-39352518,E-mail:leiwei-1234@163.com。
林华庆,男,教授,硕士生导师,主要从事药物新剂型与新技术研究及产业化开发。电话:020-39352518,E-mail:huaqing_@163.com。

