二倍体和四倍体杂交兰幼苗对低温胁迫的生理响应差异分析
王园园,叶志琴,刘 容,王广东
(南京农业大学园艺学院,江苏南京210095)
二倍体和四倍体杂交兰幼苗对低温胁迫的生理响应差异分析
王园园,叶志琴,刘容,王广东①
(南京农业大学园艺学院,江苏南京210095)
为探究不同倍性杂交兰(Cymbidium hybrid)对低温胁迫的生理响应差异,对低温胁迫下(昼温10℃、夜温4℃)二倍体杂交兰以及四倍体杂交兰株系T1和T2幼苗叶片中脯氨酸、可溶性糖、可溶性蛋白质、MDA和叶绿素含量,产生速率以及SOD、POD和CAT活性的动态变化进行了测定和分析;在此基础上,比较了二倍体和四倍体杂交兰的耐低温特性差异。结果显示:随着胁迫时间的延长,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中脯氨酸、可溶性糖、可溶性蛋白质和MDA含量,产生速率以及POD和CAT活性总体呈逐渐增加的趋势;叶绿素含量呈逐渐下降的趋势;SOD活性呈先上升后下降的趋势,并分别在胁迫后第9天和第6天达到峰值。在常温(25℃)下恢复生长3 d后,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中脯氨酸、可溶性糖、可溶性蛋白质和MDA含量,产生速率以及SOD、POD和CAT活性均降低,而叶绿素含量升高。总体上,二倍体杂交兰叶片中脯氨酸、可溶性糖和可溶性蛋白质含量以及SOD、POD和CAT活性的增幅明显小于四倍体杂交兰,MDA含量和产生速率的增幅则大于四倍体杂交兰,而叶绿素含量的降幅则明显大于四倍体杂交兰。综合分析结果表明:在低温胁迫下,四倍体杂交兰叶片中渗透调节物质含量和保护酶活性均较高,其对低温的耐性强于二倍体杂交兰。
杂交兰;二倍体;四倍体;低温胁迫;渗透调节物质;抗氧化酶活性
杂交兰(Cymbidium hybrid)是兰属(Cymbidium Sw.)温带地生种和热带附生种杂交后形成的后代,具备亲本的优点,观赏价值高,为重要的兰花产品之一[1]。但与大花蕙兰(兰属附生种反复杂交形成的品种)相比,杂交兰品种相对较少,因而,培育优良杂交兰新品种是丰富兰花品种的途径之一[2]。受冬、春季低温影响,兰花长势缓慢,严重影响其营养积累及开花[3],因此,培育耐低温的杂交兰新品种可以改善低温期其生长状态、缩短生产周期。
植物多倍体通常具有植株巨大、内含物增多和抗逆性增强等特性[4-5],并在一定程度上可增强其观赏价值和商品价值[6],例如:扬花萝卜(Raphanus sativus‘Radculus’)[7]、西瓜〔Citrullus lanatus(Thunb.) Matsum.et Nakai〕[8]、何首乌(Polygonum multiflorum Thunb.)[9]、生姜(Zingiber officinale Rosc.)[10]和不结球白菜(Brassica campestris ssp.chinensis Makino)[11]等植物的多倍体均有这些特性,但兰科(Orchidaceae)植物的多倍体是否具有这些特性尚未见报道。
作者研究了二倍体和四倍体杂交兰植株对低温胁迫的生理响应,以明确二倍体杂交兰和四倍体杂交兰抗低温特性的差异,并探明染色体加倍对杂交兰抗低温特性的影响,以期为抗低温杂交兰的育种及低温季节杂交兰的温室栽培提供理论依据。
1 材料和方法
1.1材料
供试二倍体杂交兰为本实验室采用杂交兰品种‘韩国桃花’(Cymbidium hybrid‘Korea peach’)与蕙兰(C.faberi Rolfe)杂交后筛选获得,2n=2x=40[12];四倍体杂交兰株系T1和T2由二倍体杂交兰根状茎通过秋水仙素诱导加倍后获得,2n=4x=80[13]。
1.2方法
1.2.1低温处理方法 从生长3个月的二倍体杂交兰、四倍体杂交兰株系T1和T2幼苗中各选取45株,移至温度25℃、光照度1 000 lx、光照时间16 h·d-1的GXZ型智能光照培养箱(宁波江南仪器厂)中生长15 d,然后于昼/夜温度10℃/4℃、光照度1 000 lx、光照时间12 h·d-1条件下低温处理12 d,再置于温度25℃、光照度1 000 lx、光照时间12 h·d-1条件下培养3 d。从低温处理开始,分别在处理0、3、6、9、12和15 d的8:00至10:00取样。二倍体杂交兰、四倍体杂交兰株系T1和T2各随机取6株,采集从上往下第5片叶,混合后分成3份(即3次重复),用于指标测定。
1.2.2生理指标测定方法 采用酸性茚三酮法[14]测定脯氨酸含量;采用蒽酮比色法[12]测定可溶性糖含量;采用考马斯亮蓝法[15]测定可溶性蛋白质含量;采用TCA-TBA法[16]测定MDA含量;采用乙醇浸提法[17]测定叶绿素含量;参照Ke等[18]的方法测定超氧阴离子自由基(O-·2)产生速率;采用氮蓝四唑(NBT)光还原法[19]测定超氧化物歧化酶(SOD)活性;采用愈创木酚显色法[20]测定过氧化物酶(POD)活性;参照Aebi[21]的方法测定过氧化氢酶(CAT)活性。各指标均重复测定3次,结果取平均值。
1.3数据处理
采用EXCEL 2007和SPSS 13.0统计分析软件进行实验数据的统计分析。
2 结果和分析
2.1低温胁迫条件下二倍体和四倍体杂交兰幼苗生长差异分析
低温胁迫前,二倍体和四倍体杂交兰幼苗均生长正常,二倍体杂交兰幼苗叶片呈嫩绿色,四倍体杂交兰株系T1和T2幼苗叶片均为深绿色。低温胁迫12 d后,二倍体杂交兰幼苗心叶枯萎死亡,四倍体杂交兰株系T1幼苗叶尖焦枯且叶片轻微变黄,而四倍体杂交兰株系T2的少数叶尖焦枯且颜色无明显变化。
2.2二倍体和四倍体杂交兰幼苗对低温胁迫的生理响应差异分析
2.2.1叶片中渗透调节物质含量的变化 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中脯氨酸、可溶性糖和可溶性蛋白质含量的动态变化见图1。
如图1-A所示:在低温胁迫过程中,二倍体和四倍体杂交兰幼苗叶片中脯氨酸含量均呈缓慢上升的趋势。处理前,二倍体和四倍体杂交兰幼苗叶片中脯氨酸含量差异较小,低温处理结束时,脯氨酸含量均达到最大值,其中四倍体杂交兰株系T1和T2幼苗叶片中脯氨酸含量分别较低温处理前提高了95.2%和103.8%,分别为同一时间二倍体杂交兰的1.2和1.3倍。常温下恢复生长3 d后(处理第15天),供试杂交兰幼苗叶片中脯氨酸含量急剧下降,其中二倍体杂交兰叶片中脯氨酸含量基本恢复到胁迫前水平。由此说明,在低温胁迫下四倍体杂交兰合成大量脯氨酸以抵御胁迫,从而降低受伤害程度。
如图1-B所示:在低温胁迫过程中,供试二倍体和四倍体杂交兰幼苗叶片中可溶性糖含量变化趋势一致,即在胁迫的0~9 d持续增加、9~12 d下降。胁迫结束时,四倍体杂交兰株系T1和T2的可溶性糖含量分别比胁迫前提高了286.7%和431.5%,分别是同一时间二倍体杂交兰的3.0和4.5倍。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中可溶性糖含量均呈下降趋势,这可能是由于低温伤害严重,杂交兰叶片中可溶性糖含量短期内无法恢复正常。
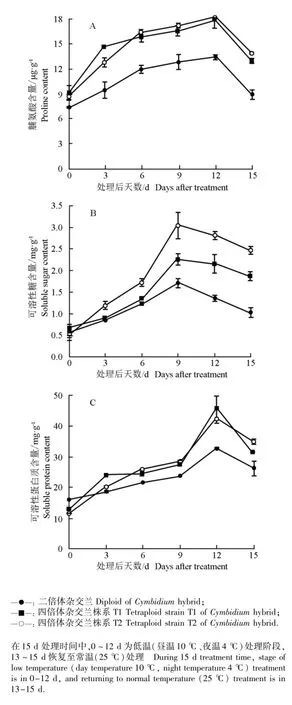
图1 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中脯氨酸(A)、可溶性糖(B)和可溶性蛋白质(C)含量的动态变化Fig.1 Dynamic change in contents of proline(A),soluble sugar (B)and soluble protein(C)in leaf of diploid and tetraploid seedlings of Cymbidium hybrid under low temperature stress
如图1-C所示:在低温胁迫过程中,供试二倍体和四倍体杂交兰幼苗叶片中可溶性蛋白质含量总体呈持续上升趋势,且2个四倍体杂交兰株系幼苗叶片中可溶性蛋白质含量总体高于二倍体杂交兰。胁迫结束时,四倍体杂交兰株系T1和T2叶片中可溶性蛋白质含量的增幅分别比同一时间二倍体杂交兰高2.4和2.5倍。由此说明,在低温胁迫过程中,四倍体杂交兰叶片中可溶性蛋白质的合成速率较快,对低温的调节能力强于二倍体杂交兰,适应能力更强。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中可溶性蛋白质含量均下降,但由于低温胁迫的严重伤害,导致此时二倍体杂交兰、四倍体杂交兰株系T1和T2幼苗叶片中可溶性蛋白质含量仍分别比胁迫前高64.7%、145.6%和193.9%。
2.2.2叶片中MDA含量的变化 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中MDA含量的动态变化见图2。如图2所示:在低温胁迫过程中,二倍体和四倍体杂交兰幼苗叶片中MDA含量均逐渐上升,且在整个低温胁迫过程中二倍体杂交兰幼苗叶片中MDA含量均高于四倍体杂交兰株系T1和T2。低温胁迫的第12天,二倍体杂交兰、四倍体杂交兰株系T1和T2幼苗叶片中的MDA含量分别较胁迫前增加了33.5%、21.0%和12.1%,由此说明,四倍体杂交兰因低温胁迫而引起的质膜损伤程度较低。常温下恢复生长3 d后(处理第15天),二倍体和四倍体杂交兰叶片中MDA含量基本恢复至胁迫前的水平。
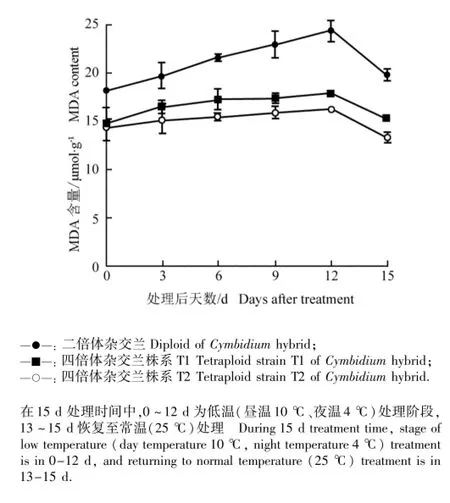
图2 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中MDA含量的动态变化Fig.2 Dynamic change in MDA content in leaf of diploid and tetraploid seedlings of Cymbidium hybrid under low temperature stress
2.2.3叶片中叶绿素含量的变化 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中叶绿素含量的动态变化见图3。如图3所示:在整个胁迫过程中,供试二倍体和四倍体杂交兰幼苗叶片中叶绿素含量均呈逐渐下降的趋势。至胁迫结束时,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中叶绿素含量分别下降27.7%、18.2%和17.3%。由此显示,低温胁迫对四倍体杂交兰叶片叶绿体结构的破坏程度较轻,叶绿素的分解速率较慢。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中叶绿素含量均有所上升。
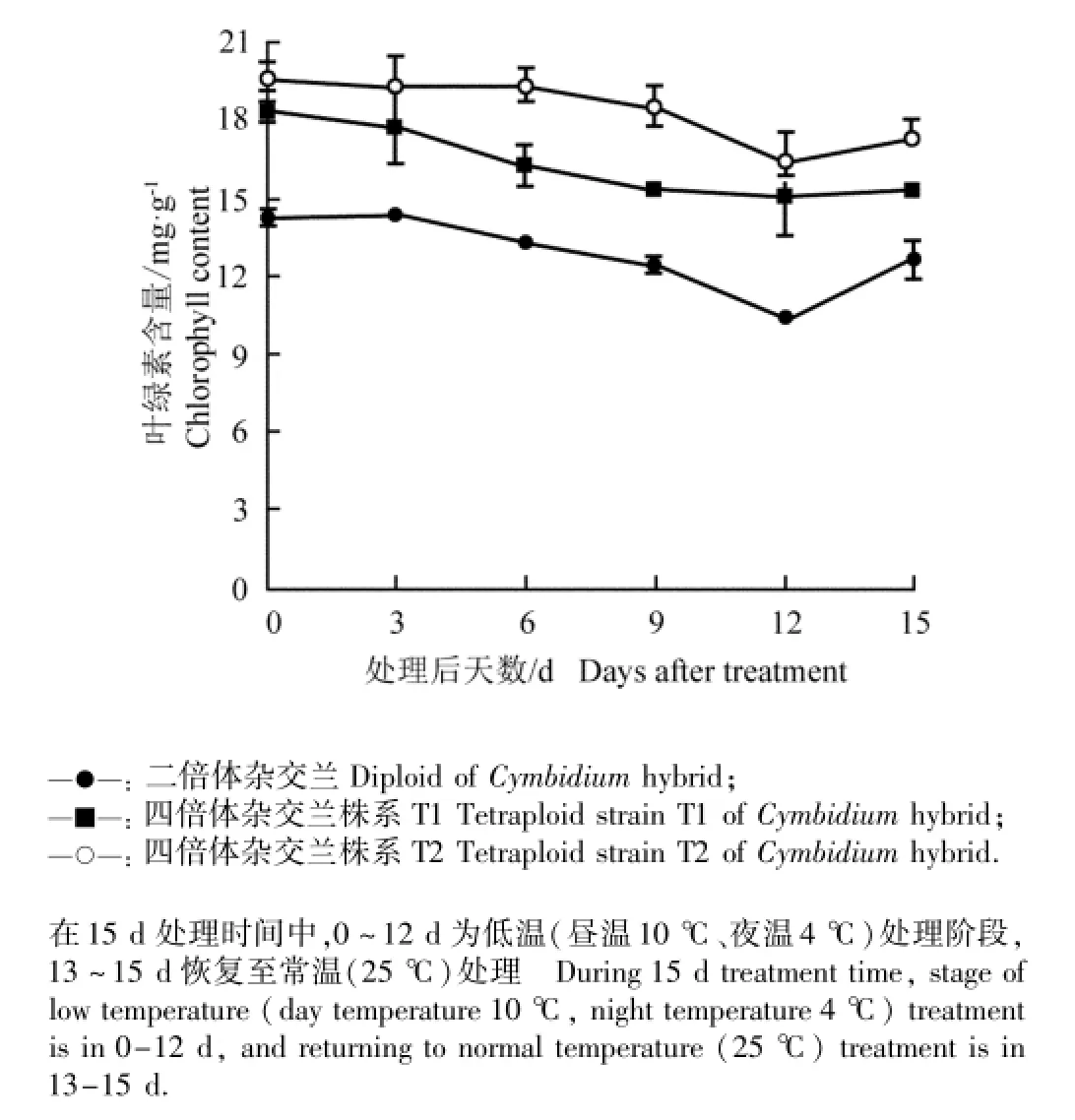
图3 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中叶绿素含量的动态变化Fig.3 Dynamic change in chlorophyll content in leaf of diploid and tetraploid seedlings of Cymbidium hybrid under low temperature stress
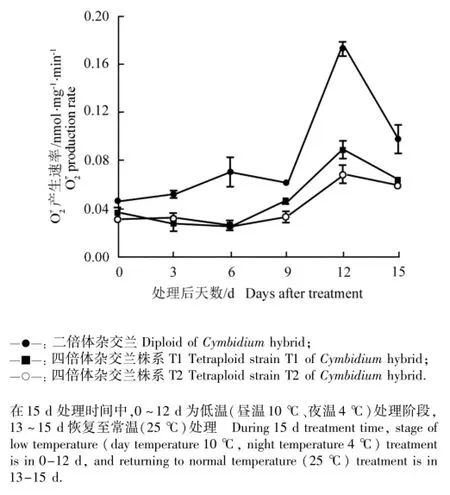
图4 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中产生速率的动态变化Fig.4 Dynamic change inproduction rate in leaf of diploid and tetraploid seedlings of Cymbidium hybrid under low temperature stress
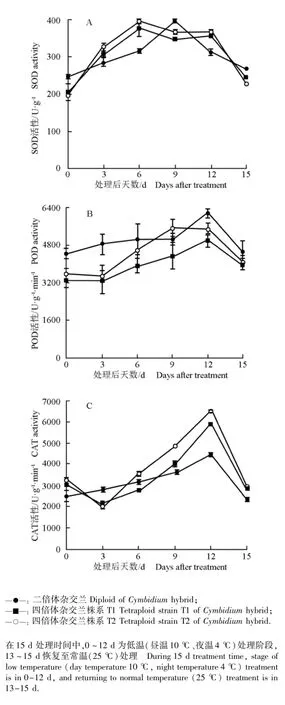
图5 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中SOD(A)、POD(B)和CAT(C)活性的动态变化Fig.5 Dynamic change in activities of SOD(A),POD(B)and CAT(C)in leaf of diploid and tetraploid seedlings of Cymbidium hybrid under low temperature stress
2.2.5叶片中抗氧化酶活性的变化 低温胁迫条件下二倍体和四倍体杂交兰幼苗叶片中SOD、POD和CAT活性的动态变化见图5。
如图5-A所示:在低温胁迫的0~6 d,四倍体杂交兰株系T1和T2幼苗叶片的SOD活性急剧上升,在6~9 d有所下降,9~12 d又略微上升;而二倍体杂交兰幼苗叶片中SOD活性在低温胁迫0~9 d持续上升,在9~12 d急剧下降。低温胁迫处理后,二倍体杂交兰、四倍体杂交兰株系T1和T2幼苗叶片中SOD活性较胁迫前均有不同程度的增加,其中,四倍体杂交兰株系T1和T2的增幅分别为74.8%和88.0%,二者的SOD活性分别为同一时间二倍体杂交兰的2.9和3.4倍。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中SOD活性基本上恢复到胁迫前的水平。低温胁迫后,四倍体杂交兰叶片中SOD活性总体上高于二倍体杂交兰,说明四倍体杂交兰具有更强的抗寒性。
如图5-B所示:在低温胁迫过程中,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中POD活性均呈持续上升的趋势。除胁迫第9天外,二倍体杂交兰叶片中POD活性始终高于四倍体杂交兰。胁迫结束后,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中POD活性分别较胁迫前增加了39%、51%和54%,四倍体杂交兰叶片中POD活性的增幅高于二倍体杂交兰。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中POD活性急剧下降。
如图5-C所示:在低温胁迫过程中,四倍体杂交兰株系T1和T2幼苗叶片中CAT活性的变化曲线一致,均呈先下降后上升的趋势;二倍体杂交兰幼苗叶片中CAT活性则呈持续上升的趋势。胁迫结束时,二倍体杂交兰和四倍体杂交兰株系T1和T2幼苗叶片中CAT活性分别较胁迫前增加了81.3%、95.2%和99.0%,四倍体杂交兰的增幅大于二倍体杂交兰。常温下恢复生长3 d后(处理第15天),供试二倍体和四倍体杂交兰叶片中CAT活性均急剧下降。
3 讨论和结论
脯氨酸作为重要的渗透调节物质,能缓解因低温脱水造成的渗透胁迫,其含量升高有利于提高植物的抗寒性[22]。植物体内可溶性糖的防脱水作用和可溶性蛋白质的强亲水胶体性都可以增强细胞的持水力,而二者的渗透调节作用又可以降低细胞水势。因此,植物体内可溶性糖和可溶性蛋白质含量的高低与植物的耐寒性强弱密切相关,可作为植物抗寒性的鉴定指标[23]。本研究中,低温胁迫下二倍体和四倍体杂交兰幼苗叶片中脯氨酸、可溶性糖和可溶性蛋白质均大量积累,四倍体杂交兰幼苗叶片中脯氨酸、可溶性糖和可溶性蛋白质的积累量明显高于二倍体杂交兰,这说明四倍体杂交兰的抗寒性明显强于二倍体。该结果与不同倍性扬花萝卜和不结球白菜的研究结果一致[7,11]。
MDA是膜脂过氧化作用的最终产物,MDA的含量反映了植物细胞膜脂过氧化的程度[24]。在低温胁迫后,二倍体和四倍体杂交兰幼苗叶片MDA含量均上升,表明低温胁迫增强了杂交兰叶片细胞膜的过氧化作用,使细胞膜受到伤害。低温胁迫的12 d内,二倍体杂交兰幼苗叶片中MDA含量始终高于四倍体杂交兰,说明四倍体杂交兰的膜脂过氧化程度低,细胞受到的伤害较轻。这与对甘蔗(Saccharum officinarum Linn.)和红掌(Anthurium andraenum Lind.)的研究结果相符,即耐低温品种体内MDA的积累量小于不耐低温品种[25-26]。
低温胁迫会导致叶绿体结构破坏、光合色素的含量和比例发生变化,最终使光合速率下降[27]。本研究中,随着低温胁迫时间的延长,供试二倍体和四倍体杂交兰幼苗叶片中叶绿素含量均呈下降趋势,这可能是低温胁迫使原有叶绿素被破坏,而新的叶绿素合成速率过慢所致。低温胁迫结束时,二倍体杂交兰叶片中叶绿体含量的下降幅度明显大于四倍体杂交兰,说明低温胁迫下四倍体杂交兰的叶绿体结构受损程度较小,其对低温有更强的适应性。这与对蝴蝶兰(Phalaenopsis spp.)和辣椒(Capsicum annuum Linn.)的研究结果一致[28-29]。
逆境胁迫会引起植物体内的活性氧代谢失调,而植物抗逆性的强弱与体内抗氧化酶活性的高低有关[24,26]。SOD和POD活性的共同提高可维持细胞膜的稳定性并保持其光化学反应活性,而SOD是细胞内活性氧和自由基清除系统的第一道防线[30-31],能将歧化成H2O2和O2以降低浓度。本研究中,二倍体和四倍体杂交兰幼苗叶片中产生速率减缓时SOD活性增强,而产生速率上升时SOD活性减弱,产生速率与SOD活性呈负相关。POD和CAT的主要作用是酶促降解H2O2,避免H2O2过量积累对细胞膜造成伤害[32]。田丹青等[26]对低温胁迫后3个红掌品种幼苗的生理特性进行了研究,结果表明:耐寒性强的品种具有较高的SOD和CAT活性及稳定的POD活性,不耐寒品种SOD和CAT活性较低、POD活性变化较大。在低温胁迫期间二倍体和四倍体杂交兰幼苗叶片中SOD、CAT和POD活性总体上呈大幅上升的趋势,能有效清除活性氧和自由基,保护叶片细胞膜免受氧化伤害,提高了杂交兰的抗寒性,且四倍体杂交兰叶片中3种酶活性的增幅均高于二倍体杂交兰,说明四倍体杂交兰的耐低温能力更强。
植物染色体组加倍后,由于等位基因的杂合性及染色体的累积效应提高了它们的遗传多样性及适应能力,因此,多倍体对逆境的适应力强于二倍体。本研究结果表明:低温胁迫条件下四倍体杂交兰叶片中渗透调节物质含量及抗氧化酶活性均显著高于二倍体杂交兰,而MDA含量则低于二倍体杂交兰,因此,四倍体杂交兰的耐寒能力强于二倍体杂交兰,表明染色体加倍后植株的抗寒性增强。
[1] 朱根发.国际兰属植物杂交育种进展[J].广东农业科学,2005 (4):25-27.
[2] 朱根发,王碧青,陈明莉,等.大花蕙兰与兰属植物种间杂交研究[J].植物学通报,2005,22(4):445-448.
[3] 刘仲健,陈心启,茹正忠.中国兰属植物[M].北京:科学出版社,2006:290-297.
[4] RÊGO M M,RÊGO E R,BRUCKNER C H,et al.In vitro induction ofautotetraploidsfromdiploidyellowpassionfruit mediated by colchicine and oryzalin[J].Plant Cell,Tissue and Organ Culture,2011,107:451-459.
[5] MOHAMMADI P P,MOIENI A,EBRAHIMI A,et al.Doubled haploid plants following colchicine treatment of microspore-derived embryos of oilseed rape(Brassica napus L.)[J].Plant Cell,Tissue and Organ Culture,2012,108:251-256.
[6] 彭 静,魏岳荣,熊兴华.植物多倍体育种研究进展[J].中国农学通报,2010,26(11):45-49.
[7] 颜志明,张蜀宁,汤伟华,等.二倍体和四倍体扬花萝卜的品质特性及抗寒性比较研究[J].西北植物学报,2007,27(7): 1405-1410.
[8] 刘文革,王 明,阎志红,等.冷锻炼对不同倍性西瓜幼苗SOD、POD活性及MDA含量的影响[J].西北植物学报,2004, 24(4):578-582.
[9] 张夏楠,高山林.何首乌同源四倍体的诱导及生理指标的测定[J].植物资源与环境学报,2006,15(4):33-37.
[10] 商宏莉,郭启高,宋 明,等.生姜四倍体抗热性与抗寒性的初步研究[J].西南农业大学学报,2003,25(3):210-211, 233.
[11] 张蜀宁,张振超,张红亮,等.低温胁迫对不同倍性不结球白菜生长及生理生化特征的影响[J].西北植物学报,2008,28 (1):109-112.
[12] 陈瑶瑶,张 燕,张 琛,等.杂交兰‘韩国桃花’×蕙兰种间杂交种子无菌萌发特征研究[J].园艺学报,2009,36(3): 441-446.
[13] 尹翠翠,张 燕,张景华,等.秋水仙素诱导杂交兰四倍体及倍性鉴定[J].核农学报,2010,24(3):518-521.
[14] KUMER G N M,KNOWLES N R.Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme activities during aging and sprouting of potato(Solanum tuberosum)seed-tubers [J].Plant Physiology,1993,102:115-124.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-185.
[16] ARORA R,WISNIEWSKI M E.Cold acclimation in genetically related(sibling)deciduous and evergreen peach(Prunus persica [L.]Batsch).Ⅱ.A 60-kilodalton bark protein in cold-acclimated tissue of peach is heat stable and related to the dehydrin family of proteins[J].Plant Physiology,1994,105:95-101.
[17] ARNON D L.Copper enzymes in isolated chloroplasts:polyphenol oxidase in Beta vulgaris[J].Plant Physiology,1949,24:1-15.
[18] KE D,SUN G,WANG Z.Effects of superoxide radicals on ACC synthase activity in chilling-stressed etiolated mungbean seedlings [J].Plant Growth Regulation,2007,51:83-91.
[19] ZHOU W,ZHAO D,LIN X.Effects of waterlogging on nitrogen accumulation and alleviation of waterlogging damage by application of nitrogen fertilizer and mixtalol in winter rape(Brassica napus L.) [J].Journal of Plant Growth Regulation,1997,16:47-53.
[20] MUÑOZ-MUÑOZ J L,GARCÍA-MOLINA F,GARCÍA-RUIZ P A, et al.Enzymatic and chemical oxidation of trihydroxylated phenols [J].Food Chemistry,2009,113:435-444.
[21] AEBI H.Catalase in vitro[M]∥PACKER L.Methods in Enzymology.Orlando:Academic Press,1984:121-126.
[22] 王茂良.植物抗渗透胁迫及其与脯氨酸的关系[J].北京园林, 2006,22(2):21-24.
[23] 谢吉容,谈 锋.自然降温过程中南方红豆杉叶片水分、渗透调节物质的动态变化与低温半致死温度的关系[J].西南民族学院学报:自然科学版,2002,28(1):61-64.
[24] 陈少裕.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯, 1991,27(2):84-90.
[25] 孙 富,杨丽涛,谢晓娜,等.低温胁迫对不同抗寒性甘蔗品种幼苗叶绿体生理代谢的影响[J].作物学报,2012,38(4): 732-739.
[26] 田丹青,葛亚英,潘刚敏,等.低温胁迫对3个红掌品种叶片形态和生理特性的影响[J].园艺学报,2011,38(6):1173-1179.
[27] 王 静,张成军,陈国祥,等.低温对灌浆期水稻剑叶光合色素和类囊体膜脂肪酸的影响[J].中国水稻科学,2006,20 (2):177-182.
[28] 高冬冬.低温对不同基因型蝴蝶兰(Phalaenopsis spp.)生理特性的影响[D].杭州:浙江大学农业与生物技术学院,2011:25-29.
[29] 张志刚,尚庆茂.低温、弱光及盐胁迫下辣椒叶片的光合特性[J].中国农业科学,2010,43(1):123-131.
[30] DU H,WANG Z,HUANG B.Differential responses of warmseason and cool-season turfgrass species to heat stress associated with antioxidant enzyme activity[J].Journal of the American Society for Horticultural Science,2009,134:417-422.
[31] ALSCHER R G,ERTURK N,HEATH L S.Role of superoxide dismutases(SODs)in controlling oxidative stress in plants[J]. Journal of Experimental Biology,2002,53:1331-1341.
[32] Van BREUSEGEM F,VRANOVÁ E,DAT J F,et al.The role of active oxygen species in plant signal transduction[J].Plant Science,2001,161:405-414.
(责任编辑:张明霞)
Analysis on difference in physiological response of diploid and tetraploid of Cymbidium hybrid
seedling to low temperature stress WANG Yuanyuan,YE Zhiqin,LIU Rong,WANG Guangdong①(College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China),J.Plant Resour.& Environ.2014,23(4):68-74
To inquire into difference in physiological response of Cymbidium hybrid with different ploidies to low temperature stress,dynamic changes in contents of proline,soluble sugar,soluble protein,MDA and chlorophyll,production rate and activities of SOD,POD and CAT in seedling leaf of diploid of Cymbidium hybrid and tetraploid strains T1 and T2 of Cymbidium hybrid under low temperature stress (day temperature 10℃,night temperature 4℃)were determined and analyzed.On this basis, difference in tolerance of diploid and tetraploid of Cymbidium hybrid to low temperature was compared. The results show that with prolonging of stress time,contents of proline,soluble sugar,soluble protein and MDA,production rate and activities of POD and CAT in seedling leaf of diploid of Cymbidium hybrid and tetraploid strains T1 and T2 of Cymbidium hybrid totally appear gradually increasing trend, chlorophyll content appears gradually decreasing trend,and SOD activity appears the trend of firstly increasing and then decreasing and reaches the peak value on the 9th and 6th days of stress, respectively.On the 3rd day of recovery growth under normal temperature(25℃),contents of proline, soluble sugar,soluble protein and MDA,production rate and activities of SOD,POD and CAT in seedling leaf of diploid of Cymbidium hybrid and tetraploid strains T1 and T2 of Cymbidium hybrid alldecrease,while chlorophyll content increases.In general,in seedling leaf of diploid of Cymbidium hybrid,increasing ranges of contents of proline,soluble sugar and soluble protein and activities of SOD, POD and CAT are obviously lower and those of MDA content andproduction rate are higher than those of tetraploid of Cymbidium hybrid,while decreasing range of chlorophyll content is obviously higher than that of tetraploid of Cymbidium hybrid.The comprehensive analysis result shows that both osmoregulation substance content and protective enzyme activity in leaf of tetraploid of Cymbidium hybrid are higher and its tolerance to low temperature is stronger than those of diploid of Cymbidium hybrid under low temperature stress.
Cymbidium hybrid;diploid;tetraploid;low temperature stress;osmoregulation substance; antioxidant enzyme activity
Q945.78;S682.31
A
1674-7895(2014)04-0068-07
10.3969/j.issn.1674-7895.2014.04.10
2014-01-22
江苏省科技支撑计划项目(BE2010334)
王园园(1985—),女,河南商丘人,硕士研究生,主要从事观赏植物生物技术方面的研究。
①通信作者E-mail:gdwang@njau.edu.cn

