低温胁迫下不同种源香椿含水量和渗透调节物质含量差异及其与抗寒性的相关性
杨玉珍,陈 刚,彭方仁,王国霞,罗 青,马 晓
(1.郑州师范学院生命科学学院,河南郑州450044;2.南京林业大学林学院,江苏南京210037; 3.河南职业技术学院环境艺术工程系,河南郑州450046)
低温胁迫下不同种源香椿含水量和渗透调节物质含量差异及其与抗寒性的相关性
杨玉珍1,陈 刚1,彭方仁2,王国霞1,罗 青1,马 晓3
(1.郑州师范学院生命科学学院,河南郑州450044;2.南京林业大学林学院,江苏南京210037; 3.河南职业技术学院环境艺术工程系,河南郑州450046)
以来源于不同产地的10个香椿〔Toona sinensis(A.Juss.)Roem.〕种源为研究对象、以温度25℃为对照,对5℃、0℃、-5℃和-10℃低温胁迫条件下叶片的水分含量指标(包括总含水量、自由水含量、束缚水含量和自由水含量与束缚水含量比值)和渗透调节物质含量(包括可溶性糖含量和脯氨酸含量)的变化进行了比较,并对这些指标与低温半致死温度(LT50)的相关性进行了分析。结果表明:在5℃至-5℃条件下,各种源幼苗叶片的总含水量、自由水含量以及自由水含量与束缚水含量比值均低于对照,并且大多种源的上述指标随温度降低不断下降;各种源幼苗叶片的束缚水含量则均高于对照,并在0℃条件下达到最高值;多数种源幼苗叶片的可溶性糖含量及脯氨酸含量则随温度降低而持续上升。在-10℃条件下,所有种源幼苗叶片的总含水量和自由水含量以及绝大多数种源的自由水含量与束缚水含量比值均高于-5℃条件下,但束缚水含量、可溶性糖含量和脯氨酸含量则均低于-5℃条件下。相关性分析结果表明:在5℃条件下,束缚水含量与LT50呈显著负相关、自由水含量与束缚水含量比值与LT50呈显著正相关,而在0℃、-5℃和-10℃条件下这2个指标与LT50则分别呈不显著的负相关和正相关;在5℃和-5℃条件下叶片的自由水含量与LT50呈显著正相关,而在0℃和-10℃条件下则呈不显著正相关;在5℃条件下叶片的可溶性糖含量和脯氨酸含量与LT50呈不显著负相关,而在0℃、-5℃和-10℃条件下则与LT50呈显著负相关。研究结果表明:供试的10个香椿种源均不能耐受-10℃的低温胁迫,应在-5℃至-10℃范围内进一步研究确定其低温耐受阈值。
香椿;种源;含水量;渗透调节物质;抗寒性;相关性分析
香椿〔Toona sinensis(A.Juss.)Roem.〕在中国分布广泛,其幼嫩茎叶可食,因叶厚芽嫩、香味浓郁而有“树上蔬菜”的美誉,营养价值远高于其他蔬菜。作者的前期研究结果表明:产自中国南方的香椿芽中的氨基酸、蛋白质、可溶性糖及VC含量均高于产自中国北方的香椿[1],因而,将南方香椿种源引入北方有利于北方香椿品种的改良、提升其营养价值。但南北方气温差异较大,尤其是低温,是制约南北方香椿种源引种和栽培的因素之一。
作者以低温适应性不同的10个香椿种源[2]为实验对象,测定并比较了不同低温条件下各种源幼苗叶片的水分含量(包括总含水量、自由水含量和束缚水含量)及渗透调节物质含量(包括可溶性糖含量和脯氨酸含量)的变化,还比较了自由水含量与束缚水含量比值的变化;在此基础上,对低温胁迫条件下不同种源的低温半致死温度(LT50)与各测定指标的相关性进行了分析,以期进一步探索不同种源香椿的抗寒机制,为香椿优良种源的引种和栽培提供基础数据。
1 材料和方法
1.1 材料
供试香椿种源来源于9个省份的10个产地,各产地基本概况及各种源的低温半致死温度(LT50)见表1。选用各香椿种源的1年生实生苗,于2008年3月中旬进行盆栽;每个栽培盆装8 kg干土,每盆栽植1株,置于南京林业大学树木园日光温室内。为保证幼苗生长相对一致,定植后进行平茬。待萌芽长至高约20 cm时,每株留1支长势较好的嫩枝,采用常规管理方法进行日常管理。
1.2 方法
1.2.1 低温胁迫处理方法 于2008年10月下旬选择长势一致的香椿苗移入人工气候室内进行低温胁迫处理。将各种源供试植株分成5组:1组作为对照(CK),置于常温(25℃)下进行处理;另外4组先放入人工气候室内,将温度逐渐降至5℃并在此温度下炼苗7 d;将其中1组在此温度下继续处理48 h,另外3组则分别置于0℃、-5℃和-10℃条件下处理48 h。每处理设3组重复,每重复5株苗。处理结束后采集幼苗中部的复叶中部叶片,混合后用于各项指标的测定分析。
1.2.2 指标测定方法 参照郝建军等[3]的方法测定叶片总含水量及自由水含量和束缚水含量;采用蒽酮比色法[4]11-13测定叶片中可溶性糖含量;采用茚三酮显色法[4]133-135测定叶片中脯氨酸含量。每个指标至少重复测定3次。
1.3 数据处理与分析
采用EXCEL 2003软件对实验数据进行预处理,并采用SPSS 11.5统计分析软件进行方差分析和相关性分析。
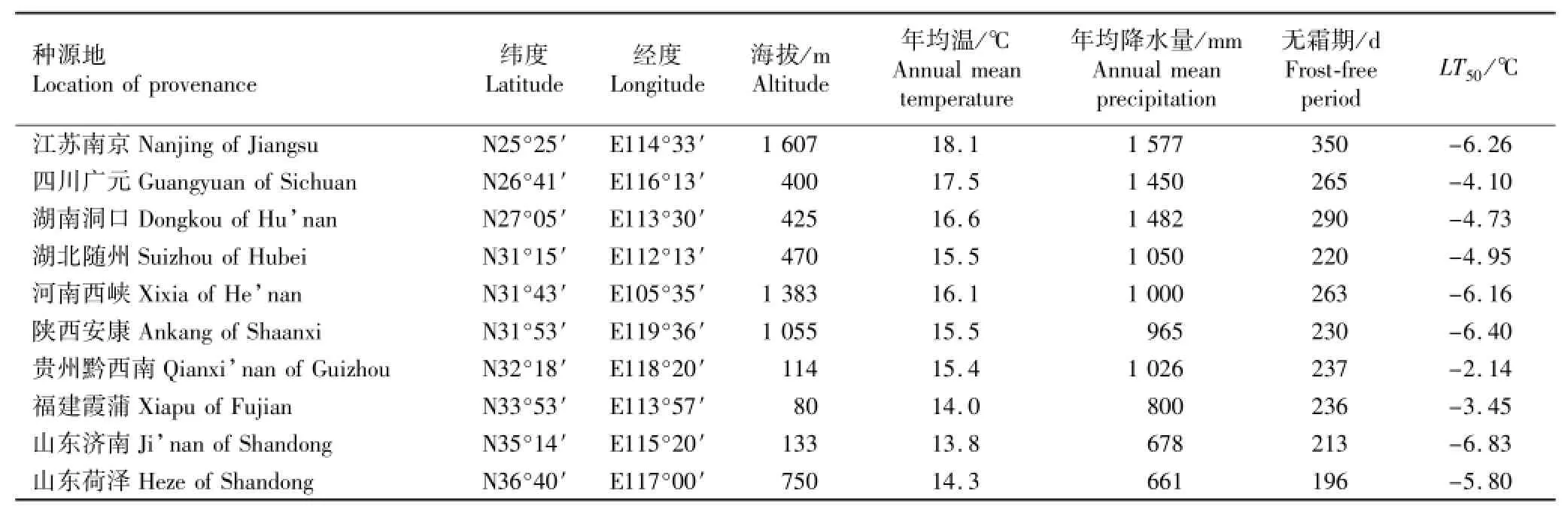
表1 供试香椿种源的产地自然概况以及低温半致死温度(LT50)Table1 Natural survey of location and the low semilethal temperature(LT50)of provenances tested of Toona sinensis(A.Juss.)Roem.
表2 低温胁迫条件下不同种源香椿幼苗叶片总含水量的变化(D)1)Table2 Change of total water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)

表2 低温胁迫条件下不同种源香椿幼苗叶片总含水量的变化(D)1)Table2 Change of total water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
2 结果和分析
2.1 低温胁迫条件下不同种源香椿幼苗叶片水分含量的变化分析
2.1.1 总含水量的变化分析 低温胁迫下不同种源香椿幼苗叶片总含水量的变化见表2。由表2可以看出:在5℃至-5℃低温胁迫条件下各种源香椿幼苗叶片的总含水量均随处理温度的降低而下降。与对照(25℃)相比,5℃和0℃低温胁迫下各种源香椿幼苗叶片的总含水量均下降,但降幅相对较小;-5℃低温胁迫下各种源叶片的总含水量最低,与对照的差异幅度最大;而-10℃低温胁迫下叶片的总含水量均高于-5℃低温胁迫条件下,但低于0℃低温胁迫条件下。不同种源之间的比较结果表明:低温胁迫下抗寒性较弱的贵州黔西南和福建霞蒲2个种源香椿幼苗的叶片总含水量均相对较高。
方差分析结果表明:在-5℃低温胁迫条件下同一种源香椿幼苗叶片的总含水量与其他低温胁迫条件下叶片的总含水量差异极显著;同一种源幼苗叶片的总含水量在-10℃和-5℃低温胁迫条件下差异极显著。
2.1.2 自由水含量的变化分析 低温胁迫下不同种源香椿幼苗叶片自由水含量的变化见表3。由表3可见:在25℃至-5℃条件下,除四川广元种源外其他种源香椿幼苗叶片的自由水含量均随温度降低逐渐下降,且与总含水量的变化趋势基本保持一致。在-5℃条件下,除四川广元种源外其余9个种源叶片的自由水含量均最低,而-10℃低温胁迫下各种源叶片的自由水含量却较-5℃低温胁迫条件下有所升高,且多数高于0℃低温胁迫条件下(江苏南京种源除外)。不同种源间的比较结果表明:贵州黔西南和福建霞蒲种源幼苗叶片的自由水含量均相对较高。
方差分析结果表明:在-5℃低温胁迫下贵州黔西南种源幼苗叶片的自由水含量极显著低于0℃条件下,而其他种源幼苗的自由水含量在0℃和-5℃条件下则无显著差异。说明从自由水含量这一指标看,贵州黔西南香椿种源对-5℃低温胁迫的抗性低于其他种源,与其低温半致死温度相一致。
表3 低温胁迫条件下不同种源香椿幼苗叶片自由水含量的变化(SD)1)Table3 Change of free water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
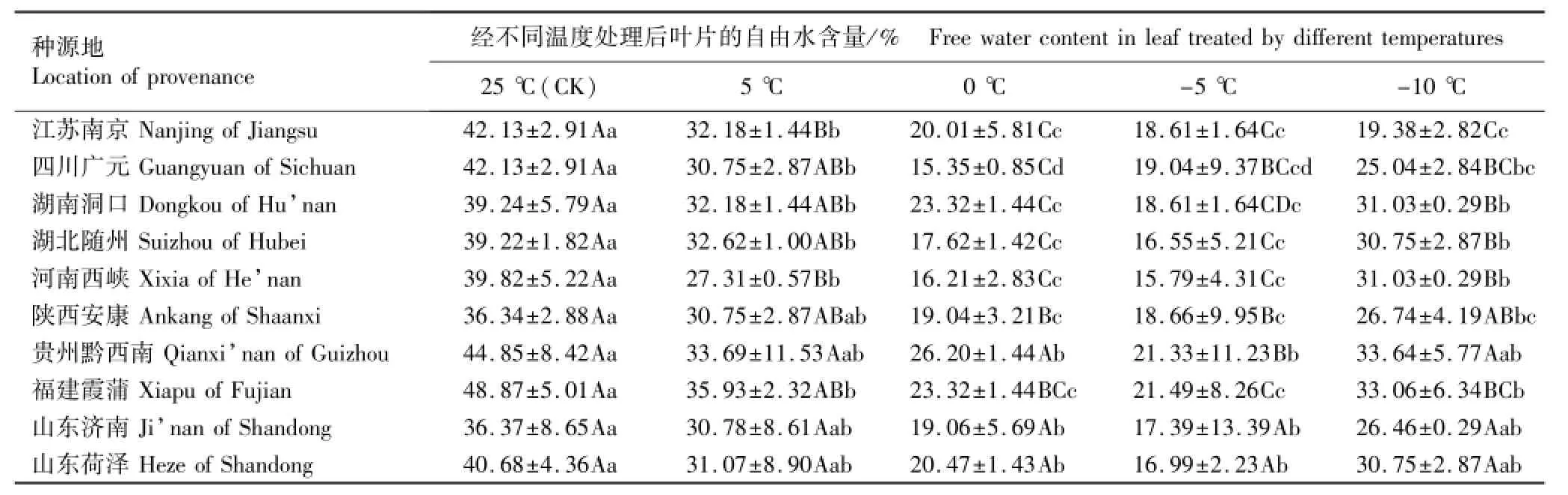
表3 低温胁迫条件下不同种源香椿幼苗叶片自由水含量的变化(SD)1)Table3 Change of free water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
表4 低温胁迫条件下不同种源香椿幼苗叶片束缚水含量的变化(SD)1)Table4 Change of bound water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
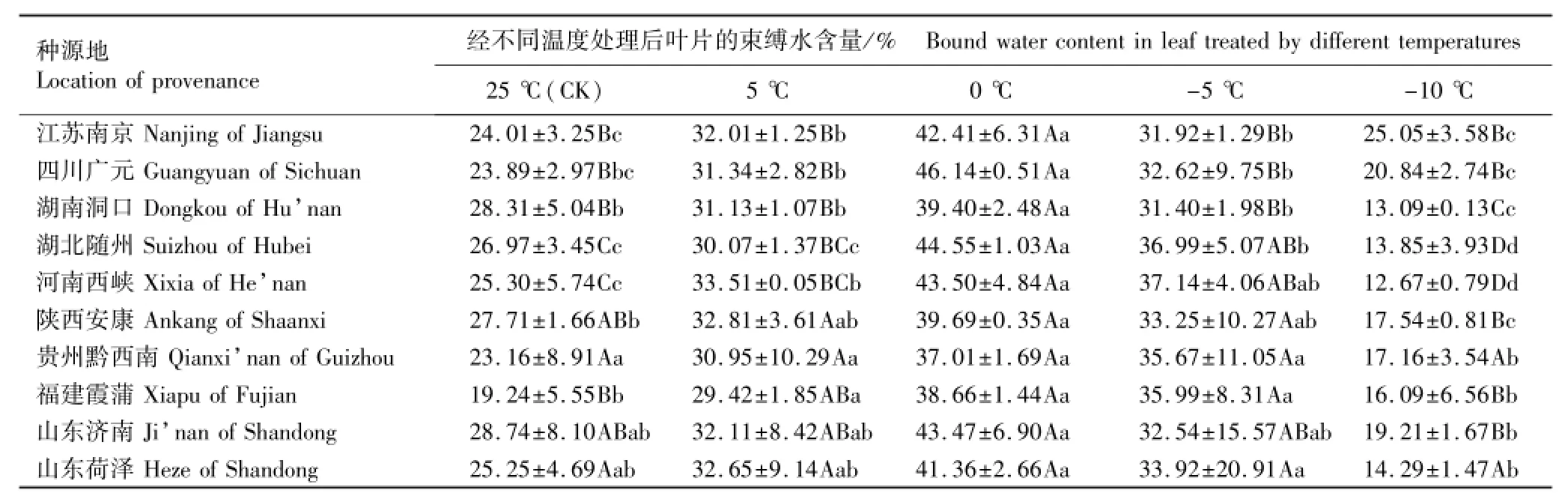
表4 低温胁迫条件下不同种源香椿幼苗叶片束缚水含量的变化(SD)1)Table4 Change of bound water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
2.1.3 束缚水含量的变化分析 低温胁迫下不同种源香椿幼苗叶片束缚水含量的变化见表4。由表4可以看出:在25℃至0℃条件下,不同种源香椿幼苗叶片的束缚水含量均呈逐渐升高的趋势,与叶片总含水量和自由水含量的变化趋势恰好相反。除江苏南京种源外,其余9个种源幼苗叶片的束缚水含量均表现为在0℃条件下最高、-5℃条件下次之、-10℃条件下最低,说明从束缚水含量这一指标看,各种源香椿幼苗对-10℃低温胁迫的抗性最弱。
方差分析结果表明:江苏南京、四川广元和湖南洞口3个种源幼苗叶片的束缚水含量在0℃和-5℃条件下差异极显著,湖北随州种源叶片的束缚水含量在0℃和-5℃条件下差异显著,而其他种源叶片的束缚水含量在0℃和-5℃条件下无显著差异。
2.1.4 自由水含量与束缚水含量比值的变化分析低温胁迫下不同种源香椿幼苗叶片自由水含量与束缚水含量比值的变化见表5。由表5可见:对照(25℃)条件下,不同种源香椿幼苗叶片的自由水含量与束缚水含量比值均最大。各种源叶片的自由水含量与束缚水含量比值在5℃条件下均不同程度减小,并在0℃或-5℃条件下最小,但在-10℃条件下则较0℃和-5℃条件下有所增大(江苏南京种源除外)。进一步说明香椿幼苗对-10℃低温的抗性最弱。不同种源间的比较结果表明:贵州黔西南和福建霞蒲种源幼苗叶片的自由水含量与束缚水含量比值均相对较高。
方差分析结果表明:在0℃和-5℃胁迫条件下,各种源幼苗叶片的自由水含量与束缚水含量比值均无显著差异。
表5 低温胁迫条件下不同种源香椿幼苗叶片自由水含量与束缚水含量比值的变化(D)1)Table5 Change of ratio of free water content to bound water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
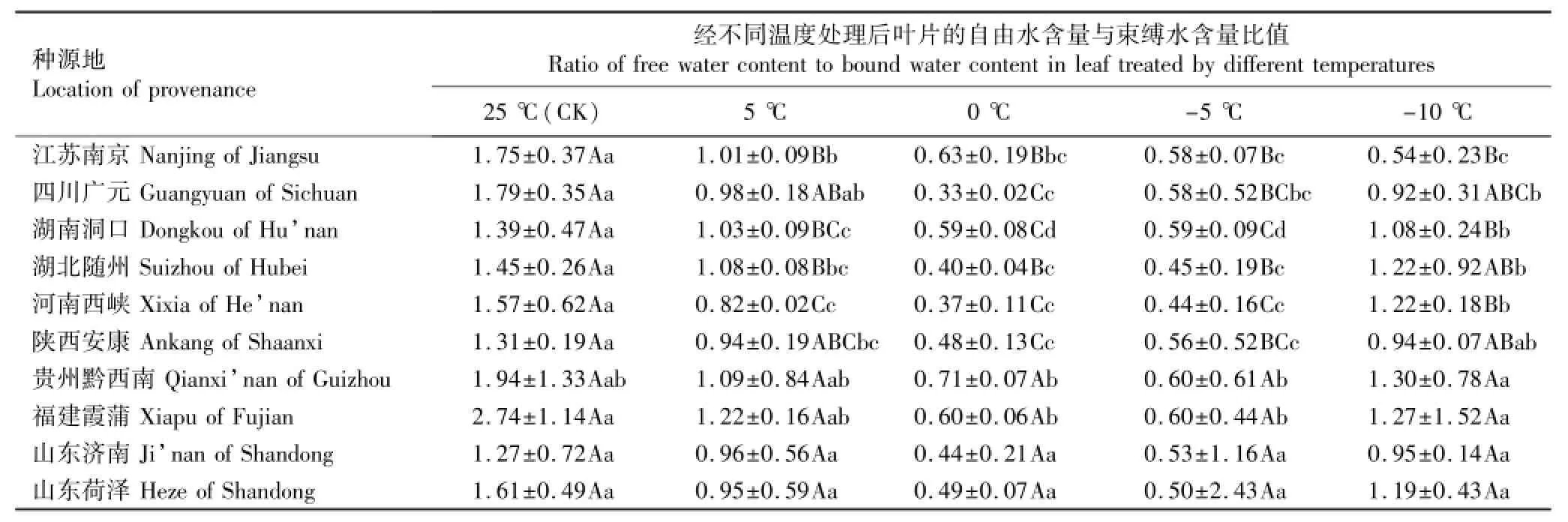
表5 低温胁迫条件下不同种源香椿幼苗叶片自由水含量与束缚水含量比值的变化(D)1)Table5 Change of ratio of free water content to bound water content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
表6 低温胁迫条件下不同种源香椿幼苗叶片可溶性糖含量的变化(SD)1)Table6 Change of soluble sugar content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
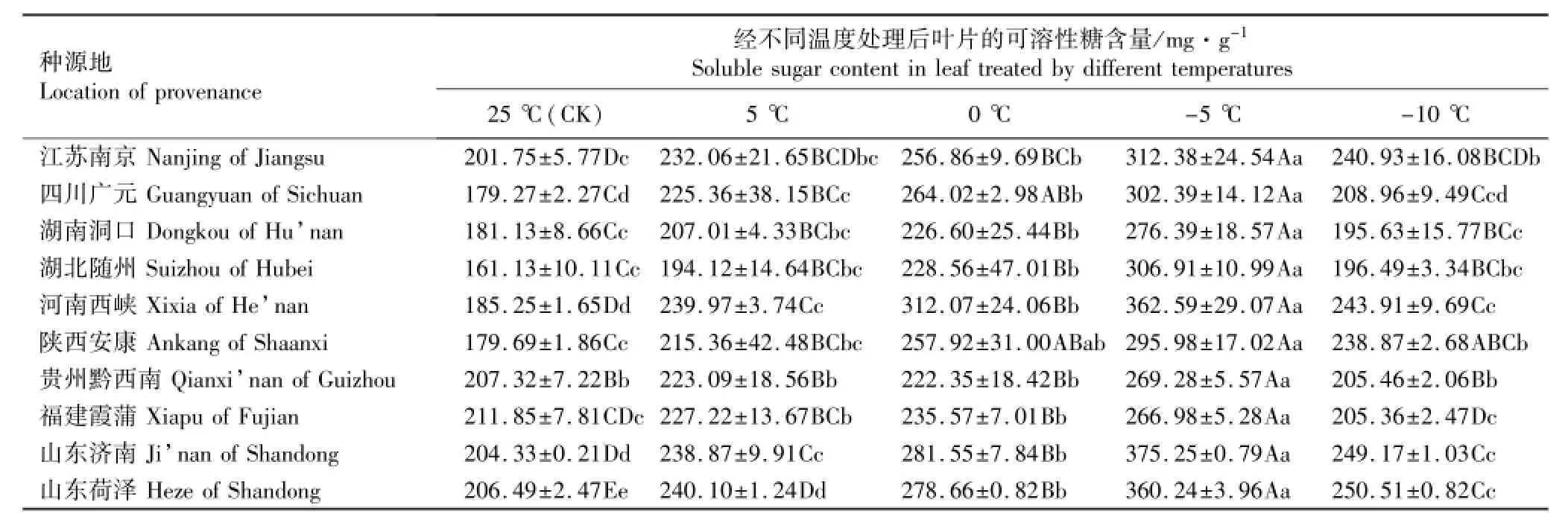
表6 低温胁迫条件下不同种源香椿幼苗叶片可溶性糖含量的变化(SD)1)Table6 Change of soluble sugar content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress(SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
2.2 低温胁迫条件下不同种源香椿幼苗叶片渗透调节物质含量的变化分析
2.2.1 可溶性糖含量的变化分析 低温胁迫下不同种源香椿幼苗叶片可溶性糖含量的变化见表6。从表6可以看出:各种源香椿幼苗叶片可溶性糖含量的变化趋势基本一致。对照(25℃)条件下,各种源香椿幼苗叶片的可溶性糖含量均较低;随着胁迫温度的降低,叶片可溶性糖含量不断升高,并在-5℃条件下急剧升高;但在-10℃胁迫条件下叶片的可溶性糖含量低于0℃甚至5℃条件下,但仍高于对照(贵州黔西南和福建霞浦种源除外)。说明在一定范围内的低温条件下,香椿幼苗可通过提高可溶性糖含量来抵御低温胁迫对机体的伤害,但是当胁迫温度超过一定范围时,由于机体受到的伤害较重导致其体内碳水化合物合成受阻,使其体内糖分的分解速率大于积累速率,表现为可溶性糖含量下降。此外,由表6还可见:不同温度条件下,贵州黔西南和福建霞蒲等南方种源叶片可溶性糖含量的增幅均较小,而北方种源的增幅则较大。
方差分析结果表明:各种源香椿幼苗叶片的可溶性糖含量在-5℃和-10℃条件下有显著或极显著差异,其中陕西安康种源的可溶性糖含量在上述2个低温条件下有显著差异,其余种源的可溶性糖含量在上述2个低温条件下则有极显著差异。说明从可溶性糖含量这一指标看,供试香椿种源不能耐受-10℃的低温胁迫。
2.2.2 脯氨酸含量的变化分析 低温胁迫下不同种源香椿幼苗叶片脯氨酸含量的变化见表7。由表7可见:不同种源香椿幼苗叶片脯氨酸含量的变化趋势也基本一致。对照(25℃)条件下,各种源叶片的脯氨酸含量均较低;在5℃和0℃条件下,各种源幼苗叶片的脯氨酸含量均大幅升高;在-5℃条件下,虽然不同种源香椿幼苗叶片脯氨酸含量的变化趋势并不一致,但均高于常温和5℃条件下,并且,除湖南洞口、河南西峡、陕西安康和福建霞蒲种源外,其他种源叶片的脯氨酸含量高于0℃条件下,说明-5℃低温对上述4个香椿种源已经产生了一定的伤害作用。在-10℃低温条件下,不同种源香椿幼苗叶片的脯氨酸含量较低,且均低于5℃条件下;并且,除四川广元、湖北随州和福建霞浦种源外,其他种源叶片的脯氨酸含量均高于对照。由表7还可见:不同温度条件下,贵州黔西南和福建霞蒲种源幼苗叶片的脯氨酸含量均较低,且总体上看,南方种源幼苗叶片脯氨酸含量的增幅均较小,而北方种源的增幅则较大。
方差分析结果表明:山东济南种源幼苗叶片的脯氨酸含量在0℃和-5℃条件下差异极显著,其余9个种源幼苗叶片的脯氨酸含量均无显著差异。
表7 低温胁迫条件下不同种源香椿幼苗叶片脯氨酸含量的变化(SD)1)Table7 Change of proline content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress (SD)1)
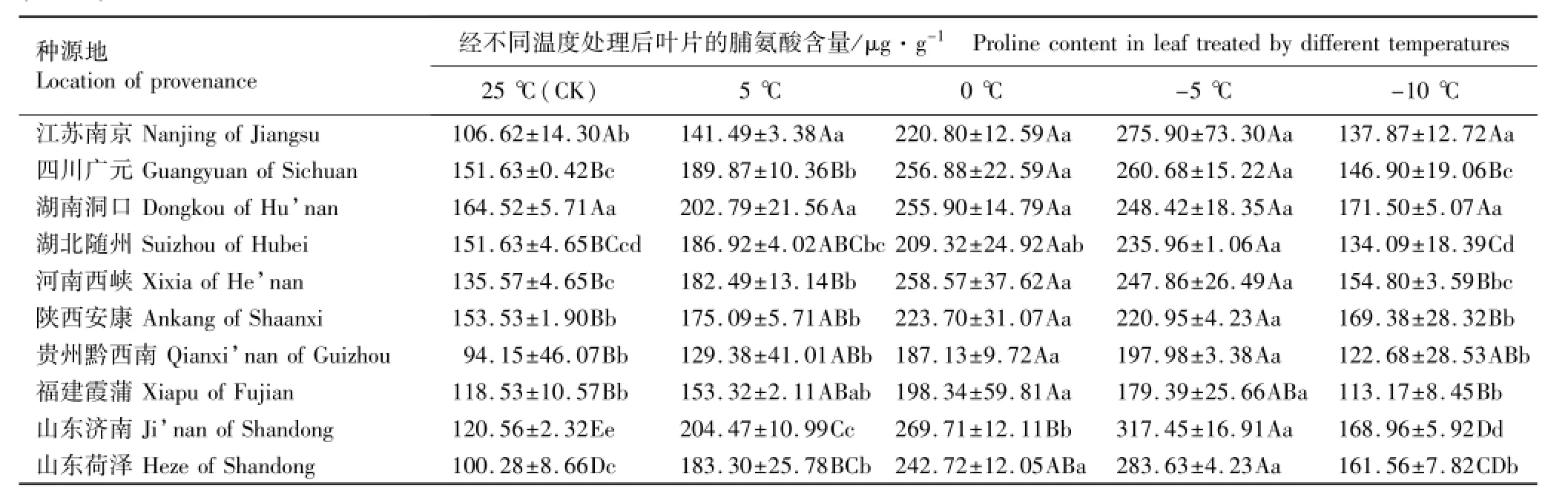
表7 低温胁迫条件下不同种源香椿幼苗叶片脯氨酸含量的变化(SD)1)Table7 Change of proline content in leaf of Toona sinensis(A.Juss.)Roem.seedlings from different provenances under low temperature stress (SD)1)
1)表中数值为3次重复的平均值Datums in this table are the average of three replications.同行中不同的小写和大写字母分别表示差异显著(P<0.05)和极显著(P<0.01)Different small letters and capitals in the same row indicate the significant(P<0.05)and extremely significant (P<0.01)differences,respectively.
?
2.3 低温胁迫条件下香椿幼苗叶片水分和渗透调节物质含量与低温半致死温度的相关性分析
2.3.1 水分含量与低温半致死温度的相关性 对供试香椿种源的低温半致死温度(LT50)(见表1)与幼苗叶片水分含量(见表2至表5)进行相关性分析,结果表明:0℃和-10℃条件下,不同种源香椿幼苗叶片的自由水含量与LT50均呈不显著的正相关关系;而在5℃和-5℃条件下则呈显著的正相关关系,相关系数分别为0.707与0.767。在5℃条件下,不同种源香椿幼苗叶片的束缚水含量与LT50呈显著的负相关关系,相关系数为-0.693;而在0℃、-5℃和-10℃条件下则呈不显著的负相关关系。在5℃条件下,不同种源香椿幼苗叶片的自由水含量与束缚水含量比值与LT50呈显著的正相关关系,相关系数为0.684;而在其他低温条件下则呈不显著的正相关关系。
2.3.2 渗透调节物质含量与低温半致死温度的相关性 对供试香椿种源的低温半致死温度(LT50)(见表1)与幼苗叶片可溶性糖和脯氨酸含量(见表6和表7)进行相关性分析,结果表明:在5℃条件下,不同种源香椿幼苗叶片的可溶性糖含量与LT50呈不显著的负相关关系;而在0℃、-5℃和-10℃条件下则呈显著的负相关关系,相关系数分别为-0.673、-0.742和-0.767。在5℃条件下,不同种源香椿幼苗叶片的脯氨酸含量与LT50呈不显著的负相关关系;而在0℃、-5℃和-10℃条件下则呈显著的负相关关系,相关系数分别为-0.643、-0.709和-0.703。
3 讨论和结论
目前,关于低温胁迫下植物水分含量与抗寒性关系的相关研究已有较多文献报道[5-8]。本研究结果显示:在5℃至-10℃低温条件下,香椿的抗寒性与叶片中的束缚水含量呈正相关,而与自由水含量及自由水含量与束缚水含量比值呈显著的负相关。与对照(25℃)相比,在5℃至-5℃低温范围内,各种源香椿幼苗叶片的总含水量和自由水含量的下降程度、束缚水含量的上升程度以及自由水含量与束缚水含量比值的降低程度大多随温度的降低而增大,而在-10℃条件下上述指标的变化幅度并没有因温度降低而继续增大,说明-5℃低温是香椿能适应的低温, -10℃低温已经对香椿幼苗细胞造成破坏,甚至是不可逆的损害,说明1年生香椿幼苗对-10℃低温的抗性较弱。
低温条件下植物体内的可溶性糖不断积累,其主要是作为渗透调节物质和防脱水剂而起作用,可以降低细胞的水势并增强其持水力[9-12]。本研究中,不同种源香椿幼苗均可通过提高可溶性糖含量来增强自身的抗寒能力。-5℃条件下香椿幼苗叶片中的可溶性糖含量急剧升高,这是细胞拥有抗寒能力的具体表现;而在-10℃条件下其可溶性糖含量的增加幅度明显小于0℃和5℃条件下,与束缚水含量的变化一致,进一步说明1年生香椿幼苗对-10℃低温的抗性较弱。
目前,尽管对脯氨酸在植物体内的积累是否可作为抗寒性指标还存在较大分歧,但许多研究者认为在低温胁迫条件下体内大量积累脯氨酸是植物对低温的适应性反应[13-15]。刘友良等[16]认为:脯氨酸对未经抗寒锻炼的原生质膜有保护作用,其机制可能是增加了质膜中蛋白质之间的亲和力,从而增强了膜结构在冰融过程中的稳定性;但也有研究表明细胞内游离脯氨酸含量与植物抗寒性无关[17]。Jackson等[18]发现自然越冬过程中皱溪菜〔Prasiola crispa(Lightf.) Menegh.〕的脯氨酸含量随温度下降而降低,并认为细胞内游离脯氨酸在逆境胁迫下的积累可能是对胁迫的一种适应,也可能是细胞结构和功能受损的表现之一。本研究中,低温胁迫下不同种源香椿幼苗叶片中脯氨酸含量升高,作者认为脯氨酸是香椿细胞内的渗透调节物质之一,能调节细胞膜的稳定性、维持细胞水分平衡,甚至具有避免细胞遭受冰冻的保护作用。在-10℃低温下,叶片中的脯氨酸含量缓慢增加,预示着伤害程度的加重和细胞活性的丧失。
当香椿处于低温环境下时,机体通过主动或被动的方式降低自由水含量,并相对提高体内的束缚水含量,维持细胞处于较低的代谢水平,同时提高可溶性糖含量以进一步降低细胞的渗透压,通过提高脯氨酸含量保护细胞膜结构的稳定,从而提高香椿的抗寒性。在5℃至-5℃范围内,香椿幼苗叶片中自由水含量和自由水含量与束缚水含量比值均下降预示着细胞的低温保护机制已启动,随着自由水含量的下降,可溶性糖含量和脯氨酸含量均上升,从而提高了细胞的持水力,并减轻低温胁迫对细胞的伤害。在-10℃条件下叶片的自由水含量较-5℃时有所提高,而可溶性糖和脯氨酸含量却降低,说明细胞持水力进一步下降,细胞内渗透调节物质含量也开始降低,表明供试10个香椿种源幼苗均不能耐受-10℃及以下的低温胁迫。据此,建议对-5℃至-10℃条件下各种源香椿幼苗的耐受性进行详细研究,确定香椿幼苗能耐受的低温阈值,以指导香椿的种植和生产。
[1] 杨玉珍,彭方仁,李洪岩.不同种源香椿芽菜营养成分的变化研究[J].河南农业科学,2007(4):83-85.
[2] 杨玉珍.不同种源香椿抗性机理及综合评价[D].南京:南京林业大学森林资源与环境学院,2008.
[3] 郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,2001:23-24.
[4] 王晶英,敖 红,张 杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003.
[5] 严寒静,谈 锋.栀子叶片生理特性与抗寒性的关系[J].植物资源与环境学报,2005,14(4):21-24.
[6] 佘文琴.低温胁迫下番荔枝叶片若干生理生化指标的变化[J].福建农林大学学报:自然科学版,2006,35(2):161-164.
[7] 朱 进.低温胁迫下不同西葫芦品种抗寒性生理指标的比较[J].湖北农学院学报,2004(2):106-108.
[8] 杨佳明,司龙亭,闫世江,等.黄瓜耐低温相关指标的初步研究[J].安徽农业科学,2007,35(3):645-646.
[9] 王 毅,杨宏福,李树德.园艺植物冷害和抗冷性的研究[J].园艺学报,1994,21(3):239-244.
[10] 朱 月,赵雪梅,唐立红,等.低温对几种引种紫斑牡丹叶片可溶性糖含量的影响[J].北方园艺,2012(2):62-64.
[11] 徐 龙,唐 燕,王新建.不同酸枣实生苗抗寒性差异比较[J].河南农业科学,2012,41(10):136-141.
[12] 林 艳,郭伟珍,徐振华,等.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28 (25):68-72.
[13] 张天翔,林宗铿,曹明华,等.不同甜椒品种抗寒性研究初报[J].福建农业学报,2014,29(2):160-164.
[14] 裴 文,李 鹏,裴海潮,等.低温条件下9种木兰科植物抗寒性研究[J].河南农业科学,2014,43(4):101-105.
[15] 马艳芝,客绍英.柴胡幼苗越冬抗寒性及其相关生理指标筛选[J].西北植物学报,2014,34(4):786-791.
[16] 刘友良,STEPONKUS P L.脯氨酸对黑麦原生质体膨胀势的影响[J].植物生理学报,1990,16(1):25-30.
[17] LEIGH R A,AHMAD N,WYN JONES R G.Assessment of glycinebetaine and proline compartmentation by analysis of isolated beet vacuoles[J].Planta,1981,153:34-41.
[18] JACKSON A E,SEPPELT R D.The accumulation of proline in Prasiola crispa during winter in Antarctica[J].Physiologia Plantarum,1995,94:25-30.
(责任编辑:佟金凤)
Differences in water and osmoregulation substance contents in Toona sinensis from different provenances under low temperature stress and their correlation to cold tolerance YANG
Yuzhen1,CHEN Gang1,PENG Fangren2,WANG Guoxia1,LUO Qing1,MA Xiao3(1.College of Life Sciences,Zhengzhou Normal University,Zhengzhou 450044,China;2.College of Forestry,Nanjing Forestry University,Nanjing 210037,China;3.Department of Environment Artistic Engineering, He’nan Vocational and Technical College,Zhengzhou 450046,China),J.Plant Resour.&Environ. 2014,23(4):47-54
Taking ten provenances of Toona sinensis(A.Juss.)Roem.from different locations as researching subjects and temperature 25℃as the control,changes in water content indexes(including contents of total water,free water and bound water,and ratio of free water content to bound water content)and osmoregulation substance content(including soluble sugar and proline contents)in leaf under low temperature stress conditions of 5℃,0℃,-5℃and-10℃were compared,and correlations between these indexes and the low semilethal temperature(LT50)were analyzed.The results show that under conditions from 5℃to-5℃,total water content,free water content and ratio of free water content to bound water content in leaf of T.sinensis seedlings from different provenances all arelower than those of the control,and above indexes of most provenances decrease gradually with decreasing of temperature;bound water content in leaf of seedlings from different provenances is higher than that of the control and reaches the highest value under condition of 0℃;contents of soluble sugar and proline in leaf of seedlings from most provenances increase continuously with decreasing of temperature.Under condition of-10℃,total water content and free water content in leaf of all provenances and ratio of free water content to bound water content in leaf of most provenances all are higher than those under condition of-5℃,but contents of bound water,soluble sugar and proline all are lower than those under condition of-5℃.The results of correlation analysis show that under condition of 5℃,there is significantly negative correlation between bound water content and LT50,and there is significantly positive correlation between ratio of free water content to bound water content and LT50,while under conditions of 0℃, -5℃and-10℃,there is no significantly negative and significantly positive correlations between the two indexes and LT50,respectively.There is significantly positive correlation between free water content in leaf and LT50under conditions of 5℃and-5℃,while there is no significantly positive correlation between them under conditions of 0℃and-10℃.There is no significantly negative correlation between contents of soluble sugar and proline and LT50under condition of 5℃,while there is significantly negative correlation between them under conditions of 0℃,-5℃and-10℃.It is suggested that ten provenances tested of T.sinensis all are not tolerant to-10℃low temperature stress,the tolerance threshold of T.sinensis to lower temperature should be confirmed from-5℃to-10℃.
Toona sinensis(A.Juss.)Roem.;provenance;water content;osmoregulation substance; cold tolerance;correlation analysis
Q945.78;S644.4
A
1674-7895(2014)04-0047-08
10.3969/j.issn.1674-7895.2014.04.07
2014-03-26
河南省科技攻关项目(112102110153);郑州师范学院资助项目(2012080)
杨玉珍(1965—),女,河南信阳人,博士,教授,主要从事植物生理生态方面的研究与教学工作。

