一种新的培养人胚胎干细胞的包被基质
朱海林,巩慧,周向雅,杨金亮,魏于全,陈慧敏
(1.四川大学生物治疗国家重点实验室,成都 610041;2.江阴司特易生物技术有限公司,江苏江阴 214400)
研究报告
一种新的培养人胚胎干细胞的包被基质
朱海林1,2,巩慧2,周向雅2,杨金亮1,魏于全1,陈慧敏1,2
(1.四川大学生物治疗国家重点实验室,成都 610041;2.江阴司特易生物技术有限公司,江苏江阴 214400)
目的开发一种新的培养人胚胎干细胞(hESCs)的包被基质,使hESCs的培养更加简便。方法用甲醇固定的小鼠胚胎成纤维细胞(MEF)作为包被基质,人胚胎干细胞系X-01在该基质上生长,每隔5~6 d传代一次,培养10代后,对人胚胎干细胞特性进行检测,包括细胞形态、碱性磷酸酶染色、相关多能性基因的表达和分化能力。结果hESCs在新的基质上生长良好,经10次传代后仍能保持典型的hESCs克隆形态。碱性磷酸酶染色阳性,免疫荧光染色Oct4、SSEA4、Tra-1-60为阳性,体外分化可形成拟胚体。结论此种固定的基质可以大量制备,长期保存,并可以长期维持hESCs的未分化状态,为人胚胎干细胞的体外扩增探索出了一个新的途径。
人胚胎干细胞;小鼠胚胎成纤维细胞;甲醇固定;基质;MEF蛋白质复合物
自从1998年获得第一个人胚胎干细胞(human embryonic stem cells,hESCs)细胞系[1],hESCs常用培养方法是在小鼠胚胎成纤维细胞(Mouse embryonic fibroblast,MEF)上进行培养。这种共培养体系可以很好地维持hESCs的生长,但是操作过程非常繁琐。首先将P3代的MEF细胞用丝裂霉素C或伽马射线处理,使其失去增殖能力。其次在hESCs培养前需要预铺MEF,MEF的状态和密度都直接影响着hESCs的生长。为了简化培养体系,很多人尝试用各种细胞外基质代替饲养层细胞。2001年,Xu等[3]用基质胶(Matrigel)作为包被材料,包被培养耗材,成功地培养了hESCs。至今,在无饲养层培养hESCs体系中,基质胶是最常用的包被材料。但是基质胶来源于小鼠EHS肉瘤,可能含有致瘤物质。Ludwig等[4]用含有胶原、层粘连蛋白、纤连蛋白、玻连蛋白的ECM混合物或分别用单独一种ECM蛋白包被,取代基质胶。尽管ECM蛋白包被表面代替了饲养层细胞,但是它们并不适合hESC的大量扩增,首先,生产和纯化这些蛋白的成本非常高;其次,包被纯化蛋白需要优化条件。比如,需要达到一定的厚度;需要在无菌条件下进行很长时间(几小时)的包被[5]。所有这些都限制了它们的大规模应用。Stelling等[6]研究发现MEF表面的硫酸乙酰肝素对hESCs的生长很重要,他们用70%乙醇固定的MEF作为hESCs生长的基质,将污染Neu5Gc鼠源成分的hESCs细胞比例降低了30%[2]。本文在此方法的基础上做了改进,选择了90%的甲醇固定的MEF作为hESCs生长的基质,这种基质制备方法简单,可大量制备并在4℃长期保存,为hESCs的体外扩增提供了一个新的途径。
1 材料和方法
1.1 材料
1.1.1 细胞及实验动物
本实验所用的人胚胎干细胞系X-01[7]购自上海斯丹赛生物技术有限公司。所用的实验动物是3只孕12.5d的SPF级CF-1小鼠(MEF的来源),雌性,8周龄,体重30~35 g。来源于北京维通利华实验动物技术有限公司【SCXK(京)2011-0011】。实验在四川大学生物治疗国家重点实验室【SYXK (川)2009-045】
1.1.2 主要试剂与仪器
胎牛血清 (Hyclone,SV30087.02)、DMEM (Hyclone,SV30022.01B)、DMEM-F12(Hyclone, SV30022.01B)、血清替代物 (knockout serum replacement,KSR)(Gibco,10828-028)、谷氨酰胺(Corning,R25-005)、β-巯基乙醇 (Sigma, M7522)、非必需氨基酸(Gibco,11140)、碱性成纤维细胞生长因子 (bFGF)(Peprotech,100-18B)、IV 型胶原酶 (type IV collagenase) (Gibco, 17104019)、分散酶(dispase)(Gibco,17105041)、0.25% 胰蛋白酶(Gibco,25200);CO2细胞培养箱(Thermo,3111,美国),超净台(YJ-VS型,无锡),荧光倒置相差显微镜(Leica,DM1300,德国)。
1.2 实验方法
1.2.1 MEF的分离和培养
将孕12.5 d的CF-1小鼠安乐死,无菌条件下取出CF-1小鼠的子宫,PBS漂洗,取出胎鼠;去除胎鼠的头、内脏和四肢;将胎鼠躯干剪成约1 mm3的碎块,0.25%胰酶消化5 min;加入含10%胎牛血清的DMEM培养基终止消化,吹打为单细胞悬液,将细胞接种于细胞培养瓶中,置于37℃,5% CO2细胞培养箱中培养。将传至第三代的MEF细胞用剂量30 Grey伽马射线照射,使其失去增殖能力,作为hESCs传统培养方法的饲养层。
1.2.2 90% 甲醇固定MEF基质的制备
将P3代MEF培养2~3 d达到80%~90%汇合率后用PBS洗一次,加入90%甲醇,室温固定5~10 min,吸掉,超净台里吹干,4℃保存。
1.2.3 hESCs的培养
在灭活的MEF饲养层上,hESCs按传统方法培养,DMEM/F12加入20%的KnockoutTMSerum Replacement(KSR),10 ng/mL bFGF,1% NEAA, 0.5%L-谷氨酰胺,0.1 mmol/Lβ巯基乙醇。hESCs的传代用1 mg/mL的 IV型胶原酶37℃ 消化30min,吹打成合适大小即可。在甲醇固定的MEF基质上,hESCs的培养条件为DMEM/F12加入20%的KnockoutTMSerum Replacement(KSR),10 ng/mL bFGF,1%非必需氨基酸(NEAA),0.5%L-谷氨酰胺,0.1 mmol/Lβ巯基乙醇和1~2倍的MEF PM。hESCs的传代用1 mg/mL的dispase(分散酶)37℃消化10 min,吹打成合适大小即可。
1.2.4 hESCs的相关检测
(1)hESCs碱性磷酸酶染色检测:使用上海斯丹赛公司的碱性磷酸酶染色试剂盒对生长在甲醇固定基质板上第10代的hESCs进行染色。具体操作步骤见试剂盒说明书。
(2)hESCs特异性抗原的检测:将 hESCs在固定化的基质上培养10代后,取适量细胞接种于包被了固定化基质的24孔板内,培养3 d后,4%多聚甲醛室温固定30 min,PBS洗3次,每次5 min;在无水乙醇中浸泡两次,每次20 min(仅限于核蛋白,如Oct4);加入含5%BSA和0.4%Triton-X 100的PBS 37℃封闭1h,分别加入小鼠抗人一抗 OCT4、SSEA4、Tra-1-60,4℃ 过夜;PBS洗3次,每次5 min,分别加入荧光标记的羊抗鼠二抗,37℃孵育1h,PBS洗3次,每次5 min加入细胞核染料DAPI,室温5 min,PBS洗涤后荧光显微镜下观察拍照。
(3)hESCs体外分化能力检测:将生长在甲醇固定基质板上第10代的hESCs用1 mg/mL dispase(分散酶)消化下来,吹打成略小于正常传代大小的团块,加入EB培养基(80%DMEM/F12,20%的KSR,1% NEAA,0.5%L-谷氨酰胺,0.1 mmol/Lβ巯基乙醇)悬浮培养在低吸附培养板上,隔2~3 d换液一次,每日观察细胞形态变化。
2 结果
2.1 在甲醇固定的MEF基质培养板上生长的hESCs的相关鉴定
2.1.1 hESCs的形态学观察
在甲醇固定浓度分别是50%(图1A)、70%(图1B)、80%(图1C)的MEF基质板上,hESC克隆形态松散,边界模糊。在固定浓度100%(图1D)的MEF基质板上,hESC克隆贴壁不佳。而在固定浓度90%(图1E)的MEF基质板上,hESC克隆形态致密,边缘界限清晰,无分化迹象,与灭活的MEF上生长的hESCs(图1F)相比,克隆形态略显不规则。
2.1.2 hESCs的碱性磷酸酶染色和多能性基因表达的鉴定
在甲醇固定MEF基质上培养10代后,hESCs的碱性磷酸酶染色鉴定为阳性(图2A),Oct4(图2C), SSEA4(图2E),Tra-1-60(图2G)的免疫染色阳性。说明甲醇固定的MEF基质板可以很好地维持hESCs的多能性(图2见彩插5)。
2.1.3 hESCs体外分化能力检测
将甲醇固定的基质上生长的hESCs消化下来吹打成小块,悬浮培养在低吸附培养板上,经过一周的培养后形成拟胚体(图3)。
2.2 MEF PM对于hESCs在MEF基质板上的生长是必须的

注:A-E:生长在不同浓度甲醇固定MEF基质上的hESCs,甲醇固定浓度分别是A:50%,B:70%, C:80%,D:100%,E:90%;F:生长在灭活的MEF饲养层上的hESCs。图1 生长在灭活的MEF饲养层上和固定化基质板上的hESCs形态特征Note:A-E:hESCs grew on MEF substrate which was fixed with different concentrations ofmethanol.The concentration ofmethanolwas A:50%,B:70%,C:80%,D:100%,E:90%;F:hESCs grew on inactivated MEF feeder cellsFig.1 Morphology of hESCs grew on the inactivated MEF feeder cells and methanol fixed MEF substrate
固定后的MEF不能分泌细胞因子,所以我们在hESCs的培养基中加入了1~2×MEF PM(MEF蛋白质复合物)。结果显示加入了MEF PM的hESCs培养基,与甲醇固定的MEF基质板配合使用可以很好地维持hESCs的生长(见图4)。

注:拟胚体形态。图3 hESCs体外分化能力检测Note:Morphology of the embryoids.Fig.3 Assessment of the ability of hESCs to differentiate into embryoids in vitro

注:A:hESC培养基中加了2×MEF PM;B:hESC培养基中未加MEF PM。图4 MEF PM可以维持hESCs在固定化MEF基质板上的生长Note:A:hESCmedium with 2×MEF PM;B:hESCmedium without MEF PM.Fig.4 MEF PM supports the growth of undifferentiated hESCs on fixed MEF substrate.
2.3 甲醇固定化MEF基质培养板可以长期保存
我们比较了4℃存放不同时间的甲醇固定化MEF基质培养板,支持hESCs生长的能力。结果显示,4℃存放三个月的甲醇固定化MEF基质培养板,仍然能维持hESCs未分化地生长(见图5)。
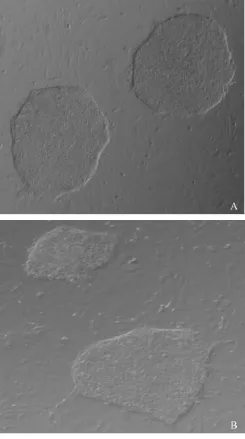
注:A:hESCs生长在4℃存放一周的甲醇固定化MEF基质培养板上;B:hESCs生长在4℃存放3个月的甲醇固定化MEF基质培养板上。图5 甲醇固定化MEF基质可以长期保存Note:A:hESCs grew on methanol-fixed MEF substrate that had been stored at4℃ for 1 week;B:hESCs grew onmethanol-fixed MEF substrate that had been stored at 4℃ for 3 monthsFig.5 Methanol-fixed MEF substrate can be stored for a long time
3 讨论
hESCs需要在合适的基质上生长。传统的方法是在灭活的MEF上培养hESCs。这种培养方法耗时且繁琐,首先需要将P3代的MEF细胞用丝裂霉素C或γ射线灭活,让其不再具有增殖能力。MEF铺板1~2d后再将hES放上去,MEF的密度需准确计算,过多或过少的MEF细胞密度都会影响hESCs的生长。灭活的MEF细胞培养7~10 d后就不能支持hESCs的生长。我们采用了90%甲醇固定MEF作为基质,使hESCs的培养变得更加简便。MEF不需灭活,正常培养2~3 d达到80%~90%的汇合率便可进行甲醇固定。固定后的基质板可以在4℃长期保存,所以用这种方法可以一次性大量制备供hESCs的长期培养所用的培养耗材。之前也有报道用化学固定MEF作为基质,2012年,Yue等[8]用2.5%的戊二醛固定饲养层作为基质培养小鼠胚胎干细胞。但是戊二醛固定后需要反复冲洗,增加了操作步骤,且我们的实验证明戊二醛固定后的基质不适合培养hESCs(结果尚未发表)。2012年,Stelling等[6]用70% 乙醇固定MEF作为基质培养hESCs,取得了较好的结果。但是戊二醛和乙醇固定后,细胞形态都变得模糊。我们采用了甲醇固定,因为甲醇作为固定剂可以很好地维持饲养层细胞的形态。选择90%的甲醇固定浓度是因为过低的浓度(50%,70%,80%)固定不牢,MEF细胞容易脱落,hESCs在上面生长的形态松散,易于分化。过高的浓度(100%)固定后,hESCs的贴壁性下降。90%甲醇固定后的包被基质,易于干燥,不会残留有毒物质,易于贴壁。
灭活的饲养层细胞除了提供hESCs生长所需的基质,还可分泌细胞因子,而固定后的MEF不再具有分泌细胞因子的功能,所以需要加入MEF的条件培养基。条件培养基的收集方法是将MEF培养至100%汇合后,加入hESC的完全培养基,每隔24 h收集一次。收集到的条件培养基与新鲜的hESCs完全培养基1∶1混合后,就可以用于hESCs无饲养层条件下的培养。条件培养基中不仅含有MEF分泌的细胞因子,还含有MEF的代谢产物,这些代谢产物是不利于hESCs生长的。而我们研发的MEF PM大大降低了MEF的代谢产物,含有的细胞因子浓度也更高,可以达到条件培养基中所含细胞因子浓度的100倍。
碱性磷酸酶的活性,核抗原(Oct4),膜抗原(SSEA4),胞浆抗原(Tra-1-60)的表达以及体外分化形成拟胚体,是检测hESCs多能性的指标。用我们制备的甲醇固定MEF基质板结合使用加入了终浓度1~2倍的MEF-PM的hESCs完全培养基,hESCs连续培养10代后,仍然保持典型的hESCs克隆形态,碱性磷酸酶染色阳性,免疫荧光染色显示Oct4,SSEA4, Tra-1-60表达为阳性,体外分化可形成拟胚体。说明甲醇固定MEF基质可以很好地维持hESCs的多能性。
hESCs细胞具有分化为三胚层的多能性,在临床上的应用前景广阔。临床级别的hESCs培养系统必须是无异源成分的,而MEF细胞表面会表达Neu5Gc这种鼠源性成分,所以在hESCs与MEF共培养体系中,hESCs污染了异源物质。采用固定MEF作为基质,一定程度上可能会减少异源成分的污染。在以后的研究中,我们将选取一些人源的饲养层细胞,比如人脐带间充质细胞[9],制备无异源成分的包被基质。MEF全细胞固定还有一些问题需要解决,hESCs在该基质上长期传代后,贴壁性会略有下降,可能是MEF分泌的一些促进hESCs贴壁的细胞外基质粘附在培养板上,在MEF全细胞固定的过程中被MEF细胞遮盖,影响了hESCs的贴壁。在今后的研究中,我们将采取一些方法,让促进hESCs贴壁的细胞外基质能充分暴露,并将寻找一些人源性的饲养层细胞,制备全人源的包被基质。
(本文图2见彩插5。)
[1] Thomson JA,Itskovitz-Eldor J,Shapiro,SS,et al.Embryonic stem cell lines derived from human blastocysts[J].Science, 1998,282:1145-1147.
[2] Martin MJ,Muotri A,Gage F,etal.Human embryonic stem cells express an immunogenic nonhuman sialic acid[J].Nat Med, 2005,11(2):228-232.
[3] Xu C,Inokuma MS,Denham J,et al.Feeder-free growth of undifferentiated human embryonic stem cells[J].Nat Biotechnol. 2001,19(10):971-974.
[4] Ludwig TE,Levenstein ME,Jones JM,etal.Derivation of human embryonic stem cells in defined conditions[J].Nat Biotechnol, 2006,24(2):185-187.
[5] Yap LY,Li J,Phang IY,et al.Defining a threshold surface density ofvitronectin for the stable expansion of human embryonic stem cells[J].Tissue Eng Part CMethods,2011,17(2):193-207.
[6] Stelling MP,Lages YM,Tovar AM,et al.Matrix-bound heparan sulfate is essential for the growth and pluripotency of human embryonic stem cells[J].Glycobiology,2013,23(3):337-345.
[7] Wu Z,Li H,Rao L,et al.Derivation and characterization of human embryonic stem cell lines from the Chinese population[J].J Genet Genomics.2011,38(1):13-20.
[8] Yue XS,Fujishiro M,Nishioka C,et al.Feeder cells support the culture of induced pluripotent stem cells even after chemical fixation[J].PLoSOne,2012,7(3).e32707:1-9.
[9] 刘峰,徐永胜,俞海燕,等.人脐带间充质干细胞作为维持人胚胎细胞生长饲养层细胞的研究[J].中国实验动物学报, 2011,19(4):271-276.
Development of a new coating substrate for human embryonic stem cell culture
ZHU Hai-lin1,2,GONG Hui2,ZHOU Xiang-ya2,YANG Jin-liang1,WEIYu-quan1,CHEN Hui-min1,2
(1.State Key Laboratory of Biotherapy,Sichuan University,Chengdu 610041,China; 2.Jiangyin StemEasy Biotech,Ltd.,Jiangyin,Jiangsu 214400)
ObjectiveTo reduce the animal component contamination for human embryonic stem cells(hESCs) and to simplify hESCs culture process,we develop a new coating substratewhich can support the hESCs growth without differentiation,and is easy to store and use.MethodsMouse embryonic fibroblasts(MEF)were fixed on the surface of plate bymethanol.hESCs were cultured on this new substrate and were passaged every 5 to 6 days.After 10 passages,we checked the cellmorphology,alkaline phosphatase expression,embryonic specificmarkers and the differentiation ability in vitro.ResultsAfter10 passages,the hESCs grew well on this new substrate andmaintained the typical hESCsmorphology.Alkaline phosphatase staining was positive.Immunofluorescence staining showed that the expressions of Oct4,SSEA4, Tra-1-60 were positive.The cells formed embryoid body in vitro.ConclusionsThismethanol-fixed MEF substrate can support the growth of undifferentiated hESCs.The coating material can be produced in large scale and stored for a long time.It provides a new and relatively easy way to amplify hESCs.
Human embryonic stem cell;Mouse embryonic fibroblast;Methanol fixation;Mouse embryonic fibroblast,MEF-protein complex
Q95-33
A
1005-4847(2014)03-0088-05
10.3969/j.issn.1005-4847.2014.03.018
2013-10-08
朱海林(1984-)女,四川大学生物治疗国家重点实验室在读硕士。研究方向:人胚胎干细胞的培养体系的研究。E-mail: zhusealin@sina.com
陈慧敏,四川大学客座教授,博士生导师。E-mail: huimin.chen@stemeasy.com

