骨髓间充质干细胞经BDNF基因修饰后移植治疗大鼠半横断脊髓损伤的电生理研究
纪萌,刘玉秋,赵京杰,金成文,李鑫,魏志新,王晓萃
(1.潍坊医学院,潍坊 261053;2.潍坊医学院机能学实验室,潍坊 261053;
3.潍坊医学院形态学实验室,潍坊 261053;4.潍坊医学院人体解剖学教研室,潍坊 261053)
研究报告
骨髓间充质干细胞经BDNF基因修饰后移植治疗大鼠半横断脊髓损伤的电生理研究
纪萌1,刘玉秋1,赵京杰1,金成文2,李鑫2,魏志新3,王晓萃4
(1.潍坊医学院,潍坊 261053;2.潍坊医学院机能学实验室,潍坊 261053;
3.潍坊医学院形态学实验室,潍坊 261053;4.潍坊医学院人体解剖学教研室,潍坊 261053)
目的采用电生理的研究方法,观察脑源性神经营养因子(BDNF)基因修饰的骨髓间充质干细胞对脊髓损伤的修复作用。方法随机将大鼠分成3组:空白组10只(只切除椎板,暴露脊髓硬脊膜);SCI组10只;SCI术后细胞移植组10只;从以上三组大鼠随机抽取8只于细胞移植后1 d、7 d、14 d、21 d、30 d、60 d进行SEP(皮层体感诱发电位)、MEP(运动诱发电位)等电生理检测技术,并观察大鼠的运动评分恢复程度。结果细胞移植4d后,大鼠饮食和活动开始增加;后肢变化过程如下:损伤后1~4 d损伤侧后肢迟缓性瘫痪,拖地行走,损伤对侧后肢由损伤初期的运动减弱逐渐恢复,损伤后5~9 d损伤侧后肢痉挛性瘫痪;10~14 d损伤侧下肢恢复少量活动,损伤对侧后肢恢复至较损伤前稍弱的状态;15~21 d损伤侧后肢活动能力较之前有明显改善,至30 d损伤侧后肢活动能力及肌张力恢复程度最明显,30 d以后无更明显改善。免疫组化发现损伤处诱导标记的骨髓间充质干细胞存活,行为学观察发现细胞移植改善了损伤大鼠运动能力。结论骨髓间充质干细胞经BDNF基因修饰后可以促进脊髓损伤大鼠的神经再生及部分传导功能恢复。
骨髓间充质干细胞;BDNF基因;脊髓损伤;电生理
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)经多年的研究被证实具有多向分化潜能。离体培养BMSCs并使之增殖并分化为神经细胞成为目前的研究热点。脊髓损伤(spinal cord injury, SCI)是中枢神经系统的一种严重的创伤性疾病,脊髓损伤后神经纤维难以再生是导致损伤后修复困难的重要原因。神经纤维再生障碍的主要原因是损伤形成了一个不利于轴突生长的微环境,通常会引起抑制轴突生长和促进轴突生长因素之间的失衡。因而,对脊髓损伤后神经保护及再生方面仍是一个难题和亟待解决的问题,选择合适的治疗手段来促进脊髓损伤后的修复是治疗脊髓损伤的重要方法。本研究目的是将BDNF基因修饰的骨髓间充质干细胞移植到大鼠损伤脊髓内,探讨细胞移植治疗脊髓损伤的是否可行,运用体感诱发电位技术(somatosensory evoked potential,SEP)和运动诱发电位(motor evoked potential,MEP)技术等电生理检测手段来观察实验效果,为骨髓干细胞移植治疗脊髓损伤将来应用于临床提供可靠的实验基础。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
青链霉素混合液(中杉金桥,中国北京)、BTX ECM830电转染系统(BTX公司,美国)、无支原体胎牛血清(杭州四季青,中国浙江)、G418(Amresco公司,美国)、L-glucose DMEM培养基、胰蛋白酶(Sigma,美国)、胶原酶Ⅳ(Sigma,美国)、倒置显微镜(O-lympus,日本)、细胞培养箱(Thermo公司,美国)。
1.1.2 实验动物
清洁级成年SD大鼠30只,雌雄不拘,体重250~270 g,购自山东中医药大学实验动物中心【SCXK (鲁)2011-0003】。随机将大鼠分成3组:空白组10只(只切除椎板,暴露脊髓硬脊膜);SCI组10只(进行SEP、MEP)检测;SCI术后细胞移植组10只;从每组中随机抽取8只于细胞移植后1 d、7 d、14 d、21 d、30 d、60 d进行检测。具体操作参考[5]。
1.2 方法
1.2.1 骨髓间充质干细胞培养方法、大鼠脊髓半横断损伤模型制作方法详见[1-2]。
1.2.2 p IRESneo-EGFP-BDNF质粒转染骨髓MSCs
待第3代骨髓间充质干细胞细胞融合度达到50%~60%时,PBS冲洗三遍,0.125%胰酶,37℃消化3 min,L-DMEM完全培养基终止消化,1000 r/min,离心5 min,依照NeuroPORT-ERTM转染试剂(购自BTX公司)说明书设置电转化参数:电压280 V,时间20 ms,携带BDNF基因的质粒pIRESneo-EGFP-BDNF转染骨髓间充质干细胞,转染后培养72 h,再用含100μg/mL G418的15%胎牛血清L-DMEM培养基进行筛选,48 h换液,加维持量G418筛选10~14 d, 15%FBSL-DMEM完全培养基继续培养7 d,倒置显微镜下观察转染细胞形态。
1.2.3 细胞移植及其组织学观察
用微量注射器抽取经BrdU标记的总细胞数约为6×105细胞悬液,将针头以45度斜角向下缓慢注入到脊髓损伤临近区域的灰白质交界处(约距脊髓表面0.5 mm),注射时间约持续l0 min,注射完毕留针5 min,针取出后,注射孔用医用生物蛋白胶封闭。对照组按照同样操作步骤注射与细胞悬液等量PBS缓冲液。电生理检测后(1 d、7 d、14 d、21 d、30 d、60 d)灌注固定观察移植后细胞存活情况(另文报道)。
1.2.4 皮层体感诱发电位(SEP)检查
造模前从各组随机抽取8只,对造模前以及造模后1 d、7 d、14 d、21 d、30 d、60 d行CSEP检查。动物用10%水合氯醛(3 mL/kg)腹腔注射致浅麻醉状态:角膜反射消失,呼吸匀称,节律规整。俯卧位固定于立体定位架上,先暴露大鼠右侧大脑感觉皮层,并在其表面安置记录电极,左额皮下插入参考电极;再分离暴露大鼠左侧坐骨神经,将坐骨神经置于勾状双极电极,周围用石蜡油棉球包裹绝缘。坐骨神经给予电刺激,刺激强度5.0 V,波形宽度0.1 ms,刺激频率10 Hz。滤波带通300 Hz,串刺激10次,信号经放大器放大后,电脑采集并储存待分析。
1.2.5 运动诱发电位(MEP)检查
造模前从各组随机抽取8只,对造模前以及造模后1 d、7 d、14 d、21 d、30 d、60 d行MEP检测。10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,具体操作方法同上。待大鼠麻醉后,俯卧位固定于立体定位架上。暴露右侧大脑感觉运动皮层将一枚银球电极(阴极)置于其上,T12脊髓背侧硬膜表面放置记录电极;另外在硬腭黏膜下(阳极)和T12邻近椎旁肌肉放置参考电极,接地电极置于大鼠颈部皮下。给予皮层单个电刺激,刺激强度5.0 V,波幅宽度0.1 ms,刺激频率10 Hz,每次记录10个完整波形,放大器放大信号后收集储存待分析。
1.2.6 运动功能评分(BBB评分)
造模结束后由不知情者按以下评分标准对各组各时间点动物损伤侧后肢运动功能进行评价。评分标准:损伤侧没有运动,且该侧后肢肌力为零记为0分;损伤侧后肢有轻微运动,但不能负重记为1分;损伤侧后肢有明显运动,但不能负重记为2分;损伤侧能行走数步,但不持久记为3分;能缓慢行走,但步态不稳记为4分;正常行走记为5分。
1.2.7 统计学处理
记录各组BBB评分、SEP及MEP数据,分别采用SPSS 17.0软件包处理,样本均数采用(±s)表示,采用重复测量数据的方差分析各组数据。
2 结果
2.1 大鼠骨髓MSCs的形态学观察及鉴定
全骨髓接种到培养瓶中,5%CO2培养箱连续培养7 d,除去培养液中悬浮细胞,只留贴壁的圆形细胞,此细胞即为骨髓间充质干细胞,新生的骨髓间充质干细胞折光能力很强;随着换液,细胞逐渐呈集落性生长(图1A),细胞形态也开始发生变化,由最初的类圆形转变近似梭型,大约取材后的12 d左右,原代细胞增殖至密度大于85%,即可进行细胞传代。
2.2 BDNF基因修饰的骨髓间充质干细胞的形态学观察
第三代骨髓间充质干细胞经转染后,大部分细胞形态较一致,但是部分细胞死亡。没有成功转染基因的骨髓间充质干细胞在G418筛选的过程中逐渐死亡,转染成功的细胞生长状态良好(图1B,彩插13)。细胞转染后,细胞数量较转染前减少,生长周期较转染前放缓,但细胞形态稍有增大,胞体突起数量增多(图2,彩插13)。
2.3 大鼠脊髓损伤后行为学观察
术后8 h,所有大鼠完全清醒,除空白组大鼠外其他两组所有受试鼠均出现脊髓休克综合征,术后前3 d自主活动及饮食较损伤前均减少,伴有轻度尿储留,肌张力低,损伤侧肌力0级,损伤对侧肌力较正常明显减弱。细胞移植术4~7 d,饮食、活动稍增加,损伤后,大鼠后肢肌张力和运动变化过程如下:1~4 d损伤侧后肢迟缓性瘫痪,拖地行走,损伤对侧后肢由损伤初期的运动减弱逐渐恢复,损伤后5~9d损伤侧后肢痉挛性瘫痪;10~14 d损伤侧下肢恢复少量活动,损伤对侧后肢恢复至较损伤前稍弱的状态;15~21 d损伤侧后肢活动能力较之前有明显改善,至30 d损伤侧后肢活动能力及肌张力恢复程度最明显,30 d以后无更明显改善。
2.4 实验各组大鼠电生理的变化
各组动物处理前后皮层诱发电位和动作诱发电位的峰值和潜伏期的动态变化分别见表1~4。运动功能评分参见表5。
表1 不同时间点SEP潜伏期比较(±s,ms)Tab.1 Comparison of SEP latency at different time points

表1 不同时间点SEP潜伏期比较(±s,ms)Tab.1 Comparison of SEP latency at different time points
组别Groups造模前Before SCI 1 d 7 d 14 d 21 d 30 d 60 d空白组Blank group 3.13±0.06 3.15±0.02 3.20±0.07 3.19±0.05 3.21±0.05 3.17±0.03 3.12±0.04 SCI组SCIgroup 3.10±0.16 15.33±0.13 13.75±0.10 12.43±0.08 10.16±0.07 9.30±0.07 9.01±0.11移植组Transplantation group 3.15±0.07 15.62±0.13 13.30±0.11 11.13±0.09 7.56±0.11 6.28±0.18 6.09±0.14
表2 不同时间点SEP波幅比较(±s,mV)Tab.2 Comparison of SEP amplitude at different time points

表2 不同时间点SEP波幅比较(±s,mV)Tab.2 Comparison of SEP amplitude at different time points
组别Groups造模前Before SCI 1 d 7 d 14 d 21 d 30 d 60 d空白组Blank group 9.09±0.09 9.03±0.02 9.01±0.11 9.05±0.10 9.10±0.07 9.08±0.07 9.14±0.13 SCI组SCIgroup 9.11±0.13 1.32±0.05 1.99±0.07 2.55±0.13 2.91±0.08 3.39±0.09 3.73±0.11移植组Transplantation group 9.15±0.11 1.39±0.18 2.56±0.25 3.88±0.31 4.82±0.17 5.70±0.23 5.98±0.14
表3 不同时间点MEP潜伏期比较(±s,ms)Tab.3 Comparison of MEP latency at different time points
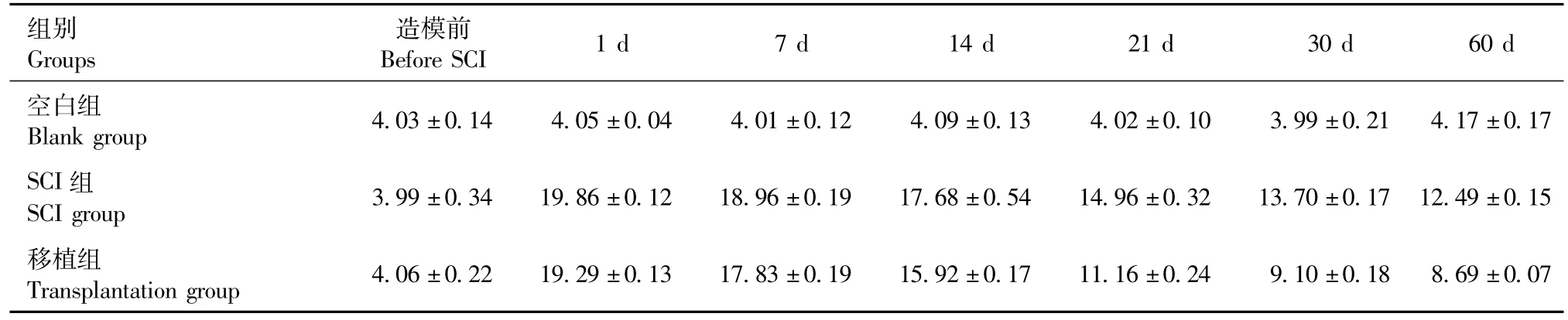
表3 不同时间点MEP潜伏期比较(±s,ms)Tab.3 Comparison of MEP latency at different time points
组别 造模前Groups Before SCI 1 d 7 d 14 d 21 d 30 d 60 d空白组Blank group 4.03±0.14 4.05±0.04 4.01±0.12 4.09±0.13 4.02±0.10 3.99±0.21 4.17±0.17 SCI组SCIgroup 3.99±0.34 19.86±0.12 18.96±0.19 17.68±0.54 14.96±0.32 13.70±0.17 12.49±0.15移植组Transplantation group 4.06±0.22 19.29±0.13 17.83±0.19 15.92±0.1711.16±0.24 9.10±0.18 8.69±0.07
表4 不同时间点MEP波幅比较(±s,mV)Tab.4 Comparison of MEP amplitude at different time points

表4 不同时间点MEP波幅比较(±s,mV)Tab.4 Comparison of MEP amplitude at different time points
组别Groups造模前Before SCI 1 d 7 d 14 d 21 d 30 d 60 d空白组Blank group 16.01±0.15 15.96±0.07 15.99±0.13 16.00±0.17 16.08±0.10 16.05±0.11 16.03±0.08 SCI组SCIgroup 16.07±0.12 4.30±0.21 5.10±0.14 6.01±0.12 8.27±0.22 8.80±0.03 8.91±0.06移植组Transplantation group 16.03±0.24 4.46±0.17 5.16±0.29 7.47±0.14 11.03±0.04 12.56±0.03 12.99±0.14
表5 不同时间点后肢运动BBB评分(±s,分)Tab.5 Hindlimb BBB score at different time points points

表5 不同时间点后肢运动BBB评分(±s,分)Tab.5 Hindlimb BBB score at different time points points
组别Groups造模前Before SCI 1 d 7 d 14 d 21 d 30 d 60 d空白组Blank group 5 5 5 5 5 5 5 SCI组SCIgroup 5 0 0.5 1.0 1.375 2 2.25移植组Transplantation group 5011.75 2.5 3.5 3.75
由表1~4可知:脊髓损伤术后1d,移植组、SCI组与空白组比较:CSEP和MEP潜伏期延长,波幅降低,差异具有显著性(P<0.05);由表2和表4可知:脊髓损伤术后14 d及以后,移植组较SCI组:CSEP和MEP潜伏期恢复程度有显著差异(P<0.05);由表5可知:脊髓损伤14 d以后,移植组较单纯损伤组BBB评分在有显著提高(P<0.05)。
3 讨论
骨髓MSCs具有易于取材、分离培养和体外扩增等优点,无免疫排斥反应并可自体移植,在特定条件下可以诱导分化为神经、骨、软骨、肝、心肌等多种细胞[3-5]。因此我们在以往的实验中选用不同诱导剂和诱导方法将MSCs向神经细胞进行诱导,均取得较理想的实验结果。我们在实验中将诱导标记后的骨髓间充质干细胞直接移植入脊髓损伤处,发现这种方法较尾静脉注射移植、脑脊液注射移植等方法既可以准确的控制干细胞迁移和趋行部位,又能增加损伤处细胞数量。我们的研究表明,脊髓损伤的大鼠在骨髓间充质干细胞移植4 d以后大鼠摄食和活动均开始有所改善,损伤侧后肢肌张力也有轻微改善,损伤后大鼠肌张力和运动变化如下:1~4 d损伤侧后肢迟缓性瘫痪,拖地行走,损伤对侧后肢由损伤初期的运动减弱逐渐开始恢复,损伤后5~9 d损伤侧后肢痉挛性瘫痪;10~14 d损伤侧下肢开始恢复少量活动,损伤对侧后肢恢复至较损伤前稍弱的状态;15~21 d损伤侧后肢活动能力较之前有明显改善。至30 d损伤侧后肢活动能力及肌张力恢复程度最明显,30 d以后无更明显改善通过免疫组织化学(另文报道)检测表明移植的骨髓间充质干细胞能在脊髓损伤处存活。根据行为学观察,脊髓损伤移植治疗后大鼠的运动功能有较明显改善。
MSCs移植后自身可分泌神经营养因子,并促进宿主分泌神经营养因子,从而营养和保护神经。BDNF是一种自泌性促神经生长因子,主要在神经元的胞体内合成,通过自分泌的方式与它自身的受体相结合,从而对神经元发挥广泛的神经营养作用,并能够促进神经元存活、分化及功能表达,也能挽救损伤的脊髓运动神经元和感觉神经元是促进神经元分化以及髓鞘形成不可缺少的神经营养因子[6]。有研究表明,BDNF能促进神经存活,增加其的表达对缺血周围区的损伤修复有重要的促进作用[7],另外,BDNF还能通过调节突触传递及其可塑性来促进树突和轴突的生长并发挥抑制神经元凋亡等作用[8]。有研究发现,通过电针治疗后,BDNF的合成在损伤处有显著提高,这可能是促进神经再生的有效途径[9]。而BDNF有可能是通过受体激酶促进神经细胞存活和分化从而实现胆碱能神经元在体内或者体外培养时的存活和分化,最终发挥促进受损神经的修复的作用[10-11]。Gu等[12]实验发现在脊髓损伤动物脊髓中观察到很少移植的BMSCs分化为神经元样或神经胶质细胞样细胞,但是在致伤后第6周、第8周观察到移植组脊髓损伤空洞的体积明显小于对照组。
仅靠影像学等辅助检查往往难以准确判断和评估脊髓损伤后脊髓的神经功能及其恢复情况。临床通常用神经电生理指标检测和评价损伤后脊髓神经的传导功能。最常用的指标包括皮层体感诱发电位和运动诱发电位。皮层体感诱发电位主要沿本体感觉通路的有髓纤维传导,由神经节、薄束、楔束核和三级神经元组成,通常用来反映本体感觉通路功能状况和结构完整性。我们在实验中发现,切断左侧脊髓后,左侧皮层体感诱发电位波幅明显下降,潜伏期明显延长,而右侧基本正常。我们还观察到:脊髓损伤后神经功能恢复情况与皮层体感诱发电位恢复快慢有一定的关联,伤后短期内,运动功能恢复较佳者,其皮层体感诱发电位也出现较好恢复。运动诱发电位主要用来检测运动神经系统的完整性和反映脊髓损伤的严重程度。损伤脊髓不同部位后,运动诱发电位表现截然不同,我们发现:切断大鼠左侧脊髓,左侧运动诱发电位无法引出,而右侧正常。我们还发现:保留脊髓前索白质神经纤维,运动诱发电位均可引出,而破坏前索纤维者,运动电位难以引出,运动诱发电位的表现与脊髓破坏程度一致;损伤后,短期内运动诱发电位有较快恢复者,其运动功能往往也恢复很好。形态学实验结果表明,运动诱发电位的变化趋势与组织学改变有较好的一致性。对不完全性的脊髓损伤,潜伏期越长,波幅越低,脊髓病变程度往往越严重。分析其原因可能为白质纤维发生脱髓鞘病变,从而导致纤维传导速度下降,另外位于脊髓前角的运动细胞兴奋性降低导致运动诱发电位刺激强度阈值增高也可能是形成因素。
本研究发现可以通过观察动物的皮层体感诱发电位和运动诱发电位的潜伏期、波幅粗略判断脊髓损伤后动物运动功能的缺失程度及预后。但是脊髓损伤后,皮层体感诱发电位和运动诱发电位的传导通路以及诱导的具体机制尚待进一步的探究。
(本文图1,2见彩插13。)
[1] 王晓萃,吴金生,付文玉,等.诱导大鼠间充质干细胞形成的神经元样细胞的形态特征[J].解剖学报,2007,38(1):107 -110.
[2] 吴金生,董爱萍,王晓萃,等.骨髓间充质干细胞移植对大鼠半横断脊髓损伤的修复研究[J].中国实验动物学报.2010, 18(1):56-59.
[3] Alexanian AR.Epigeneticmodifiers promote efficientgeneration of neural-like cells from bone marrow-derived mesenchymal cells grown in neural environment[J].Cell Biochem,2007,100(2): 362-371.
[4] Schwartz RE,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bonemarrow differentiate into functional hepatocyte-like cells[J].JClin Invest,2002,109(10):291-1302.
[5] 段朝霞,张洁元,陈魁君,等.细胞移植治疗脊髓损伤的研究进展[J].中国医药导报.2012,36(12):57-59.
[6] Zhou XF,LiWP,Zhou FH,et al.Differential effects of endogenous brain-derived neurotrophic factor on the survival of axotomized sensory neurons in dorsal root ganglia:a possible role for the p75 neurotrophin receptor[J].Neuroscience.2005,132(3):591-600.
[7] 徐冰,田国萍.脑源性神经营养因子在脑缺血损伤修复反应中的作用[J].中国医药导报.2007,43(1):23-25.
[8] Jin GZ,Cho SJ,Lee YS,etal.Intrastriatal grafts ofmesenchymal stem cells in adult intact rats can elevate tyrosine hydroxylase expression and dopamine levels[J].Cell Biol Int,2009,34(1): 135-140.
[9] Scott AL,Ramer MS.Differential regulation of dendritic plasticity by neurotrophins following deafferentation of the adult spinal cord is independent of p75(NTR)[J].Brain Res,2010,1323:48-58.
[10] Yoshii A,Constantine-Paton M.Postsynaptic BDNF-TrkB signaling in synapsematuration plasticity and disease[J].Dev Neurobiol,2010,70:304-322.
[11] Numakawa T,Suzuki S,Kumamaru E,et al.BDNF function and intracellular signaling in neurons[J].Histol Histopathol,2010, 25:237-258.
[12] Gu W,Zhang F,Xue Q,et al.Transplantation of bone marrow mesenchymal stem cells reduces lesion volume and induces axonal regrowth of injured spinal cord[J].Neuropathology,2010,30 (3):27-30.
Electrophysiological study of BDNF gene-modified mesenchymal stem cell transplantation to repair transversely hem isectioned spinal cord injury in rats
JIMeng1,LIU Yu-qiu1,ZHAO Jing-jie1,JIN Cheng-wen2,LIXin2,WEIZhi-xin3,WANG Xiao-cui4
(1.Weifang Medical University,Weifang 261053,China;2.Department of Physiology;3.Department of Morphology; 4.Department of Human Anatomy,Weifang Medical University,Weifang 261053)
ObjectiveTo study the effects of bonemarrowmesenchymal stem cellsmodified by brain-derived neurotrophic factor(BDNF)gene on the repair of spinal cord injury by electrophysiologicalassay.MethodsThirty healthy Sprague-Dawley rats(male and female)were randomly divided into 3 groups:Blank group,10 rats(removal of the lamina only and exposed spinal duramater);spinal cord injury(SCI)group,10 rats;and cell transplantation after SCI group,10 rats. Eight rats of them were selected randomly and detected their SEP and MEP,and evaluated the degree of recovery of motor scores in the rats at1 d,7 d,14 d,21 d,30 d,and 60 d.ResultSince 4 days after cell transplantation,the process of hind limbs changes was as follows:at the 1-4 days after injury,the injury side hind limb had flaccid paralysis,mopping the floor walk,themovement of contralateral hind limb was gradually recovered from the initial injury,the injury side hind limb had spastic paralysis in 5-9 days after SCI;during10-14 days,the injury side had a few activities;the contralateral side recovered to a less normal state;At15-21 days,activities of the injury side improved obviously,until the30th day.The activ-ity and muscle tension degree of the injury side recoveredmostobviously.After30 days nomore obvious improvementwas observed.Immunohistochemistry showed that the transplantedmesenchymal stem cells,which were induced and labeled firstly, survived at the damage spinal cord,and behavioral observation found that the cell transplantation improved exercise capacity of the rats injured before.ConclusionBonemarrowmesenchymal stem cellsmodified by BDNF gene can partially promote the recovery of nerve transmission function and nerve regeneration.
Mesenchymal stem cells;BDNF gene;Spinal cord injury;Electrophysiology
Q95-33
A
1005-4847(2014)03-0093-05
10.3969/j.issn.1005-4847.2014.03.019
2013-12-02
山东省教育厅资助项目(J11LF15);潍坊医学院大学生科技创新项目(KX2013022)。
纪萌(1987-),男,在读医学硕士。E-mail:Mengge316@163.com
王晓萃(1977-),女,副教授,E-mail: wxcwfmc2003@yahoo.com.cn

