雄性大鼠膀胱出口梗阻两种模型制作方法的比较研究
荆 强,王东文,高宏飞,刘 冲,史 骁
(1.山西医科大学,太原山西 030001;2.山西医科大学第一医院泌尿外科,太原山西 030001)
雄性大鼠膀胱出口梗阻两种模型制作方法的比较研究
荆 强1,王东文2,高宏飞2,刘 冲1,史 骁1
(1.山西医科大学,太原山西 030001;2.山西医科大学第一医院泌尿外科,太原山西 030001)
目的通过采用耻骨后膀胱颈和会阴途径球部尿道部分结扎两种方法,建立雄性大鼠膀胱出口部分梗阻(paritial bladder outlet obstraction,pBOO)模型,并对所建模型进行鉴定和比较,为pBOO后膀胱重构(bladder reconstruction)的深入研究提供一种成活率高,复制性和稳定性较好的动物模型。方法80只健康雄性Wistar大鼠随机分为三组:I组为假手术组(对照组),20只;II组为耻骨后途径膀胱颈部分结扎组,30只;III组为会阴途径球部尿道部分结扎组,30只。依据梗阻时间分别将I组、II组、III组大鼠随机分为2周组和4周组,于术后2周和4周对大鼠行尿动力学检测后,完整切除膀胱测其重量,将精囊腺组织和部分膀胱用4%甲醛固定,HE染色观察组织学变化。结果II组和III组成活率分别为73.3%和80.0%,二者无统计学意义;I组、II组、III组建模手术时间分别为(9.75±2.29)、(17.33±3.54)、(10.77±2.44)min,II组与I组和III组比较差异均有统计学意义;I组、II组、III组的2周组和4周组逼尿肌漏尿点压(detrusor leak point pressure,DLPP)分别为(26.31±2.32)、(27.34±3.93)、(24.68±2.39)mmHg和(26..42±2.41)、(34.23±3.01)、(32.63±3.20)mmHg,I组与II组和III组的4周组比较差异有统计学意义,II组和III组的2周组和4周组比较差异均有统计学意义。结论耻骨后途经膀胱颈部分结扎和会阴途径球部尿道部分结扎两种方法都能成功建立雄性大鼠pBOO模型,与耻骨后途径相比,会阴途径成活率高,手术操作时间短,复制性和稳定性好。
膀胱出口部分梗阻;耻骨后途径;会阴途径;模型,动物
膀胱出口部分梗阻(paritial bladder outlet obstraction,pBOO)是泌尿外科常见的疾病,尤其是男性患者,如良性前列腺增生(benign prostatic hyperplasia,BPH)、尿道狭窄及先天性尿道畸形等都会导致pBOO。越来越多的研究证实pBOO患者伴随的下尿路症状(lower urinary tract symptoms,LUTS)与尿路梗阻后导致的膀胱组织结构和功能改变密切相关。而且临床上约35%~45%的pBOO/LUTS患者通过手术解除梗阻后,并不能有效的缓解储尿/排尿期症状,表明尿路梗阻并非完全是致病原因[1]。目前对于pBOO/LUTS的病理生理机制仍然缺乏足够的认识,因此有必要通过建立一种存活率高,复制性和稳定性较好的实验动物模型,进一步探究其中的潜在机制,为寻求pBOO/LUTS更合理的治疗方法提供依据。
1 材料和方法
1.1 实验动物
健康雄性Wistar大鼠80只,SPF级,体重200g~250g,由中国人民解放军军事医学科学院实验动物中心提供(实验动物质量合格证号SCXK-(军)2012-0004)。山西医科大学生理实验中心动物房饲养,自由进水、饮食,保持动物笼具清洁干燥。大鼠在动物房适应3~5d后采用随机分组的办法将其分为三组:I组为假手术组(对照组),20只;II组为耻骨后途径膀胱颈部分结扎组,30只;III组为会阴途径球部尿道部分结扎组,30只。依据梗阻时间分别随机将三组分为pBOO 2周组和pBOO 4周组。
1.2 pBOO动物模型的构建
1.2.1 耻骨后途径膀胱颈部分结扎组:10%水合氯醛(0.3mL/100g)腹腔内注射麻醉后将Wistar大鼠仰卧位固定,下腹部备皮,碘伏消毒后取下腹部正中(1.5~2.0)cm垂直切口,于腹直肌旁钝性分离后打开腹腔,暴露膀胱,小心钝性分离出膀胱颈,紧贴膀胱颈放置1mm硬膜外导管,于膀胱颈处穿过3-0丝线,以硬膜外导管为支撑,结扎膀胱颈。结扎标准:结扎程度尽可能松,线圈轻轻靠近即可,拔出硬膜外导管时结扎周围组织不被牵动。然后拔出导管,逐层关闭切口。动物放入苏醒室观察,苏醒后放回动物房。
1.2.2 会阴途径球部尿道部分结扎组:准备工作如上所述,会阴消毒后取阴茎阴囊联合处到阴囊中部长约1cm大小的正中垂直切口,钝性分离出球部尿道后将尿道与海绵体分离,于此处穿过3-0丝线,紧贴尿道放置1mm硬膜外导管作为支撑,结扎尿道[2]。结扎标准同上,拔出导管,关闭切口。
1.2.3 假手术组:为了减少因感染导致大鼠死亡的数量,采用会阴切口,尿道分离如上所述,但不结扎,然后关闭切口。三组动物均完整记录手术时间,于实验当天开始以硫酸庆大霉素0.3mL~0.4mL于大腿内侧肌肉注射,连用3d。术后第1天开始自由饮水,限制饮食,保持笼具清洁干燥,所有实验大鼠均在相同条件下饲养。
1.3 尿动力学检查
术后分别对pBOO 2周组和pBOO 4周组通过耻骨上膀胱造瘘途径行尿动力学检测,以20%乌拉坦(1g/kg体重)腹腔麻醉,大鼠仰卧位固定,碘伏消毒下腹部后取正中切口,暴露膀胱,用眼科剪在膀胱顶部剪一小口,将备好的两根硬膜外导管(提前用胶带将两根导管捆绑在一起,将进入膀胱的一端剪成斜面)插入,穿过2-0丝线结扎,使导管固定于膀胱且不漏尿,结扎时被结扎膀胱组织尽可能少。挤压排空膀胱尿液后,两根导管分别连接BL-420生物机能实验系统的压力传感器和微量灌注泵,启动灌注泵,以0.2mL/min的速度灌注37℃生理盐水并开始测压。当尿道口出现第一滴尿液时,记录的即刻压力为漏尿点压力(leak point pressure,LPP)。大鼠行尿动力学检查前已被麻醉,无应力动作出现,因此LPP可以被视为逼尿肌漏尿点压(detrusor leak point pressure,DLPP)[3]。
1.4 膀胱标本称重
尿动力检测完毕后,仔细分离膀胱周围组织,暴露膀胱颈后,自结扎线近端处切取膀胱,去除脂肪组织,用生理盐水冲洗膀胱表面血渍,滤纸吸干表面液体,测膀胱湿重。
1.5 组织学检查
部分膀胱、精囊腺组织4%甲醛液固定12h后常规脱水,石蜡包埋,3.0μm厚切片,置70℃烤箱15h,低温保存,HE染色,光镜观察。
1.6 统计学方法
2 结果
2.1 动物模型的成活率
耻骨后膀胱颈部分结扎组和会阴途径球部尿道部分结扎组各30只,分别死亡8只和6只,两组的成活率分别为73.3%和80.0%,χ2检验P>0.05,两种pBOO动物模型成活率无统计学差异。在死亡的15只wistar大鼠中,结扎过紧6只,其中Ⅱ组2只,Ⅲ组4只;输尿管损伤2只全部为Ⅱ组;感染4只,Ⅱ组3只,Ⅲ组1只;切口裂开2只,Ⅱ组、Ⅲ组各1只;麻醉过深1只为sham组(图1)。
2.2 模型制作手术时间
耻骨后膀胱颈部分结扎组、会阴途径球部尿道部分结扎组和假手术组的模型制作手术时间分别为(9.75±2.29),(17.33±3.54)和(10.77±2.44)min,单因素方差分析检验发现Ⅰ组和Ⅲ组实验动物模型制作的手术时间显著低于Ⅱ组(P<0.05)。
2.3 尿动力学结果
各组DLPP结果见表1,II组与III组的2周组比较差异有统计学意义(P<0.05),I组的4周组显著低于II组和III组的4周组(P<0.01),II组和III组的2周组和4周组比较差异均有统计学意义(P<0.01)。II组的2周组DLPP比I组稍高,4周组显著高于I组,说明梗阻4周后膀胱重构明显。III组的2周组DLPP较I组轻度下降,原因是在膀胱测压过程中,部分尿液返流入精囊腺,压力经其分流,出现膀胱压力轻度下降。梗阻4周后膀胱重构进展,DLPP增加,但低于耻骨后途径4周组,这也与压力返流有关(图2)。

表1 各组在不同时间点DLPP测定结果(mmHg,n=65)Tab.1 Measrements of detrusor leak point pressure in the 2-week and 4-week subgroups(mmHg,n=65)
2.4 膀胱湿重
各组膀胱湿重结果见表2,Ⅰ组和Ⅱ组在2周时间点上的膀胱湿重有统计学差异(P<0.05),Ⅰ组和Ⅱ组、Ⅲ组在4周时间点上的膀胱湿重差异有统计学意义(P<0.05),II组和Ⅲ组分别在2周和4周不同时间点上的膀胱湿重有统计学显著性差异(P<0.05)。
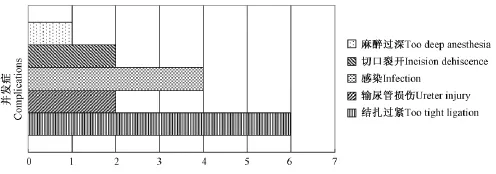
图1 手术并发症死亡大鼠Fig.1 Summary of operative complications and death in the rats
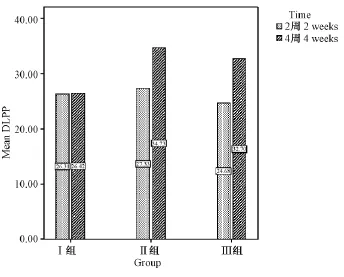
图2 各组不同时间点DLPP柱状图Fig.2 Histogram of detrusor leak point pressure in the 2-week and 4-week subgroups

表2 各组在不同时间点的膀胱湿重(g,n=65)Tab.2 Bladder wet weights in the 2-week and 4-week subroups(g,n=65)
2.5 组织学检查
梗阻2周后膀胱组织结构尚未发生明显变化,4周后逼尿肌细胞增生、肥大,逼尿肌层变厚,平滑肌细胞之间及肌束之间胶原纤维增生(图3)。精囊腺HE染色可见耻骨后途径无明显扩张,而会阴途径腺腔明显扩张(图4)(图3,4见彩插5,6)。
3 讨论
pBOO模型目前主要的建模方法是通过手术结扎的方法人为的造成动物膀胱流出道部分梗阻,尽管文献报道雄性和雌性均可制作模型,但以雌性大鼠制作pBOO模型较多。雌性大鼠模型存在致命性的弊端,因性别差异体内激素的不同,男女患者的病因、发病机制、治疗也不尽相同,临床上pBOO/LUTS的患者大部分为男性,并有文献指出膀胱逼尿肌(detrusor)是激素敏感性组织[4],因此采用雌性大鼠pBOO动物模型研究pBOO后膀胱重构的机制不甚合理。雄性大鼠尿道中部阴茎悬韧带将尿道固定在腹壁上,阴茎由此向后弯曲成锐角,解剖结构的特殊性导致其行导尿时导尿管不能通过折角处,反而极易损伤尿道[5]。另一个原因是雄性大鼠存在精囊腺,在充盈性膀胱测压过程中因腺体压力返流而导致压力不稳定,以上两方面的原因限制了雄性大鼠制作pBOO动物模型的应用。有文献报道雄性大鼠采用耻骨后途径膀胱颈部分结扎法能成功制作pBOO动物模型[6,7],但样本量少。本实验采用耻骨后途径膀胱颈和会阴途径球部尿道部分结扎法制作模型,并对所建模型进行鉴定和比较,为pBOO后膀胱重构(bladder reconstruction)的深入研究提供一种成活率高,复制性和稳定性较好的动物对象。
模型制作过程中普遍采用一根校准棒作为支撑,丝线结扎后去除校准棒。然而校准棒外径不一,如18gauge、20gauge的血管导管,1mm的硬膜外导管等[8-10]。但也有文献报道体重在300~350g的雄性SD大鼠利用1.7mm校准棒作为支撑成功建立膀胱出口梗阻动物模型[11-12]。校准棒有内塞和外压两种方法,文献多以内塞为主,本课题组采用1mm硬膜外导管外压造成梗阻,这样既避免了尿道损伤,又保证了大鼠排尿时膀胱颈受到限制,而且操作相对简单。结扎的松紧度是建立梗阻模型和模型成活率的关键因素,结扎过松不能形成有效梗阻,过紧成活率太低。本实验中80只雄性Wistar大鼠,死亡15只:其中6只因严重尿潴留死亡,分析原因系结扎过紧,解剖后发现膀胱破裂,腹腔大量腹水或膀胱极度充盈,内含透明清亮尿液或膀胱呈紫葡萄外观,切开后溢出血性脓液。本课题组的心得是暴露膀胱颈或者球部尿道后,放置1mm硬膜外导管作为支撑结扎,结扎程度尽可能松,线圈轻轻靠近即可,拔出硬膜外导管时结扎周围组织不被牵动为准。2只因损伤输尿管死亡,术后解剖发现被损伤输尿管近端扩张积水,积水稍浑浊,肾周可见积脓。分析原因系出血致解剖层次不清,未分离出输尿管,盲目结扎。4只因切口、尿道口感染死亡,2只因切口裂开,大鼠咀咬死亡,这归因于缝合技术原因,进针点距切缘近,加上切口周围皮肤和皮下水肿疏松,当膀胱充盈过大时,将缝合切口撑开。1只因麻醉过深死亡。
耻骨后途径膀胱颈部分结扎组需切开下腹部,分离尿道,于膀胱颈处部分结扎尿道,此法操作繁琐,易损伤输尿管及膀胱周围血管丛。耻骨后途径切口约为1.5~2cm,比会阴途径切口大,易引起感染[13]。本实验也证实了这种观点,感染死亡的大鼠总共4只,其中耻骨后途径3只。会阴途径仅需会阴一大小约1cm的垂直切口即可,手术创伤小,涉及的解剖结构少,操作简单,手术时间短。两组的成活率相比,虽无统计学意义,但会阴途径手术并发症少,成活率高于耻骨后途径。通过两种方法手术时间、成活率的比较和手术并发症的统计,会阴途径比耻骨后途径具有明显优势。
行充盈行膀胱测压时,目前主要有两种方法:一种是经原切口切开皮肤,松解尿道结扎线,经尿道口置入膀胱测压管进行测压[14]。该法理论上可行,但实际操作中难以完成,主要原因是长时间梗阻后结扎处已形成瘢痕狭窄,即使去除结扎线,导管也难以通过狭窄处。另一种方法是通过耻骨上膀胱造瘘进行膀胱测压。部分研究者的做法是暴露膀胱后,用头皮针穿刺膀胱,直接做膀胱测压。本研究发现随着膀胱压增加,头皮针极易脱出膀胱而使测压失败。也有部分研究者在膀胱顶部采用荷包缝合,将测压管固定,这种方法最主要的问题是缝扎的膀胱组织较多,膀胱有效容量相对减少,加大实验误差[15]。文献报道测压时尿动力仪与微量灌注泵是通过一个三通管相连,进入膀胱的灌注管和测压管是一根单腔导管,影响测压的真实数据[16]。本课题组在测压时进行改良:暴露膀胱后,用眼科剪在膀胱顶部剪一小口,将备好的两根硬膜外导管插入,丝线结扎,使导管固定于膀胱,结扎时被结扎膀胱组织尽可能少。这样做既保证导管固定牢靠,又避免了单根单腔导管对测压结果的影响。充盈性膀胱测压结果显示:耻骨后途径2周组DLPP比假手术组稍高,4周组DLPP显著高于假手术组,说明梗阻2周后膀胱组织结构尚未发生明显改变,4周后膀胱组织结构发生变化,逼尿肌平滑肌细胞增生、肥大,逼尿肌层变厚,平滑肌细胞之间及肌束之间胶原纤维增生。会阴途径2周组DLPP较假手术组轻度下降,原因是在膀胱测压过程中,发生逼尿肌收缩排尿时,部分尿液返流入精囊腺,压力经其分流,出现膀胱压力轻度下降[17]。梗阻4周后膀胱重构[18]进展,DLPP增加,但低于耻骨后途径4周组,这也与精囊腺体压力返流有关。
基础研究开展的前提是动物模型的建立,目前pBOO动物模型存在的主要问题是尽管选择了一个校准棒作为结扎松紧的标准,直径多浮动在1mm的范围内,但文献中大鼠的体重不一致,较难形成较一致的梗阻表现。因此还需要进一步标化模型,建立一个成活率更高,复制性和稳定性更好,操作更简单的雄性大鼠pBOO动物模型。
[1]Seaman EK,Jacobs BZ,Blaivas JG,et al.Persistence or
recurrence of symptoms after transurethral resection of theprostate:a urodynamic assessment[J].J Urol,1994,152(3):935-937.
[2]Melman A,Tar,M Boczko J,et al.Evaluation of two techniques of partial urethral obstruction in the male rat model of bladder outlet obstruction[J].Urology,2005,66:1127-1133.
[3]廖利民.尿动力学[M].北京:人民军区出版社,2012:217-236.
[4]Austin JC,Chacko SK,Disanto M,et al.A male murine model of partial bladder outlet obstruction reveals changes in detrusor morphology,contractility and myosin isoform expression[J].J Urol,2004,172:1524-1528.
[5]王增涛.Wistar大鼠解剖图谱[M].济南:山东科学技术出版社,125-143.
[6]Yazaki J,Aikawa K,Shishido K,et al.Alpha 1-adrenoceptor antagonists improve bladder storage function through reduction of afferent activity in rats with bladder outlet obstruction[J].Neurourol Urodyn,2011,30(3):461-467.
[7]Zhang X,Seftel A,Disanto ME,et al.Blebbistatin,a myosin II inhibitor,as a novel strategy to regulate detrusor contractility in a rat model of partial bladder outlet obstruction[J].Plos One,2011,6(10):e25958
[8]De Almeida Prado PS,SoaresMF,Lima FO,etal.Amitriptyline aggravates the fibrosis process in a rat model of infravesical obstruction[J].Int J Exp Pathol,2012,93(3):218-224.
[9]Liu F,Yao L,Yuan J,et al.Protective effects of inosine on urinary bladder function in rats with partial bladder outlet obstruction[J].Urology,2009,73(6):1417-1422.
[10]Xu A,Frederiksen H,Kanje M,et al.Partial urethral obstruction:ATF3 and p-c-Jun are involved in the growth of the detrusor muscle and its motor innervation[J].Scand J Urol Nephrol,2011,45(1):30-38.
[11]Burns JA,Kreder KJ,Lubaroff DM,et al.Alteration in constituent urinary proteins in response to bladderoutlet obstruction in rats[J].J Urol,1998,159(5):1747-1751.
[12]Song YS,Lee HJ,Doo SH,et al.Mesenchymal stem cells overexpressing hepatocyte growth factor(HGF)inhibitor collagen deposit and improve bladder function in rat model of bladder outlet obstruction[J].Cell Transplant,2012,21(8):1641-1650.
[13]Malmgron A,Sjogren C,Uvelius B,et al.Cystometrical evaluation of bladder instability in rats with infra-vesical outflow obstruction[J].J Urol,1987,137(6):1291-1294.
[14]卢根生,宋波,金锡御.大鼠不稳定膀胱超微结构改变的实验研究[J].重庆医学,2002,31(9):812-814.
[15]牛志尚,孙宁,谢向辉,等.膀胱出口部分梗阻对逼尿肌生物力学特性的影响[J].中华泌尿外科杂志2008,29卷增刊:70-73.
[16]廖利民,尿动力学[M].北京:人民军医出版社,2012:117-120.
[17]Oconnor LT Jr,Vaughan ED Jr,Felsen D.In vivo cystometric evaluation of progressive bladder outlt obstruction in rats[J].J Urol,1997,158(2):631-635.
[18]高宏飞,王东文.2型糖尿病膀胱重构的受体机制研究[J].中西医结合心脑血管病杂志,2013,11(6):716-718.
Comparison of two methods to establish male rat model of partial bladder outlet obstruction
JIN Qiang1,WANG Dong-Wen2,GAO Hong-Fei2,LIU Chong1,SHI Xiao1
(1.Shanxi Medical University,Taiyuan 030001,China;2.Department of Urology,the First Hospital Affiliated to Shanxi Medical University,Taiyuan 030001)
ObjectivesTo compare the retropubic and perineal approaches in establishing partial bladder outlet obstruction in male rats,and provide an effective and reliable method to prepare the rat model to serve researches on mechanism of bladder reconstruction.MethodsEighty healthy male Wistar rats were used in this study,and randomly divided into three groups.Group I:Twenty rats were used for sham operation with a perineal incision.Group II:Thirty rats were chosen for midprostatic obstruction using a retropubic approach.Group III:Thirty rats were used for bulbous urethral obstruction through a perineal incision.The groups II and III were further randomly divided into 2-week and 4-week subgroups.After 2 and 4 weeks,respectively,all experimental rats were anesthetized and underwent cystometricevaluation.Then the rats were sacrificed,and the organs including bladder and seminal vesicle were removed.The bladder body was weighted and recorded,and then a portion of the bladder body and the seminal vesicle were fixed in 4%paraformaldehyde solution.Remaining bladder tissue was saved in the liquid nitrogen.ResultsThe survival rate of group II and III was 73.3%and 80.0%,respectively(P>0.05).The operation time in the three groups was(9.75±2.29),(17.33±3.54)and(10.77±2.44)min,respectively.The operation times of groups I andⅢ were significantly shorter than that of the group II(P>0.05).DLPP of the group 1-and 2-week and 4-week subgroups of Groups II and III were(26.31±2.32),(27.34±3.93),(24.68±2.39)mmHg and(26.42±2.41),(34.23±3.01),(32.63±3.20) mmHg,respectively,showing a significant difference between the group I and the 4-week sbugroups of Group II and III,and between the 2-week and 4-week subgroups of groups II and III(P<0.05).ConclusionsBoth the retropubic and perineal approaches can be used to successfully establish a partial bladder outlet obstruction in male rats.Compared with the retropubic approach,the perineal approach has advantages such as shorter operation time,a higher survival rate,better reproducibility and stability of the animal models,and that this rat model better resembles the progress of human male partial bladder outlet obstruction.
Partial bladder outlet obstruction;Retropubic approach;Perineal approach;Animal mode;Rat
R33
A
1671-7856(2014)02-0052-05
10.3969.j.issn.1671.7856.2014.002.004
山西省回国留学人员科研资助项目(No.2007-47);山西省青年科技研究基金租住项目(No.2012021034-1)。
荆强(1986-),男,研究方向:尿动力基础与临床。E-mail:jq0310urology@126.com。
王东文(1964-),男,博士生导师,研究方向:尿动力基础与临床,泌尿系肿瘤和微创泌尿外科学。E-mail:urology2007@126.com。
2013-12-31

