Cry1Ab/Ac抗虫基因克隆与原核表达
陈 锐,朱 珠,兰青阔,陈 佳,王 永
(1. 天津市农业质量标准与检测技术研究所,天津 300381;2. 天津科技大学食品工程与生物技术学院,天津 300457;3. 天津大学化工学院,天津 300072)
转基因技术在提高农作物产量、改善农产品品质、减少农药使用等方面正深刻地改变着现代农业格局.据统计[1],2012年转基因作物种植面积已达1.7×106平方千米,超过全球耕地面积的10%.转基因试纸条检测法是以抗原与抗体互相作用的免疫学理论为基础的一种针对蛋白的检测方法.该方法样品前处理简单、操作快捷,不需要特殊仪器设备,对操作人员也无过高技术要求,十分适用于田间快速检测和产品成分筛查,在转基因检测市场具有广阔的应用前景.
Bt基因是目前抗虫转基因植物中使用最广泛的外源基因,其来源于苏云金芽胞杆菌(Bacillus thuringiensis),表达产物对多种农业害虫具有特异性毒杀作用[2].在转基因植物中,Bt蛋白表达占总可溶性蛋白的比例较高[3],十分适用于试纸条方法检测.
本研究以转基因水稻 TT51-1中的外源 Bt基因为研究对象,通过基因克隆、载体构建、原核表达与纯化等步骤,开展转基因检测用 Bt蛋白富集制备工作,为进一步研发试纸条检测产品提供物质基础与技术支持.
1 材料与方法
1.1 实验材料
转基因水稻TT51-1由秦皇岛出入境检验检疫局提供.
1.2 主要试剂
高保真 DNA聚合酶、琼脂糖切胶回收试剂盒、HindⅢ与 BamHⅠ内切酶,宝生物工程(大连)有限公司;pGEM-T easy载体、T4,DNA 连接酶,Promega公司;质粒提取试剂盒、JM109感受态细胞,北京博迈德生物技术有限公司;pET-28a质粒与大肠杆菌(E.coli)BL21菌株由天津大学黄金海教授馈赠.
1.3 基因组DNA提取
DNA提取参照农业部1485号公告–4–2010《转基因植物及其产品成分检测DNA提取和纯化》[4]进行;使用1%琼脂糖凝胶电泳与Nanodrop ND1000核酸蛋白测定仪评估质量并定量.
1.4 引物设计
依据 GenBank EU880444.1序列信息,在 Bt基因两端设计引物并在上下游引物的 5’端分别加入BamHⅠ和 HindⅢ酶切位点与保护碱基.表达载体构建验证引物分别设计在 BamHⅠ与 HindⅢ酶切位点两侧.全部引物由上海生工生物工程技术服务有限公司合成,序列详见表1.
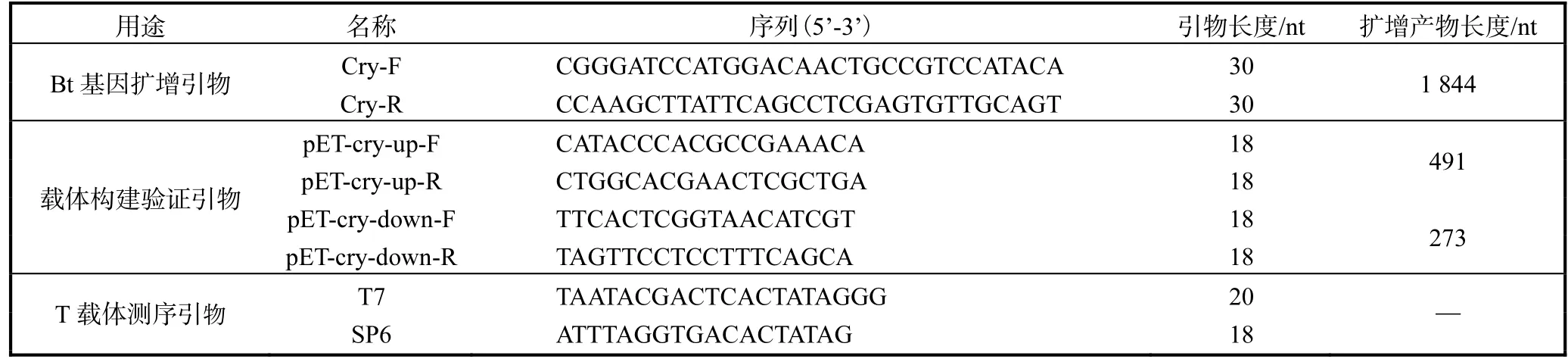
表1 本研究使用引物Tab.1 Primers used in this study
1.5 Bt基因克隆
PCR 反应体系(50,µL)为:100,ng/µL 模板 DNA 1,µL,10×PCR Buffer 5,µL,10,mmol/L dNTPs 1,µL,10,mmol/L 上下游引物各 1,µL,5,U/µL Taq 酶 1,µL,灭菌去离子水 40,µL.扩增程序为:95,℃预变性5,min;95,℃变性 45,s,56,℃退火 45,s,72,℃延伸2,min,共计 35个循环;72,℃延伸 10,min.PCR产物经1%琼脂糖凝胶电泳分离,切胶回收1.8,kbp目的条带,连接pGEM-T载体后转化JM109,挑取白色菌落摇菌培养并提取质粒,PCR验证的阳性克隆(T-cry)培养物送至金维智生物科技(苏州)有限公司完成测序.
1.6 原核表达载体构建
使用限制性内切酶 HindⅢ与 BamHⅠ分别对 T-cry与pET-28a质粒进行双酶切,产物经1%琼脂糖凝胶电泳后切胶回收,连接载体与目的片段后热激转化JM109,筛选 Kan+抗性重组转化体进行 PCR及双酶切鉴定.
1.7 重组蛋白诱导表达及纯化
将构建的重组表达质粒pET-28a-cry转化E. coli BL21(DE3),挑取Kan+抗性菌落摇菌活化,取培养物按 1∶100加入 Kan+抗性 2×YT液体培养基,加入终浓度0.1,mmol/L的IPTG,25,℃、120,r/min诱导培养 6,h,诱导菌液经超声裂解提取蛋白,12% SDSPAGE检验表达情况.取阳性菌株 37,℃条件下进行大量培养,超声波破菌后离心收集包涵体,TritoxX-100洗涤,8,mol/L尿素溶解.蛋白纯化使用 SDSPAGE切胶分离与透析袋水平电泳法回收纯化目的蛋白[5].紫外分光光度法测定蛋白的 A260、A280,按照经验公式(1)计算蛋白质质量浓度(mg/mL).
蛋白质质量浓度=1.45×A280–0.74×A260(1)
2 结果与分析
2.1 Bt基因克隆
转基因水稻 TT51-1基因组 DNA提取后 1%琼脂糖凝胶电泳检测结果显示,DNA条带清晰、质量完好、无降解弥散与RNA污染(图1a).Bt基因扩增得到片段大小约为 1.8,kbp,与预期产物长度相符(图1b).TA 克隆转化 JM109后,Amp+平板挑取白斑摇菌活化,质粒 PCR检测结果显示,多数转化子携带1.8,kbp目的条带(图1c).测序验证Bt基因序列及两端酶切位点,选取序列完全正确的克隆用于后续实验(图 1d).
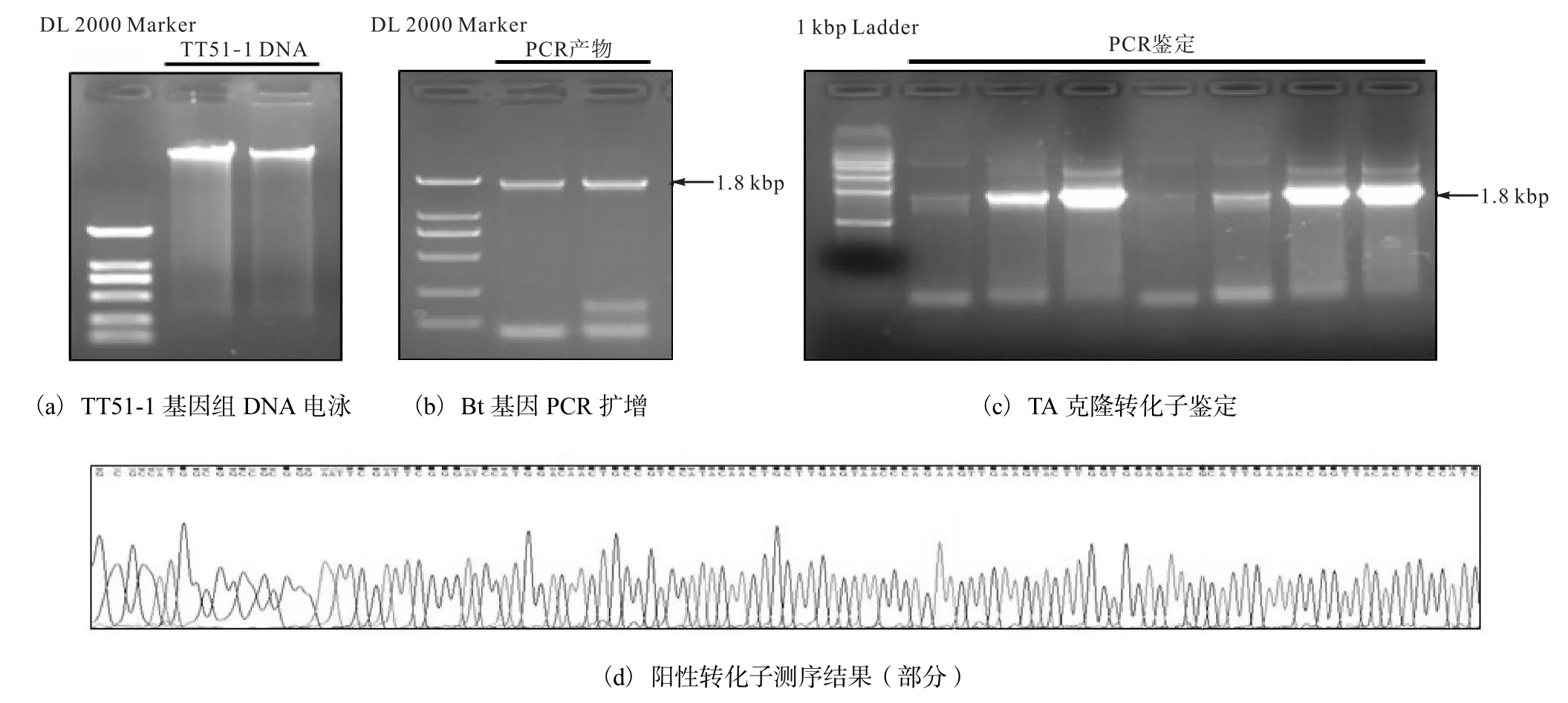
图1 Bt基因克隆结果Fig.1 Results of Bt gene cloning
2.2 原核表达载体构建及鉴定
T-cry质粒经 HindⅢ与 BamHⅠ内切酶消化后,产生 1.8,kbp目的条带与 3,kbp载体线性化条带(图2a).pET-28a质粒经HindⅢ与BamHⅠ内切酶消化,产生 5.3,kbp载体线性化条带(图 2b).切胶回收1.8,kbp目的条带与线性化pET-28a,连接转化JM109后,Kan+平板挑取克隆摇菌活化并提取质粒.载体构建验证引物分别位于上下游连接位点两侧,PCR鉴定分别获得预期 491,bp与 273,bp大小条带(图2c).进一步Hind/ⅢBamHⅠ双酶切检测结果证明,成功构建原核表达载体 pET-28a-cry,Bt基因插入位置与方向正确无误(图2d).

图2 ,pET-28a-cry原核表达载体构建Fig.2 Construction of prokaryotic expression vector pET-28a-cry
2.3 目的基因原核表达与纯化
将pET-28a-cry转化BL21(DE3),Kan+平板挑取克隆摇菌活化,0.1,mmol/L IPTG 诱导表达后 SDSPAGE检测结果显示,成功表达预期蛋白,条带大小与理论值相符,表达产物主要以包涵体形式存在(图3a).重组蛋白包括组氨酸标签在内共编码 643个氨基酸,相对分子质量约为 7.1×104,电泳条带偏低可能是由于电泳液 pH影响蛋白 SDS载量,从而影响其电泳迁移率.利用透析袋水平电泳法纯化的目的蛋白经 SDS-PAGE检测结果显示,回收蛋白条带单一、无杂带,纯化效果良好(图3b).
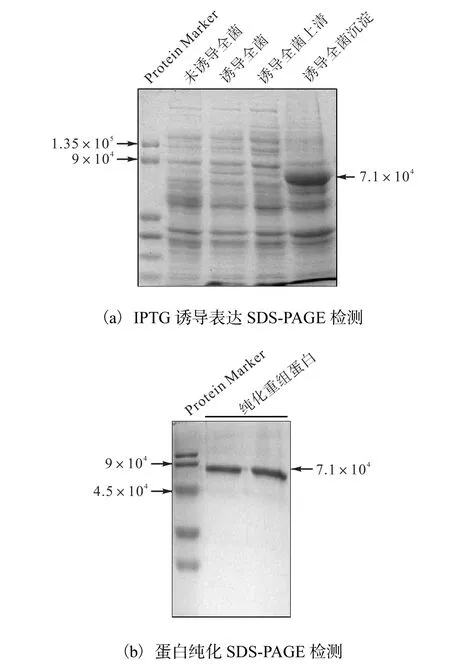
图3 CRY1Ab/Ac蛋白原核表达与纯化Fig.3 Prokaryotic expression and purification of recombined CRY1Ab/Ac protein
3 讨 论
Bt基因是目前转基因农作物中应用极为广泛的一大类抗虫基因,本研究从转基因水稻TT51-1入手,针对其抗虫Bt基因进行全长克隆,利用pET/DE3表达系统成功富集检测标示物,为今后转基因检测产品的研发提供必要前提.
本研究目的蛋白以包涵体形式存在,虽然包涵体易于分离,但其通常需要条件剧烈的变性剂才能溶解,如高浓度的尿素或盐酸胍,这使得目的蛋白在变性、复性过程中容易形成沉淀.因此,从包涵体中回收具备活性的目的蛋白非常困难,对后续的免疫及抗体制备研究存在一定影响.
当前,国内外转基因水稻研究领域已取得长足进展[6],我国科研工作者历经多年努力也培育出多个转基因水稻品种[7–10];但由于转基因食用安全问题的争论以及公众的高度关注,使我国转基因水稻尚未实现大面积推广种植.此外,不同国家和地区的转基因标识制度(CAC/GL 44—2003、CAC/GL 45—2003 和CAC/GL 46—2003)也直接关联农产品进出口检验与国际贸易争端.例如,欧盟 2006年 9月起多次声称中国进口大米检出未经批准的转基因成分,并对中国出口米制品采取了拒绝入境或撤架、召回等措施,严重影响了我国农产品出口.由此可见,转基因检测需求市场巨大.开发快速、准确的转基因检测技术与方法,不仅可以满足我国转基因生物监管需求,而且对完善转基因标识管理制度与保护国家农产品进出口利益等方面均具有重要意义.
[1] James C. 2012年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2013,33(2):1-8.
[2] 林良斌,官春云. Bt 毒蛋白基因与植物抗虫基因工程[J]. 生物工程进展,1997,17(2):51-55.
[3] Koziel M G,Beland G L,Bowman C,et al. Field performance of elite transgenic maize plants expressing an insecticidal protein derived from Bacillus thuringiensis[J]. Nature Biotechnology,1993,11(2):194-200.
[4] 中华人民共和国农业部. 农业部 1485号公告-4-2010转基因植物及其产品成分检测 DNA提取和纯化[S].北京:中国标准出版社,2010.
[5] 镕刘 ,钟沁萍,蒋明森,等. 一种获得高纯度包涵体蛋白的简便方法[J]. 中国寄生虫学与寄生虫病杂志,2011,29(5):399-401.
[6] Qiu C,Sangha J S,Song F,et al. Production of markerfree transgenic rice expressing tissue-specific Bt gene[J].Plant Cell Reports,2010,29(10):1097-1107.
[7] Tu Junmin,Zhang Guoan,Datta K ,et al. Field performance of transgenic elite commercial hybrid rice expressing Bacillus thuringiensis δ-endotoxin[J]. Nature Biotechnology,2000,18(10):1101-1104.
[8] 冯道荣,许新萍,邱国华,等. 多个抗病抗虫基因在水稻中的遗传和表达[J]. 科学通报,2000,45(15):1593-1599.
[9] 张启军,尹福强,王世全,等. 根癌农杆菌介导 gna基因对水稻的转化[J]. 中国农学通报,2006,22(6):40-44.
[10] 卫剑文,许新萍,陈金婷,等. 应用 Bt和 SBTi基因提高水稻抗虫性的研究[J]. 生物工程学报,2000,16(5):603-608.

