荧光定量PCR检测HBV-DNA、HCV-RNA室内质控物的制备及评估
葛咏梅,冯晓朦,周劲松,高 申*
荧光定量PCR检测HBV-DNA、HCV-RNA室内质控物的制备及评估
葛咏梅1,冯晓朦2,周劲松2,高 申2*
(1.吉林省人民医院,吉林长春130021;2.吉林大学中日联谊医院)
荧光定量PCR法检测人血浆中乙肝HBVDNA、HCV-RNA具有较高的灵敏度和较强的特异性[1],但是检测的结果易受很多因素影响,因此严格的室内质量控制才能预防和控制检验误差,保证结果的准确性。目前,PCR检测试剂盒并未提供定值的室内质控品,且商用质控品的价格昂贵、不易获得,给常规PCR检测过程中室内质量控制带来不便。根据卫生部临检中心对质控品的相关规定,结合近年来临床PCR工作的基础,我们应用混合血清自制单一模式的混合血清实验室室内质控品,并根据《体外诊断试剂注册管理办法》(试行)等相关文件要求对其准确性、稳定性进行了初步评价,报告如下。
1 材料与方法
1.1标本采集
2012年6月—11月在我院住院和门诊患者血清中,分别选取60例HBsAg、HBeAg、抗HBc阳性、60例Hcv-Ab阳性的患者标本,选取200例乙肝、丙肝标志物均阴性的患者标本,所选取的标本均无黄疸、溶血、脂血、高IgG。
收集的阳性标本于56℃水浴箱中30min灭活,离心后收集上层血清,0.5ml/支分装,于-70℃冰箱中保存待测,避免反复冻融。
1.2主要仪器与试剂
LightCycler480荧光PCR基因扩增检测仪,深圳匹基生物工程有限公司的HBV-DNA、HCVRNA荧光定量PCR试剂盒。
1.3单一模式混合血清的制备
200例乙肝标志物均阴性标本的混合血清,作为基质血清;60例HBsAg、HBeAg、抗HBc均阳性标本的混合血清,记做模式①,60例Hcv-Ab阳性标本的混合血清,记做模式②。将模式①,模式②的病毒浓度测定3-4次,取其平均值。用基质血清通过1∶10、1∶100、1∶1000稀释后,检测3-4次,平均值及预期靶值。0.5ml/支分装,于-70℃冰箱中保存备用。
1.4确定靶值绘制质控图
使用相同的仪器及同一品牌的试剂盒在同一反应条件下进行检测,每次平行测定3个反应,连续检测20日,确定其靶值,计算x—、s、CV,并绘制质控图。
1.5均一性实验
任意抽取样本各30支,进行编号。从每支样本中取200μl,共6ml充分混匀,用于批内不精密度的检测,共检测30次。1-30号样本分别进行检测,每份样本检测1次,计算测定(总)不精密度。该检测为同一人操作,同一条件下,1次上机完成[2]。
1.6稳定性实验
1.6.1 分别取样本各20支共40支,分为4组,每组10支包括5支HBV-DNA、5支HCV-RNA,分别按照以下放置样本条件放置。放置条件:①室温(20-25℃),相对湿度20%-50%,3d;②冰箱冷藏(2-8℃),5d;③-20℃14d;④-70℃(不同条件下稳定性对照组)。
1.6.2 随机抽取20支样本-20℃冻存,12个月内不定期检测,每次抽取2支,复融,室温放置15 min,漩涡振荡混匀。每份样本从核酸提取开始平行做2份。以-70℃冻存的样本作为长期保存稳定性对照组,与-20℃保存时的检测值作比较,监测制备物长期保存时HBV DNA的含量变化。
1.7质控品的评估
1.7.1 生物安全性 在本实验制备前,将所用血清均按照常规方法进行56℃30min灭活备用,保证质控血清无已知的生物传染性。
1.7.2 质控品的准确性 本实验室为国家标准实验室,在常规工作条件下,由熟练的技术人员对自制的质控血清进行检测,经卫生部临检中心颁布的国家标准品溯源定值,结果一致。
1.8统计分析
按文献[3]方法计算x—、s、CV值。均一性实验检测采用方差齐性检验,稳定性试验检测采用t检验。
2 结果
2.1质控品的预期靶值
使用基质血清稀释的室内质控物的预期靶值见表1。

表1 最佳稀释倍数下所测得的HBV-DNA、HCV-RNA拷贝数
2.2质控品定值
在常规条件下,由熟练的技术人员对自制的质控血清进行检测20次,计算x—、s、CV值,确定质控品的预期靶值,详见表2。
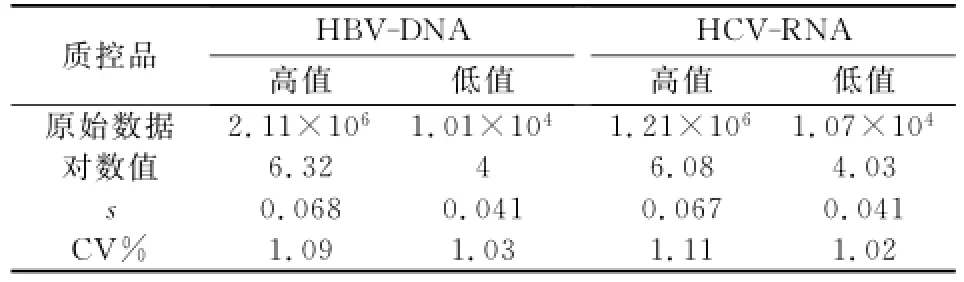
表2 自制质控品参数
2.3均一性实验检测
对混合样本检测30次的数据和30份样本的检测数据进行统计,将两组数据作方差齐性检验,批内精密度和总精密度差异无统计学意义(F(HBV)=1.0250、F(HCV)=1.0240,P值均>0.05),符合均匀性要求(表3)。
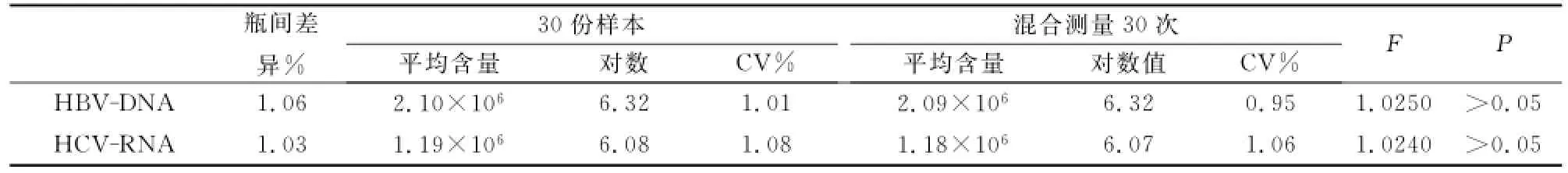
表3 均一性实验结果
2.4稳定性实验结果
不同条件下放置质控物结果P值均>0.05,差异无统计学意义(表4)。对质控物的稳定性进行长期监测,12个月不定期分别对制备物HBV-DNA、 HCV-RNA监测12次,各组间t(HBV-DNA)=0.949,t(HCV-RNA)=0.926,P均>0.05,无统计学差异,表明该定值制备物长期保存含量无明显变化。具有很好的稳定性和长期保存性(表5)。

表4 不同条件下放置质控物结果
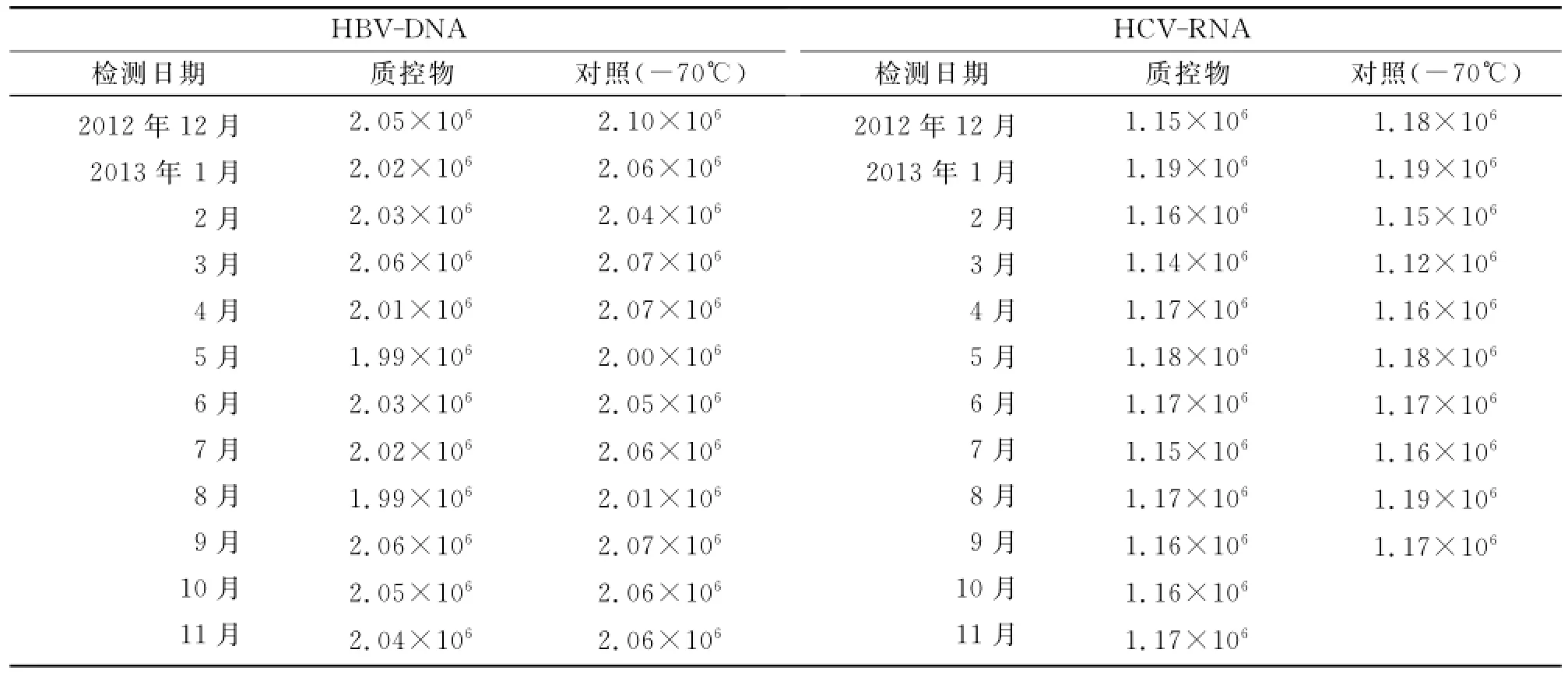
表5 不定期检测HBV-DNA、HCV-RNA拷贝数
3 讨论
病毒性肝炎严重威胁人类健康,尤其是乙型肝炎在我国流行广泛,因此肝炎的诊断和治疗显得格外重要。目前临床实验室多采用荧光定量PCR方法检测,提高HBV-DNA、HCV-RNA荧光定量PCR检测的灵敏度与精确度,对临床乙型肝炎的诊断及预后有极其重要的用。
为了保证荧光定量PCR法进行病毒DNA定量检测的准确性,应严格按照实验室标准操作程序(SOP),建立和完善室内质控物,提高常规工作的批内、批间标本的一致性。
理想的室内质控样本的条件为:基质与待测标本一致,所含待测物浓度应接近试验的决定水平,有很好的稳定性,靶值或预期结果已定,无已知的生物传染危险性,单批可大量获得[4]。
本研究自制的质控品为单一模式的混合血清,且在实验前经过常规灭活,达到无生物传染性,并在通过国家标准的实验室条件下,由熟练的技术员进行荧光定量PCR检测,该定值质控品的测量准确度不低于国家标准、行业标准的规定,具有可信度。均一性实验结果显示,批内精密度和总精密度差异无统计学意义;稳定性实验结果表明,自制血清稳定,且长期保存含量无明显变化,达到国家对质控品制备要求的相关规定。且根据《分子诊断项目分析性能标准》自建检测系统不精密度要求:以能力验证/室间质评评价界限(靶值±0.4对数值)作为允许总误差(TEa),重复性精密度<3/5TEa;中间精密度<4/5TEa。按照项目稳定性要求选取最长期限样品,5个样品,覆盖测量区间,至少4个样品测量结果偏倚<±7.5%,本质控品均达到要求。
因此通过本实验方法自制荧光定量PCR检测HBV-DNA、HCV-RNA的室内质控物,实验室的质量控制提供了基本的保障,也节约了实验室的成本。应用于临床乙型、丙型肝炎的检测的室内质控,为临床出具更多及时、准确的检验报告,具有很大的意义。
[1]H o SK,Yam WC,Leung EK,et al.Raped quantification of hepatitisB virus DNA by real-time PCR using fluorescent hybrid ization probes[J].J Med Microbiol,2003,52:397.
[2]王露楠,邓 巍,申子瑜,等.乙型肝炎病毒DNA标准物质的研究[J].中华肝脏病杂志,2007,15(2):107.
[3]CNAS-GL26:2008.中国合格评定国家认可委员会.医学实验室质量和能力认可准则在基因扩增检验领域的指南[S].
[4]李金明.实时荧光PCR技术[M].北京:人民军医出版社,2007:190.
2014-01-17)
1007-4287(2014)12-2024-03
*通讯作者

