肺炎克雷伯菌介导致碳青霉烯类耐药的基因检测研究
于亲德,徐平,于勇文,王曙光,冯桂梅
(1.长沙市航天医院药剂科,湖南 长沙 410205;2.中南大学湘雅医院(附一医院)药剂科,湖南 长沙 410008)
肺炎克雷伯菌介导致碳青霉烯类耐药的基因检测研究
于亲德1,徐平2,于勇文1,王曙光1,冯桂梅1
(1.长沙市航天医院药剂科,湖南 长沙 410205;2.中南大学湘雅医院(附一医院)药剂科,湖南 长沙 410008)
目的分析碳青霉烯类耐药型肺炎克雷伯菌的耐药性及耐药基因型。方法分离碳青霉烯类耐药型肺炎克雷伯菌14株,分别采用E-test实验、改良的Hodge试验、脉冲场琼脂糖凝胶电泳分型及多位点序列分型测定其耐药性、耐药基因型及主要流行序列型。结果14株碳青霉烯类耐药型肺炎克雷伯菌对常用碳青霉烯类抗生素亚胺培南和美罗培南呈中高度耐药,最低抑菌浓度(MIC)分别为8~64 mg/L、16~128 mg/L;对常见头孢类抗生素头孢哌酮、头孢西丁、头孢他啶和头孢吡肟均呈高度耐药,MIC 32~256 mg/L;对喹诺酮类药物环丙沙星呈中度耐药,MIC 3~32 mg/L;对氨基糖苷类抗生素阿米卡星不稳定,MIC<0.12~256 mg/L。本组碳青霉烯类耐药型肺炎克雷伯菌碳青霉烯酶表型检测均为阳性,基因型属KPC-2;脉冲电泳分型显示A克隆2株、B克隆9株、C克隆3株,多位点序列分型显示ST11 9株、ST15 4株、ST439 1株,分型结果基本一致。结论碳青霉烯类耐药型肺炎克雷伯菌对部分其他种类的抗生素亦有较强耐药性,KPC-2型碳青霉烯酶是本院肺炎克雷伯菌产生青霉烯类耐药性的主要原因,主要流行克隆型和序列型分别为B型、ST11型。
肺炎克雷伯菌;碳青霉烯酶;抗生素;耐药;基因检测
肺炎克雷伯菌(Klebsiella pneumoniae,KNP)与大肠埃希菌、阴沟肠杆菌并称为临床三大肠杆菌。事实上,除消化系统和呼吸系统外,KNP在泌尿系统及血液系统疾病中亦有较高的感染率,已成为临床分离及医院感染的重要致病菌之一[1]。碳青霉烯类抗生素是临床治疗肠杆菌科细菌重症感染的首选药物,籍其抗菌谱广、抗菌活性强、耐受β-内酰胺酶水解及低毒等优势得以迅速普及和应用。然而近年报道显示,随着其临床使用频率的增加,碳青霉烯类抗生素的耐药性日渐凸显,成为制约其临床疗效的重要原因之一,以KNP最为突出。研究表明[2-3],KNP产生碳青霉烯耐受的机制主要是产生碳青霉烯酶(Klebsiella pneumoniae carbapenemases,KPC)。国外研究对该酶进行了DNA条带图谱和基因序列分型,对其分型的掌握有助于明确其流行病学特征和耐药机制。本研究对院内重症监护病房分离的14株碳青霉烯类抗生素耐受型KNP做了耐药性和基因型检测,现报道如下:
1 材料与方法
1.1 主要材料
1.1.1 主要菌株本院重症监护病房2012年9月至2013年9月分离的14株KNP。分离来源:痰液3株,脓性分泌物7株,腹水2株,血液2株。入选标准:所有细菌采用细菌全自动鉴定仪鉴定为肺炎克雷伯菌,并对亚胺培南和亚胺培南耐药。
1.1.2 主要仪器细菌全自动鉴定仪(Vitek 2,BioMerieux);脉冲场凝胶电泳仪(CHEF Mapper XA System,Bio-Rad);电热恒温培养箱(DNP-9162,上海精宏实验设备有限公司);核酸电泳仪(QSEP100,BiOptic Inc);紫外线凝胶成像仪(FR-980,上海复日);PCR扩增仪(5334,Eppendorf);激光扫描仪(TYPOON9200,Pharmacia Biotech);紫外交联仪(DTK3-DTY-2010,北京中西远大生物技术有限公司)等。
1.1.3 主要试剂大肠埃希菌(ATCC25922,南京便诊生物科技有限公司);蛋白酶K(71049-3,EMD Millipore);核酸内切酶(XbaⅠ,TaKaRa);脉冲场凝胶电泳λ Ladder DNA Marker购自Bio-Rad;限制性内切酶等常规PCR试剂购自TaKaRa公司;LB肉汤、Mueller-Hinton培养基及8种抗生素的E-test条均购自BioMerieux公司;其他常规试剂均为国产分析纯,购自上海生工生物工程有限公司。
1.2 主要方法
1.2.1 E-test实验以E-test法测定8种抗生素的最低抑菌浓度(Minimal inhibitory concentration,MIC),包括亚胺培南(Imipenem,IMI)、美罗培南(Meropenem,MEM)、头孢哌酮(Cefoperazone,CFZ)、头孢西丁(Cefoxitin,CFX)、头孢他啶(Ceftazidime,CAZ)、头孢吡肟(Cefepime,CFM)、环丙沙星(Ciprofloxacin,CPFX)和阿米卡星(Amikacin,AMK)。选取待测菌纯菌落,制备成0.5麦氏单位的菌悬液,以无菌棉签均匀的涂抹于MH培养皿,放置20 min,挥干水分,以E-test药敏试纸条进行检测。以大肠埃希菌ATCC25922作为质控菌株,以CLSI 2011标准为评定标准。
1.2.2 改良的Hodge试验主要用于测定碳青霉烯酶表型,选取大肠埃希菌ATCC25922纯菌落,制备成0.5麦氏单位的菌悬液,稀释10倍,涂于MH培养皿,进行美洛培南药敏纸片测定。以美洛培南药敏纸片边缘为起点,沿离心方向划一直线,35°C培养过夜,抑菌圈内出现矢状者为阳性。
1.2.3 脉冲场凝胶电泳(PFGE)实验常规细菌接种、包埋,调整浊度为2~2.5 MacFarrand;并取300 μl菌液制备2%低熔点胶块。蛋白酶K消化,50℃24 h,消化浓度0.8 mg/L。内切酶消化,体系:10×XbaⅠ内切酶缓冲液+BSA+10×XbaⅠ内切酶+超纯水=12 μl+ 12 μl+4 μl+102 μl;37℃24 h。消化后以脉冲场凝胶电泳装置电泳,紫外线凝胶成像仪拍照,分析条带。
1.2.4 脉冲场凝胶电泳(PFGE)实验多序列位点分型(MLST)实验采用煮沸法提取细菌DNA模板,参照MLST专业网站设计管家基因引物(表1)。PCR体系:按照Taq酶说明书配比,含10×buffer、3.5 mmol Mg2+、2 mmol/L dNTPs、500 μmol/L引物、0.25 U Taq、10 ng模板,共计50 μl反应体系。PCR条件:94°C 5 min,94°C 50 s,50°C 30 s,72°C 50 s,30个循环;72°C 10 min。产物送至上海生工进行双向测序,比对MLST序列型,并分析与PFGE分型的相似度。

表1 MLST 7对管家基因的引物序列
2 结果
2.1 各菌株的MIC检测结果14株碳青霉烯类耐药型肺炎克雷伯菌对常用碳青霉烯类抗生素IMI和MEM呈中高度耐药,MIC分别为8~64 mg/L、16~128 mg/L;对常见头孢类抗生素CFZ、CFX、CAZ和CFM均呈高度耐药,MIC 32~256 mg/L;对喹诺酮类药物CPFX呈中度耐药,MIC 2~32 mg/L;对氨基糖苷类抗生素AMK不稳定,MIC<0.12~256 mg/L,见表2。

表2 14株碳青霉烯类耐药型肺炎克雷伯菌对临床8种常用抗生素的MIC(mg/L)
2.2 各菌株的耐药基因型检测结果本组碳青霉烯类耐药型KPC表型检测均为阳性,均可扩增出KPC条带,基因测序属KPC-2型;此外,尚有13株扩增出SHV带,7株TEM条带及3株CTX带。
2.3 各菌株的耐药克隆型和序列型检测结果PFGE分型显示A克隆2株(14.3%)、B克隆9株 (64.3%)、C克隆3株(21.4%),MLST分型显示ST11 9株(64.3%)、ST15 4株(28.6%)、ST439 1株(7.14%),分型结果基本一致;见图1、图2。
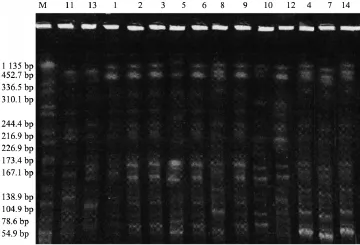
图1 各株菌株的PFGE电泳图谱

图2 PFGE克隆型与MLST序列型的同源性分析图
3 讨论
KNP属革兰氏阴性杆菌,常见于呼吸道和肠道,近年其碳青霉烯类耐药菌株有增多趋势。据报道,产生KPC酶是KNP抵抗碳青霉烯类抗生素的主要原因之一[5],其中,西欧国家的产酶率为10%~40%[6],我国稍高,为20%~50%[7]。KPC酶系能够水解亚胺培南或美罗培南的一类β-内酰胺酶,对几乎所有β-内酰胺类抗生素如青霉素、头孢菌素及碳青霉烯类等均有较高水解活性。且产KPC酶型菌株往往携带多种其他耐药基因,可导致多种抗生素交叉耐药现象,是限制临床抗感染治疗疗效的重要因素之一[8]。目前,国外对于产生KPC酶KNP的基因学研究已较为深入;然而国内相对局限,个别产KPC酶菌株的报道多,基因型与同源性研究偏少。本研究自重症监护病房分离产KPC酶KNP菌株14例,利用E-test法测定8种常见抗生素的MIC,以期为指导临床合理用药提供依据;同时,对该14种菌株的基因型、流行克隆型以及序列型也做初步探讨,以期为其耐药机制的深入研究提供依据。
流行病学调查结果显示[9],国内产KPC酶KNP以KPC-2基因型为主,本院自重症监护病房分离碳青霉烯类耐受性KNP菌株14株,经鉴定均为KPC-2型,与以往多数报道相符。KPC-2酶最早报道于2002,与KPC-1酶有一个氨基酸的改变,分别属于Ambler与Bush分类的A、2f组,其耐药性不依赖于膜孔蛋白的丢失。研究表明[10],KPC-2酶位于结合质粒的转座子上,不仅可进行垂直传播,尚有水平传播给其他细菌的活性。本研究的药敏性试验结果显示,KPC-2酶对除碳青霉烯类以外的其他常用抗生素亦有显著耐药性,且对头孢类抗生素的耐药性尤其偏高,本组四种头孢抗生素中,MIC最低限为32 mg/L,部分菌株可达256 mg/L。此外,对喹诺酮类药物CPFX呈中度耐药,对氨基糖苷类抗生素AMK亦有一定的耐受作用。鉴于以上抗生素临床应用的广泛性和高密度性,克服以KPC-2基因型为主的KNP耐药性已成为我国感染性疾病研究领域亟待解决的重要课题之一。
PFGE是目前国际上公认的病原菌同源性分析的“金标准”,建立在细菌染色体DNA的酶切片段长度多态性的基础上,即通过DNA条带图谱对细菌进行克隆分型。MLST则是一直基于核酸序列的细菌分型方法,属于分子水平流行病学监测研究的一种。PFGE和MLST的交叉研究利于从分子水平细化和明确其耐药机制和流行病学指征。本研究结果显示,本院KPC-2基因型KNP的主要流行克隆型为B型(9/14,64.3%),主要流行序列型为ST11(9/14,64.3%)。与国外流行情况有些许出入,提示KPC-2基因型KNP的耐药基因可能存在地域差异,应以地区为单位,开展更为全面的研究。
综上所述,碳青霉烯类耐药型肺炎克雷伯菌对部分其他种类的抗生素亦有较强耐药性,KPC-2型碳青霉烯酶是本院肺炎克雷伯菌产生青霉烯类耐药性的主要原因,主要流行克隆型为B型,主要流行序列型为ST11,应做重点研究。
[1]Orsi G,Bencardino A,Venditti M,et al.Patient risk factors for outer membrane permeability and KPC-producing carbapenem-resistant Klebsiella pneumoniae isolation:results of a double case-control study[J].Infection,2013,41(1):61-67.
[2]Correa L,Martino M,Marra A,et al.A hospital-based matched case-control study to identify clinical outcome and risk factors associated with carbapenem-resistant Klebsiella pneumoniae infection [J].BMC Infectious Diseases,2013,13(1):80.
[3]Zulfiqar S,Shakoori A.Molecular characterization,metal uptake and copper induced transcriptional activation of efflux determinants in copper resistant isolates of Klebsiella pneumoniae[J].Gene,2012, 510(1):32-38.
[4]Hussein K,Raz-Pasteur A,Kassis I,et al.Impact of carbapenem resistance on the outcome of patients'hospital-acquired bacteraemia caused by Klebsiella pneumoniae[J].The Journal of Hospital Infection,2013,83(4):307-313.
[5]汤瑾,李卿,蒋燕群.对肺炎克雷伯菌碳青霉烯酶的研究进展[J].检验医学,2010,25(01):63-66.
[6]Fu Y,Zhang F,Liu S,et al.Differential expression of bla(SHV)related to susceptibility to ampicillin in Klebsiella pneumoniae[J].International Journal ofAntimicrobialAgents,2007,29(3):344-347.
[7]关红,曹霞,陈蕊,等.对碳青霉烯类抗生素敏感性降低的肺炎克雷伯菌耐药机理探讨[J].四川大学学报(医学版),2013,44 (02):242-245,250.
[8]蒯守刚,邵海枫,王卫萍,等.肺炎克雷伯菌介导碳青霉烯类耐药的基因型检测[J].临床检验杂志,2008,26(05):358-361.
[9]吴丹丹,蔡加昌,刘进.耐碳青霉烯肺炎克雷伯菌的感染现状[J].中国抗生素杂志,2011,36(01):1-6.
[10]周蓉,朱卫民.肺炎克雷伯菌分子流行病学及耐药机制研究进展[J].国外医药(抗生素分册),2012,33(01):1-5,42.
Genetic testing of carbapenems-resistant Klebsiella pneumoniae.
YU Qin-de1,XU Ping2,YU Yong-wen1,WANG
Shu-guang1,FENG Gui-mei1.
1.Department of Pharmacy,the Aerospace Hospital of Changsha,Changsha 410205, Hunan,CHINA;2.Department of Pharmacy,Xiangya Hospital of Central South University,Changsha 410205,Hunan, CHINA
ObjectiveTo analyze the antibiotic resistance and genotype of Klebsiella pneumoniae(KNP)resistant to carbapenems.Methods14 strains of Klebsiella pneumonia resistant to carbapenems were separated.The antibiotic resistance capacity,drug-resistant phenotype and genic sequence type were detected with E-test,reformative Hodge-test, pulsed-field gel electrophoresis(PFGE)and multilocus sequence typing(MLST).ResultsThe MICs of KNP to imipenem and meropenem were 8~64 mg/L and 16~128 mg/L respectively,with moderate to high antibiotic resistance capacity to carbapenems.The antibiotic resistance capacities to cefoperazone,cefoxitin,ceftazidime and cefepime were all high with MIC of 32~256 mg/L,and to ciprofloxacin it showed a moderate antibiotic resistance capacity with MIC of 3~32 mg/L,while to amikacin,it is unstable with MIC of 0.38~256 mg/L.All 14 stains of KNP could produce Klebsiella pneumoniae carbapenemase 2(KPC-2).PFGE results showed cloning types of A(n=2),B(n=9)and C(n=3).Meanwhile,MLST results showed ST types of ST11(n=9),ST15(n=4)and ST439(n=1).ConclusionCarbapenems-resistant KNP also resists to some other kinds of antibiotics,and KPC-2 is the primary cause of that resistance in our hospital,where the major epidemic cloning and sequence types are type B and type ST11 respectively
Klebsiella pneumoniae;Carbapenemases;Antibiotic;Drug resistance;Genetic testing
R378.99+6
A
1003—6350(2014)17—2499—04
10.3969/j.issn.1003-6350.2014.17.0980
2014-02-25)
于亲德。E-mail:wuzhichuang1971@163.com