大鼠脊髓损伤后P物质与神经源性肠道功能障碍的关系
龙志华,高飞,张锋良,岳军忠,王磊,王烨,刘文国,徐青
大鼠脊髓损伤后P物质与神经源性肠道功能障碍的关系
龙志华,高飞,张锋良,岳军忠,王磊,王烨,刘文国,徐青
目的探讨脊髓损伤后结肠中P物质与神经源性肠道功能障碍的关系。方法60只体质量(220±40)g的雄性Sprague-Dawley大鼠随机分为假手术组(n=20)、正常对照组(n=20)和模型组(n=20)。氯胺酮60 mg/kg腹腔注射麻醉大鼠,利用NYU脊髓打击器,以75 g⋅cm致伤力制作T10脊髓损伤模型,分别于造模后24 h、1周、3周和5周时切除大鼠结肠组织制作标本,检测肠道传输功能,采用ELISA方法测定血清中和组织中的P物质含量,实时荧光定量PCR和Western blotting法检测P物质mRNA和蛋白表达。结果模型组大鼠脊髓损伤后出现肠道传输功能下降,且于造模后3周时肠道传输达到最低值;造模后3周时模型组血清和组织中P物质含量与假手术组相比均降低,结肠组织中P物质的mRNA及蛋白表达水平也下调,与假手术组、正常对照组相比具有显著性差异,假手术组P物质的表达是模型组的(3.12±0.51)倍(P<0.05)。结论大鼠脊髓损伤后神经源性肠道功能障碍与结肠中P物质的表达降低有关。
脊髓损伤;P物质;神经源性肠道功能障碍;大鼠
[本文著录格式]龙志华,高飞,张锋良,等.大鼠脊髓损伤后P物质与神经源性肠道功能障碍的关系[J].中国康复理论与实践,2014,20(8):718-722.
脊髓损伤(spinal cord injury,SCI)不仅严重地损害患者的躯体感觉和运动功能,且对胃肠神经系统造成影响使得胃肠运动、肛门括约肌功能及肛门反射、排便协调性等发生改变,导致患者发生神经源性肠道功能障碍(neurogenic bowel dysfunction,NBD)[1]。调查发现,41%的脊髓损伤患者认为NBD严重影响生活质量。在脊髓损伤患者中高达1/3出现NBD,主要表现为便秘、腹胀以及大便失禁等[2-4]。
随着对肠神经系统研究的深入,对慢性传输型便秘发病机理有了进一步认识。但脊髓损伤后肠神经系统和胃肠激素的作用机理及改变的相关研究严重滞后。本文拟对大鼠脊髓损伤后出现的NBD与胃肠激素中P物质之间的关系进行研究。
1 材料与方法
1.1 实验材料
1.1.1 动物与分组60只健康雄性Sprague-Dawley大鼠(编号:RD008),体质量(220±40)g,SPF级,购于军事医学科学院实验动物中心,合格证编号:SCK-(军)2009-005。
饲养条件:室温16~25℃,相对湿度50%~70%,分笼饲养,饲以普通饲料,环境清洁安静。
采用抽签法随机分为假手术组(n=20)、正常对照组(n=20)和模型组(n=20),每组又分为造模后24 h、1周、3周和5周共4个时间点,每个时间点5只大鼠。各组间大鼠体质量差异无统计学意义(P>0.05)。饲养1周后开始建立脊髓损伤模型。
1.1.2 主要试剂粉末活性炭(分析纯)(台山市联兴化工有限公司);BCA Protein Assay Kit(PIERCE公司,美国);SYBR Green PCR Master Mix(ABI公司,美国);大鼠P物质酶联免疫吸附测定试剂盒(武汉伊艾博科技有限公司);抗P物质抗体、辣根过氧化物酶标记山羊抗兔IgG、化学发光试剂盒(SANTA CRUZ公司,美国);辣根过氧化物酶标记的抗GAPDH抗体(中国康成公司);M-MLV逆转录试剂盒(INVITROGEN公司,美国);RNeasy Mini Kit(QIAGEN公司,德国)。
1.1.3 动物模型制备氯胺酮60 mg/kg腹腔注射麻醉大鼠,利用NYU脊髓打击器(美国,纽约大学)以75 g⋅cm致伤力制作T10脊髓损伤模型[5]。
脊髓损伤模型成功的标志为,在打击器撞击脊髓的瞬间,动物身体抖动,双下肢迅速回缩并出现弹动动作,尾巴翘起并迅速倒下,打击局部脊髓表面迅速呈瘀紫色,术后双下肢出现完全瘫痪。
取每个试件中通过位移传感器测量的工字钢竖向相对位移的平均值为横坐标,取加载试验机的荷载值为纵坐标.试验以单调静力加载方式对试件进行加载,以200 kN为单位进行测量读数,读取试件的竖向位移.最后得到试件的荷载位移曲线.
假手术组大鼠同法暴露T10段脊髓,但不造成脊髓打击伤。
正常对照组大鼠不做任何处理。
1.1.4 取材手术后大鼠用普通饲料饲养,各时间点大鼠禁食24 h后,暴露腹腔,下腔静脉采血置于含抑肽酶40µl的清洁试管中,室温下血液自然凝固2 h,1000 g离心20min,取上清置于-80℃冰箱保存待测。
经口灌入活性炭悬液10 ml/kg(悬液浓度100 g/ L),30min后氯胺酮60 mg/kg腹腔注射麻醉,立即剖腹取出幽门至直肠末端的全部肠管并测量。迅速切取结肠中段肠管,用生理盐水冲去肠内容物以及黏膜表面粘附的粪便、分泌物和血液后,将结肠壁组织切成1.5×1.5×1.5 mm的小块迅速置于-80℃冰箱内保存,用于提取结肠组织总RNA和总蛋白。
1.2 测定方法
1.2.1 肠道传输功能测定采用活性炭悬液推进法,在无张力状况下用直尺测量肠道全长及活性炭混悬液在肠道内推进长度,并计算活性炭悬液推进长度占肠道全长的百分比(黑染肠管长度/肠道总长度×100%),最后计算每组的平均值[6-7]。
1.2.2 P物质测定结肠组织用预冷生理盐水洗去血液,滤纸吸干,按1∶9(结肠组织∶生理盐水)加入生理盐水制备组织匀浆,1000 g离心20min,取上清待测。
将制备好的血清样品和组织上清应用大鼠P物质酶联免疫吸附测定试剂盒,按说明书测定血清中及组织上清中P物质含量。利用全自动酶标仪,在450nm处测定各孔的平均光密度值(mean density,MD),采用Curve2Expert 113进行标准曲线的绘制,并计算出对应的浓度值。
1.2.3 实时荧光定量聚合酶链反应(real-time PCR)①组织总RNA的提取:按照QIAGEN®RNeasy Mini Kit说明书的操作方法提取结肠组织总RNA,并用紫外分光光度计检测RNA的浓度及纯度。
②反转录方法制备cDNA:将稀释后的总RNA 2 μg、Oligo(dT)15 0.5 μl、10 mmol/L dNTP 1 μl、超纯水6.5 μl,依次加入PCR反应管中,65℃反应5min,立即转入冰浴中,短暂离心后,加入5×第一链缓冲液4 μl,0.l mmol/L二硫苏糖醇2 μl、M-MLV 200 U(1 μl)、超纯水1 μl,轻轻混匀,短暂离心,37℃,50min;70℃,l5min终止反应,冰浴冷却,并以不加逆转录酶的反应体系作为阴性对照。
③绘制引物标准曲线:根据P物质的cDNA序列,通过Primer Express 3.0软件设计引物。以某一个样本的4个不同量的cDNA为模板(100 ng、50 ng、25 ng、10 ng)做实时荧光定量聚合酶链反应(ABI 7300),反应条件:95℃,10min;95℃,15 s;60℃,1min,共50个循环。将所获得的PCR产物进行熔解曲线分析。将每个反应的Ct值与其cDNA加入量(ng)的lg值进行线性相关分析,计算其斜率。当斜率在-3.6~-3.0范围内时,认为该反应的Ct值与相对应的模板量呈对应关系。故选取斜率位于-3.6~-3.0的引物序列待用。
④样本测定:使用选定的引物对样本进行PCR反应,将检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,熔解曲线分析采用默认条件。结果用18S RNA进行校正。用ΔCt法计算相对基因表达,确定P物质mRNA的相对浓度。在实时定量分析中所得的荧光值可以反映目的产物的含量,各组所测得P物质的Ct值与18S RNA的Ct值的差值为ΔCt。各实验组的ΔCt与正常对照组ΔCt值的差值为ΔΔCt。
1.2.4 Western blotting检测在4℃条件下,加入裂解液提取结肠组织中的蛋白,用BCA Protein Assay Kit测定样品蛋白含量。每个样本取蛋白50 μg进行SDS聚丙烯酰胺凝胶电泳并转至PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭4 h,加入1∶500 P物质兔多克隆抗体于4℃孵育过夜,TBST漂洗2次,每次5min,加入1∶10000辣根过氧化物酶标记的山羊抗兔IgG,室温孵育1 h,TBST漂洗6次,每次5min,将膜用化学发光试剂孵育1min,于X线片上曝光,常规显影、定影。洗膜后孵育GAPDH单克隆抗体作为内参,将结果用Genetools软件(PerklmElmer)进行密度分析。
1.3 统计学分析
采用SPSS 11.5统计软件进行统计分析,计量资料用(±s)表示,两组间比较采用t检验。显著性水平α=0.05。
2 结果
2.1 肠道传输功能测定
造模后1周,模型组有1只因术后感染死亡,其余4只动物与假手术组结肠长度无显著性差异(P>0.05),正常对照组与假手术组结肠长度也无显著性差异(P>0.05);造模后24 h、3周和5周,模型组与假手术组结肠长度均无显著性差异,正常对照组与假手术组结肠长度也均无显著性差异(P>0.05)。
肠道传输功能测定发现,模型组造模后3周肠道传输功能达到最低值,造模后5周肠道传输功能开始升高,且造模后3周和5周模型组与假手术组相比降低(P<0.05),正常对照组与假手术组相比均无显著性差异(P>0.05)。见表1。因此,造模后3周出现NBD的脊髓损伤动物模型造成结肠肠道传输功能减慢。

表1 结肠传输功能比较
2.2 血清和结肠组织中P物质变化
模型组大鼠脊髓损伤后24 h和1周,血清中P物质含量降低,伤后3周达最低值,伤后5周上升。见图1。伤后3周,模型组血清中P物质含量与假手术组和正常对照组比较均有显著性差异(P<0.05)。见图2。伤后5周,模型组血清中P物质含量与假手术组和正常对照组比较无显著性差异(P>0.05)。伤后3周,模型组结肠组织中P物质含量与假手术组比较降低(P<0.05),正常对照组与假手术组比较无显著性差异(P>0.05)。见图3。

图1 不同时间点血清中P物质含量变化

图2 伤后3周血清中P物质的含量

图3 伤后3周结肠组织中P物质的含量
2.3 结肠组织中P物质mRNA表达水平变化
选用表2所示的P物质引物序列测定大鼠结肠组织中P物质在mRNA水平的表达情况。取大鼠脊髓损伤造模后3周的组织提取总RNA,测定mRNA表达水平,结果显示,大鼠在脊髓损伤造模后3周,假手术组P物质的表达是模型组的(4.52±0.35)倍(P<0.05),而假手术组与正常对照组相比无显著性差异(P>0.05))。见图4。

表2 P物质引物序列
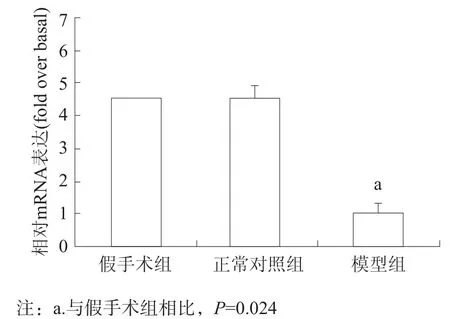
图4 P物质基因mRNA在各组结肠组织中的表达
2.4 结肠组织中P物质蛋白表达水平变化
取大鼠脊髓损伤造模后3周的组织提取总蛋白进行Western blotting测定。结果显示,大鼠在脊髓损伤造模后3周,假手术组P物质的表达是模型组的(3.12± 0.51)倍(P<0.05),而假手术组与正常对照组相比无显著性差异(P>0.05)。见图5。

图5 P物质蛋白在各组大鼠结肠中的表达
3 讨论
结肠运动受神经和胃肠激素的支配与调节。胃肠肽类激素是由胃肠道管壁上散在的内分泌细胞和胰腺的胰岛分泌的高效能生物活性物质,它们与神经系统一起,调节消化器官的运动、分泌和吸收等功能[8]。这些胃肠激素通过旁分泌、自分泌、神经分泌等方式,介导细胞间信息传递,使其产生兴奋和/或抑制作用。兴奋性胃肠肽激素包括胃动素、胃泌素、内皮素、P物质等,抑制性胃肠肽激素包括血管活性肽、胆囊收缩素、胰泌素等。
P物质能神经元是肠道内一种重要的肽能神经元,对胃肠的运动功能起着重要的调节作用。P物质能神经元胞体存在于肠肌间神经丛内,发出的纤维分布至肠壁各层,是促进胃肠运动的神经递质,对消化道平滑肌有强烈刺激作用,直接作用于全结肠肠壁肌,同时激活结肠中远端胆碱能兴奋通路和结肠近端非胆碱能兴奋通路,并激活NO依赖的抑制性神经通路,从而增加胃肠蠕动[9-12]。
肠道问题是脊髓损伤患者主要的生理和心理问题,肠道问题给患者带来的痛苦并不亚于失去运动能力的痛苦[13]。由于脊髓损伤后肠道的运动能力、括约肌的控制能力等问题使得脊髓损伤患者生活能力出现较大的障碍,这对患者的生活质量也产生巨大影响。目前有关脊髓损伤后结肠P物质能神经元及P物质含量的相关研究鲜见报道。本研究旨在探讨是否脊髓损伤大鼠出现NBD与结肠中P物质含量的改变有关,为今后研究和治疗脊髓损伤患者NBD提供可靠的理论依据。
成功建立大鼠脊髓损伤模型后,大鼠出现不同程度的便秘及腹胀,为实验奠定良好基础[14]。本研究发现,脊髓损伤造模后3周大鼠结肠传输功能减慢达到最低值,在造模后5周时发现结肠传输略有增加,在造模后3周和5周时模型组与假手术组比较结肠传输功能均降低(P<0.05),提示大鼠结肠在造模后3周开始出现结肠运动功能障碍。因此在后续的实验中我们选择脊髓损伤后3周的大鼠进行实验。
研究还发现,脊髓损伤后导致NBD大鼠的血清和结肠组织中P物质与假手术组比较,表达降低(P<0.05)。之后通过PCR和Western blotting方法检测脊髓损伤后大鼠结肠组织中P物质的表达情况。结果发现,结肠组织中P物质的mRNA和蛋白表达与假手术组相比均下调(P<0.05)。
由此可见,脊髓损伤后大鼠出现结肠功能障碍可能与大鼠结肠中P物质的减少和P物质能神经元病变有关。
[1]徐青,高飞,王磊,等.脊髓损伤后肠道功能障碍:美国临床实践指南解读[J].中国康复理论与实践,2010,16(1):83-86.
[2]Liu CW,Huang CC,Chen CH,et al.Prediction of severe neurogenic bowel dysfunction in persons with spinal cord injury[J]. Spinal Cord,2010,48(7):554-559.
[3]Faaborg PM,Finnerup NB,Christensen P,et al.Abdominal pain:a comparison between neurogenic bowel dysfunction and chronic idiopathic constipation[J].Gastroenterol Res Pract, 2013,(2013):1-7.
[4]Emmanuel A.Review of the efficacy and safety of transanal irrigation for neurogenic bowel dysfunction[J].Spinal Cord, 2010,48(9):664-673.
[5]张新,李建军,霍小林,等.重复经颅磁刺激对脊髓运动功能恢复的影响及其机制的实验研究[J].中国康复理论与实践, 2008,14(3):228-230.
[6]张燕,李红岩,郭伶俐,等.大黄对大鼠结肠动力的影响[J].北京中医药大学学报,2010,33(3):187-190.
[7]李爱萍,于洪波,戴林,等.芍药甘草汤对慢传输型便秘大鼠肠道运动及血浆胃肠激素的实验研究[J].临床军医杂志,2013, 41(10):993-995.
[8]Stiens SA,Bergman SB,Goetz LL.Neurogenic bowel dysfunction after spinal cord injury:clinical evaluation and rehabilitative management[J].Arch Phys Med Rehabil,1997,78(3 Suppl):S86-S102.
[9]Knowles CH,Veress B,Kapur RP,et al.Quantitation of cellular components of the enteric nervous system in the normal human gastrointestinal tract—report on behalf of the Gastro 2009 International Working Group[J].Neurogastroenterol Motil, 2011,23(2):115-124.
[10]谢启文.神经肽[M].上海:复旦大学出版社,2004:350.
[11]Lynch AC,Anthony A,Dobbs BR,et al.Colonic neurotransmitters following spinal cord injury[J].Tech Coloproctol, 2000,4:93-97.
[12]岳军忠,徐青.脊髓损伤后结肠运动与胃动素、P物质、血管活性肠肽[J].中国康复理论与实践,2010,16(8):755-757.
[13]Lynch AC,Antony A,Dobbs BR,et al.Bowel dysfunction following spinal cord injury[J].Spinal Cord,2001,39(4):193-203.
[14]龙志华,徐青,王磊,等.脊髓损伤后大鼠结肠血管活性肠肽能神经元表达的变化[J].中国康复医学杂志,2012,27(2):103-106,119.
Substance P in Neurogenic Bowel Dysfunction after Spinal Cord Injury in Rats
LONG Zhi-hua,GAO Fei,ZHANG Feng-liang,YUE Jun-zhong,WANG Lei,WANG Ye,LIU Wen-guo,XU Qing.Capital Medical University School of Rehabilitation Medicine,Department of General Surgery,Beijing Bo'ai Hospital,China Rehabilitation Reserch Center,Beijing 100068,China
ObjectiveTo investigate the relationship between neurogenic bowel dysfunction(NBD)and substance P in rats suffering from spinal cord injury(SCI).Methods60 male Sprague-Dawley rats,weighted(220±40)g,were randomly divided into three groups:sham group(n=20),normal group(n=20)and model group(n=20)and then were subdivided into subgroups of 24 h,1 week,3 weeks,and 5 weeks respectively after SCI.SCI model was established at thoracic 10 segment of rat with NYU impactor device.The colon tissue of the rats was resected and stored.Substance P in serum and tissue was measured by ELISA.The tissue was examined by real-time RT-PCR and Western blotting to analyze the expression of substance P.ResultsThe colon intestinal transmission function decreased and delineated atminimum value at 3 weeks in the model group.There was statistical significance with respect to the content of substance P in serum and tissue between the sham group and model group at 3 weeks.The expression of substance P in the sham group was(3.12±0.51)times of the model group(P<0.05).ConclusionSubstance P may take part in NBD after SCI in rats.
spinal cord injury;substance P;neurogenic bowel dysfunction;rats
10.3969/j.issn.1006-9771.2014.08.004
R651.2
A
1006-9771(2014)08-0718-05
2014-03-26
2014-04-11)
中国康复研究中心青年基金项目(No.2009-Q4)。
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院,北京市100068。作者简介:龙志华(1976-),男,汉族,湖南安仁县人,硕士研究生,主治医师,主要研究方向:胃肠外科。通讯作者:徐青,主任医师,教授,硕士生导师。E-mail:tsingcrrc@sina.cn。
时间:2014-06-30 15:57
http://www.cnki.net/kcms/detail/11.3759.R.20140808.0913.001.html

