酪氨酸酶的研究进展
王春丽,柳 伟
(1.华东理工大学 药学院,上海 200237;2.上海市新药设计重点实验室,上海 200237)
酪氨酸酶(EC 1.14.18.1,tyrosinase,TYR)又称多酚氧化酶、儿茶酚氧化酶、陈干酪酵素等,是1种结构复杂的含多亚基的含铜氧化还原酶,广泛存在于微生物、动植物和人体中[1]。酪氨酸酶具有多种生物学功能,近年来对其在医药、美容、食品和环保等领域的应用,引起了国内外的广泛关注。笔者结合近年来国内外有关酪氨酸酶的研究成果,对酪氨酸酶的作用机制、提取制备以及应用等方面进行综述,以期为有关产品的研发以及其深入应用提供参考。
1 酪氨酸酶的作用机制
酪氨酸酶活性中心呈现出双核铜中心结构(图1),由2个铜离子位点组成,与蛋白质中的组氨酸残基结合,并且由1个内源桥基将2个铜离子联系起来。当酪氨酸等物质和酶过渡络合时,主要是羟基和酶的活性中心上的原子键合发生作用[2]。在黑色素的催化反应过程中,将其分为氧化态(Eoxy)、还原态(Emet)和脱氧态(Edeoxy)3种形式[3],区别在于双核铜离子活性中心的结构不同。

图1 酪氨酸酶活性中心的双核铜中心结构Fig.1 The structure of the active center containing Cu of tyrosinase
酪氨酸酶(菌类)催化反应具有单酚酶和双酚酶活性,能催化氧化单酚和双酚成为苯醌(图2)。在单酚酶循环中,Eoxy与单酚反应生成苯醌和Edeoxy,后者与O2结合,最终又重新生成 Eoxy。在双酚酶循环中,Eoxy与双酚反应生成苯醌和Emet,后者将另一种双酚转化为苯醌,其自身转化为Edeoxy形态,双酚是Edeoxy形成的必要因素。
酪氨酸酶的单酚酶活性表现出特异的时滞,直到Eoxy提供足够的双酚。时滞长短受酶的来源、单酚酶浓度等影响,浓度增大,时滞缩短,但不可完全消除,而双酚可以完全消除时滞[4]。
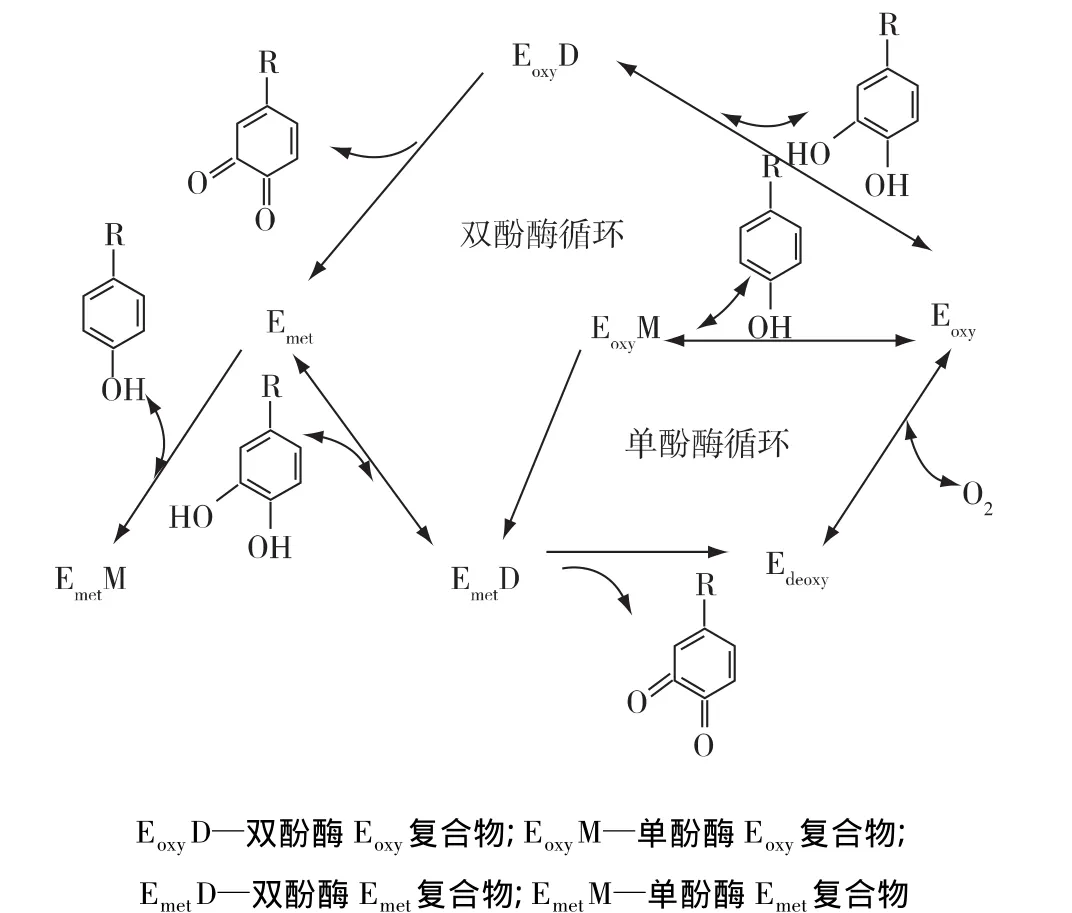
图2 酪氨酸酶的反应机制Fig.2 Reaction mechanism of tyrosinase
酪氨酸酶催化酪氨酸氧化成多巴,多巴氧化形成多巴醌反应,控制黑色素细胞的活性,是黑色素合成的关键酶(图3)。酪氨酸酶抑制剂的浓度增大,酶活力受到抑制而使得催化效率降低。根据抑制机制的不同,将酪氨酸酶抑制剂一般分为竞争型、非竞争型、反竞争型和混合型[5]。
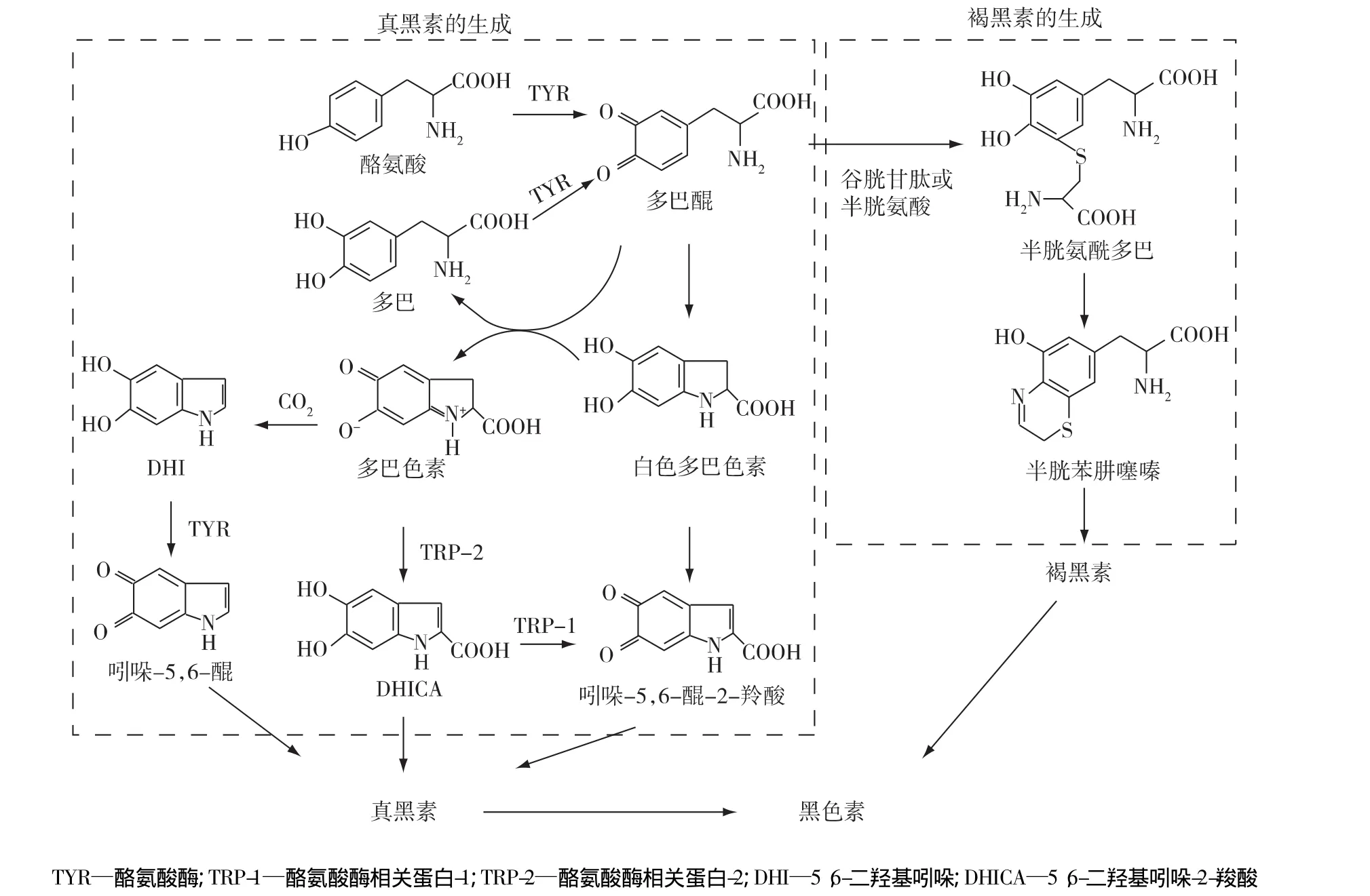
图3 酪氨酸酶催化黑色素的生物合成过程Fig.3 Process of melanin biosynthesis catalyzed by tyrosinase
2 酪氨酸酶的制备及其活性研究
迄今为止,成功分离出酪氨酸酶的生物主要有真菌(包括霉菌、食用伞菌、酵母菌等)、细菌、裸子植物、被子植物,昆虫,脊索动物类,哺乳动物(包括人)[6]。但从植物中提取制备酪氨酸酶的报道较少,实验中以食用菌与水果为主要酶源,常见原料包括蘑菇、马铃薯和苹果等。实验中所用的酪氨酸酶纯酶大多为国外进口,价格昂贵且不宜大规模应用。
研究者通常借鉴国内外常用提取酪氨酸酶的方法,选用国内低价常用原料来制备酶液。例如王宁芳[7]以 pH 为7.2的 Na2HPO4-HCl缓冲溶液为体系,通过研磨挤压、过滤、离心分离,提取马铃薯中的酪氨酸酶,用分光光度计在480 nm处测定马铃薯提取液的吸光度,以吸光度对时间的变化率为反应速率,建立多巴溶液的转换动力学曲线;发现所测数据波动小,酪氨酸酶的催化活性稳定性高,准确度高且效果好,但是多巴价格昂贵。鲁卫斌等[8]则以邻苯二酚(儿茶酚)为底物研究自制马铃薯酪氨酸酶,发现其催化产物的最大吸收波长为410 nm,最佳反应条件为 pH 6.8、30℃;并用其处理羊毛织物,发现酪氨酸残基被催化氧化为多巴醌结构,且能与含有—NH2的物质反应,为进一步研究羊毛改性奠定了基础。樊倩等[9]以新鲜马铃薯、红富士苹果、红蛇果、秀珍菇和紫茄子为研究对象,从中分别提取酪氨酸酶并测定其酶活力,发现紫茄子的酪氨酸酶活力最为理想,并选择邻苯二酚作为紫茄子酪氨酸酶底物;而后研究了有机合成、无机盐和天然提取物3大类抑制剂对酪氨酸酶的催化影响,发现有机合成化合物效果最佳。Faridi等[10]从产自伊朗北部的花生中提取酪氨酸酶。花生以液态氮为体系,随后通过(NH4)2SO4沉淀和透析。电泳显示存在2个可能的同工酶。酶活性在纯化的不同阶段中进行测定,也测量一些具有重要物理性质的酶。结果表明,花生酪氨酸酶的最佳pH为5.2、最适温度为40℃。动力学研究也确定了米氏常数 Km=257.5 mmol,最大反应速度Vmax=0.004 21 mmol/min。
目前,已从各种微生物中分离出不同特性的酪氨酸酶,但要用于商业目的,其成本高、效率低、产量少仍是棘手问题。随着生物技术的成熟发展,利用基因工程构建大量高效的酪氨酸酶工程菌已成为可能。Dolashki等[11]对土壤细菌产酪氨酸酶进行分离和鉴定。通过离心分离,而后经过(NH4)2SO4沉淀法和超滤法获得粗酶,除去褐色素(可能黑色素)后,通过体积排阻色谱进一步分离天然蛋白质混合物获得纯化酶。双酚基质L-多巴、多巴胺以及单酚基质L-酪氨酸的动力学参数已确定,即 Km为4.5、1.5 和0.055 mmol/L,纯化酶最大活性条件为pH 6.8。王戈林等[12]在微生物产黑色素的发酵条件研究中,将嗜麦芽假单胞菌的酪氨酸酶基因用重组DNA技术转入大肠杆菌HB101中,获得了酪氨酸酶基因表达较好的工程菌WY8。何伟等[13]采用比较酪氨酸酶的同源保守结构域氨基酸序列的方法设计引物,从苏云金芽孢杆菌4D11中通过PCR扩增得到了包含酪氨酸酶基因的DNA片段,并在大肠杆菌中获得了表达,验证了该基因产生的黑色素可在一定程度上保护菌体免受紫外辐射,为构建产黑色素杀虫基因工程菌提供了有益的参考。Ren等[14]基于 V.spinosum中的酪氨酸酶基因在大肠杆菌中的成功克隆,建立了1个酪氨酸酶在大肠杆菌中高效表达的有效模式,并对温度、诱导物浓度以及不同操作模式下诱导的启动时间进行了研究,经过28 h的孵化获得大约3 g/L活性的酪氨酸酶。
3 酪氨酸酶的应用研究
作为1种重要的生物资源,酪氨酸酶有着广泛的用途,在生物体内具有多种重要的生理功能,特别在皮肤美白、抗氧化作用等方面表现尤为突出。另外,结合固定化[15]、生物传感器等技术,在有机合成、环境保护、生物检测等领域,利用酪氨酸酶进行催化氧化、处理工业废水、检测化合物等方向已经逐渐成为目前国内外研究的热点。
3.1 有机合成方面
酪氨酸酶的氧化反应可广泛用于有机合成领域,可以利用其选择性羟基化、催化生成活泼中间体合成新化合物等,合成化学方法难以一步合成的化学物质或难以实现的化学反应过程。如Müller等[16]报道了在氯仿中由固定化酪氨酸酶催化苯酚串联羟基化/氧化/Diels-Alder反应生成二环[2.2.2]辛烯二酮的一系列合成;徐迪等[17]发现用固定化酪氨酸酶催化4-取代烷基或烷氧基单酚类化合物的氧化反应可得到相应的4-取代邻苯醌,这类邻苯醌能和芳香胺发生迈克尔加成反应,烷基或烷氧基从醌环4位上脱落,继而得到三取代胺的化合物。将抗炎药布洛芬引入到单酚的苯环4位上,在酪氨酸酶和芳香胺同时存在的条件下,也得到脱布洛芬的加成取代产物,显示4-羟基布洛芬苯酚酯可作为布洛芬药物载体;另外,以对苄氧基苯酚、对苄基苯酚和对苯氧基苯酚为底物,初步探讨了在无溶剂体系中酪氨酸酶催化与邻氨基苯甲醚的氧化-迈克尔加成反应,并考察了各因素对该反应速率的影响[18];Casella 等[19]研究发现,酪氨酸酶对苯硫基甲烷(茴香硫醚)具有硫化氧化作用,可以获得高对映体过剩值的(R)-亚砜。这一发现扩大了酪氨酸酶催化底物的范围,也为生物法生产高光学纯度的手性化合物开辟了一条新途径;Stratford等[20]发现4-氟邻苯二酚在水缓冲液中由酪氨酸酶催化氧化生成的4-氟-1,2-苯醌,可通过邻位亲核试剂(水或儿茶酚类)快速进行替换,并释放氟离子。4-氯及4-溴邻苯二酚也有类似反应;Brooks等[21]实现了蘑菇酪氨酸酶催化生成1个手性乙醇——1-(3,4-二羟苯基)乙醇,这是从非手性底物通过酪氨酸酶产生的第一个手性产品。
3.2 医药美容方面
3.2.1 国内研究近况
陈景华等[22]的实验结果表明,0.5 ~2 g/L 当归提取物能显著促进细胞增殖(P<0.01);0.25~2 g/L质量浓度可明显抑制黑素合成(P<0.05或P<0.01);不同浓度提取物均能显著抑制酪氨酸酶,其中1、2 g/L试验组抑制作用比熊果苷组(P<0.01)弱,0.125、0.25 和0.5 g/L 试验组和熊果苷组相当。朴香兰等[23]将连翘用乙醇回流提取,用二氯甲烷、正丁醇和水萃取其有效成分,并检测出它们均呈浓度依赖性的抑制酪氨酸酶活性。通过硅胶色谱柱法分离成分,利用质谱、核磁共振分析手段鉴定出酪氨酸酶抑制成分为白桦脂酸,为五环三萜类化合物,其 IC50值为(138.5 ± 1.6)μmol/L。唐建阳等[24]研究发现,当质量浓度达到10.5 μg/mL 时,砂仁的30%乙醇提取物(体积分数)可使单酚酶的稳定态酶活力下降40%,迟滞时间延长了3.12倍;对二酚酶活力的抑制作用也呈现浓度依赖性关系,酶活力下降60%,IC50值为64 μg/mL,作用机制为可逆混合型抑制,抑制常数K1和 K1S分别为41.85和98.51 μg/mL。穆燕等[25]研究发现,以体积分数为20%乙醇水溶液为溶剂的白附子粗提物对酪氨酸酶的抑制作用最强,抑制率可达96.35%;与酪氨酸酶抑制率可达90.7%的恒温水浴振荡提取法相比,超声波辅助提取法的抑制率达98.1%。在此提取条件下所得的白附子粗提物的 IC50值为 24.69 μg/mL。孙培冬等[26]测定出藤茶中二氢杨梅素对酪氨酸酶单酚酶的抑制率为95.87%,抑制作用表现为酶催化反应的迟滞时间延长;二氢杨梅素对二酚酶的抑制率为69.01%,抑制作用表现为可逆混合型抑制,对游离酶的抑制常数和对酶-底物络合物的抑制常数分别为150和83 μmol/L。沈晓佳等[27]研究发现,紫娟茶的3种提取物对酪氨酸酶单酚酶和二酚酶均有较好的抑制作用,尤其是含有花青素和茶多酚混合物的提取物I。严航等[28]通过添加8倍量的体积分数为70%乙醇提取2 h,以进行优化工艺,测定得出提取2次得到的薏苡仁提取物对酪氨酸酶的抑制率达 33.3%,IC50值为 1.4 mg/mL;Lineweaver-Burk双倒数作图显示,薏苡仁提取物对酪氨酸酶的抑制作用属于线性混合型抑制。李红艳等[29]的筛选结果显示,红花水提物的酪氨酸酶抑制作用较强,推测其中9种成分可能具有酪氨酸酶抑制作用,选取验证并确认了羟基红花黄色素A对酪氨酸酶的抑制作用较为明显。
3.2.2 国外研究近况
Dung等[30]评估了金银花的花、叶、枝各部分的乙醇提取物的酚类物质、抗氧化性以及酪氨酸酶的抑制活性。实验结果显示,花、叶、枝的酚类物质提取率分别为30.00、18.57 和9.12 mg/g;抑制酪氨酸酶活性的 IC50值分别为(11.16 ±2.61)、(15.81 ±3.89)和(17.18 ± 1.76)μg/mL,对照品曲酸为(3.50 ±0.94)μg/mL。Zhang 等[31]从灵芝的乙醇可溶性酸性成分(ESACs)分离出赤芝酸 F甲酯(methyl lucidenate F),以邻苯二酚为底物测定酪氨酸酶的抑制活性,结果显示为非竞争性抑制作用,Lineweaver-Burk 图中 Vmax为 0.436 7 min-1,Km为6.765 mmol/L,非竞争性抑制常数(KI)为 19.22 μmol/L,同时赤芝酸F甲酯显示出高度酪氨酸酶抑制活性,其 IC50值为 32.23 μmol/L。Kim 等[32]从黄芪中分离出毛蕊异黄酮-7-O-β-D-葡糖苷,检测出其酪氨酸酶抑制活性的IC50值为68 μmol/L,其降低Melan-A 细胞黑色素含量的 IC50值为 75.78 μmol/L。Ding等[33]对牡丹根皮提取物(Ps-1到 Ps-8)的抗氧化性能和抗黑色素生成进行评价,其中Ps-8的清除自由基能力、鏊合离子能力、还原能力以及抑制脂质过氧化反应较强,可能是因为含有丰富的黄酮类和酚类;提取物Ps-1,尤其是提取物Ps-6大大抑制了B16细胞酪氨酸酶和多巴氧化酶的活性,并且通过减少黑素皮质受体-1(MC1R)、眼球相关转录因子(MITF)、酪氨酸酶、酪氨酸酶相关蛋白-1(TRP-1)的表达来减少B16细胞中黑色素的含量。Li等[34]在银合欢中发现抗氧化剂羽扇豆醇和酪氨酸酶抑制剂脱镁叶绿酸a甲酯,二者均显示出清除DPPH·的有效活性(维生素C为对照)以及蘑菇酪氨酸酶的抑制作用(曲酸为对照)。Zheng等[35]在小叶桑的根中发现包括austraone A在内的22种新化合物,并通过质谱和核磁共振谱确定其结构,发现在酪氨酸酶活性抑制的测试中,其中氧化白藜芦醇、桑白皮素D、桑根酮T以及桑酮O的酪氨酸酶抑制作用比曲酸强。Chen等[36]的结果表明,红花黄色素以剂量依赖性方式抑制蘑菇酪氨酸酶活性,其 IC50值约为(1.01 ±0.03)mg/mL;动力学研究显示为竞争性抑制模式,KI为0.607 mg/mL;细胞活力分析表明,1.0~4.0 mg/mL的红花黄色素质量浓度对B16F10黑色素瘤细胞并无细胞毒性作用,使用4.0 mg/mL的红花黄色素可使B16F10黑色素瘤细胞的黑素产生降至(82.3±0.4)%。
3.3 环境保护方面
酪氨酸酶能够催化氧化单酚化合物,Wada等[37]研究表明,其清除水溶液中取代苯酚的速率依次为邻苯二酚、对甲苯酚、对氯苯酚、苯酚和对甲氧基苯酚。酪氨酸酶不仅能除去酚类物质,还能去除有机胺等多种有机物,最终形成沉淀而易被处理。因此,可以利用微生物中的酪氨酸酶,用于工厂、医院等环境工程领域中来以降解处理酚类及胺类废水[38]。
随着处理工艺的不断摸索,其反应条件逐渐得到优化。Ikehata等[39]观察到蘑菇酪氨酸酶去除废水中酚类化合物最大催化活性的pH为7,超过最佳活性50%的pH范围为5~8。酪氨酸酶在高温和酸性条件下不稳定,以L-酪氨酸为底物,在pH为7的条件下热钝化酪氨酸酶的活化能为1.85 kJ/mol。Yamada等[40]发现酪氨酸酶与壳聚糖组合去除人工废水中酚类化合物的效果较好。酪氨酸酶催化氧化苯酚化合物成为醌的衍生物,随后化学吸附到壳聚糖膜上。对甲基苯酚而言,决定醌吸附的最佳条件是pH为7,温度为45℃。某些烷基取代酚,比如对甲基苯酚、对乙基苯酚、对丙基苯酚、对丁基苯酚和对氯苯酚的去除率可达93%。另外,Palma等[41]开发了1种在搅拌容器中使用纯酪氨酸酶的新型经济酶法工艺处理酚类污染物,确定了最佳反应条件(温度45 ℃、pH 6.6、转速400 r/min、初始苯酚质量浓度0.000 1 mol/L和酶质量浓度50 U/mL)下酪氨酸酶的氧化效率为88.1%,初始氧化速率为10.2 mg/(L·min),以及达到反应终点所需时间为40 min。
固定化技术的普及,使得固定化材料具有广大的发展空间。将酪氨酸酶固定化到疏水基团修饰的琼脂珠上,蛋白吸附率和酶活力回收分别达到了90%和80%[42];而通过酶中的氨基基团固定于阳离子交换树脂的酪氨酸酶可重复使用,2 h后苯酚完全移除并且重复使用10次之后其活性几乎没有减弱[37];固定于改性的铝硅酸钠(NaA)和铝硅酸钙(CaA)的酪氨酸酶也可使用多次且活性没有丝毫下降[43]。邵健等[44]将酪氨酸酶固定于海藻酸钠/二氧化硅(ALG/SiO2)凝胶复合物中,发现pH为7.0时,固定化酪氨酸酶的比酶活为1 120 U/g,25℃时以邻苯二酚为底物的Km为10.6 mmol/L。相对于游离酶和海藻酸钠固定化酶,该杂化凝胶固定酪氨酸酶具有良好的热稳定性、贮存稳定性及连续使用性。Bayramoglu等[45]使用天然生物矿化硅藻开发了1个新型酪氨酸酶固定化系统,使得有望替代传统合成的高分子材料。Xu等[46]采用实用又经济的交联法,又称无载体固定化法,获得交联酪氨酸酶聚集体作为催化剂,有效治理污水中的酚类化合物。同时,纳米材料与多酚氧化酶形成的复合物可有效减少传统酶处理污水的缺点[47]。
3.4 生物检测方面
生物传感器作为生物检测的1种新兴技术,是将酶、DNA、抗体、细胞等作为分子识别物质固定在传导器上,将化学变化、热变化等转变成电信号的分析器件,具有灵敏、专一、微量、快速和准确等特点,被广泛应用于空间生命科学、食品工业、环境工程、发酵工程以及医学等领域[48]。柳亚玲[49]探讨了非导电聚合物固定的酪氨酸酶生物传感器检测灭菌磷、甲基氯吡硫磷、二嗪磷和碘硫磷4种有机磷农药的效果;Wu等[50]利用纳米级石墨烯为基本成分的酪氨酸酶生物传感器快速检测到双酚A;Yang等[51]研制了1种基于壳聚糖-碳包覆镍复合膜的新型酪氨酸酶生物传感器,用于检测儿茶酚,具有快速、可重复使用以及稳定性好的特点;Jiang等[52]基于层层组装技术,创建了固定化毛细管酪氨酸酶反应器,用于筛选酪氨酸酶抑制剂,并经19种天然中药提取物进行筛选验证,发现固定酶能够承受连续25次检测,而仅失去12%的活性;Sigolaeva等[53]也通过层层组装技术,利用聚二甲基二烯丙基氯化铵(PDDA)/酪氨酸酶/戊二醛石墨基质生物传感器测定血液中羧酸酯酶和神经病变靶酯酶的活性,表现出了良好的再现性;Singh等[54]提出了1种利用表面等离子体激元共振(SPR)建立的光纤生物传感器,用于检测水溶液中的酚醛化合物。通过热蒸发技术将银膜沉积在光纤芯上以制备传感探头,而后使用凝胶诱捕技术固定酪氨酸酶。
4 展望
酪氨酸酶具有操作条件温和、反应专一、可重复使用等特点,被广泛用于食品、美容、医药、环境等领域。由于酪氨酸酶在生物体内含量低,目前由植物来制备酪氨酸的研究未见详细报道,实验室用作制备酪氨酸酶的原料较为单一(蘑菇、马铃薯、苹果)。针对进口纯酶价格昂贵且需求量大的问题,今后的主要研究任务是提高国内生产酪氨酸酶的能力,扩展该酶来源物种种类。同时,应用基因重组等生物学技术制备优质高效表达酪氨酸酶基因的工程菌是其制备技术的发展方向,有望提高酪氨酸酶的产量。
作为国内外皮肤美白产品的重点研究对象,以天然产物为来源的酪氨酸酶抑制剂,具有广阔的应用前景,对其增效减毒、美白机制等的研究也将是重点方向。另外,随着对酪氨酸酶性质和功能的深入了解,以固定化技术为代表的酶工程技术的应用,已经成为开发新型材料的研究热点之一。随着化学、生物学、医学等多学科及相关多技术的不断发展、交叉和融合,将有利于拓展酪氨酸酶的研究和应用。
[1] Sánchez F Á,Neptuno R L J,García C F,et al.Tyrosinase:a comprehensive review ofitsmechanism[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1995,1247(1):1-11.
[2] Durán N,Rosa M A,D'Annibale A,et al.Applications of laccases and tyrosinases(phenoloxidases)immobilized on different supports:a review[J].Enzyme and Microbial Technology,2002,31(7):907-931.
[3] Fenoll L G,Rodrı'guez L J N,Garcı'a S F,et al.Analysis and interpretation of the action mechanism of mushroom tyrosinase on monophenols and diphenols generating highly unstable o-quinones[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,2001,1548(1):1-22.
[4] 李溯,丁劲松.黑色素生物合成与酪氨酸酶抑制剂的研究进展[J].中南药学,2013,11(4):278-282.
[5] 官兴丽,罗理勇,曾亮.天然产物的美白作用及其机理研究进展[J].食品工业科技,2011,32(5):432-435,439.
[6] Yao J,Liu Y,Wang T Z,et al.Microcalorimetic study on tyrosinase oxidation catalyzed by tyrosinase[J]. Chinese Chemical Letters,2003,14(6):619-622.
[7] 王宁芳.酪氨酸酶的提取及其催化活性研究[J].安徽农业科学,2009,37(20):9315-9316.
[8] 鲁卫斌,王树根,范雪荣,等.马铃薯酪氨酸酶的制备及其对羊毛的改性[J].纺织学报,2009,30(7):69-72.
[9] 樊倩,韦庆益,袁尔东,等.植物中酪氨酸酶的筛选及不同抑制剂对其活性的影响[J].食品工业科技,2012,33(10):91-93.
[10] Faridi M,Sariri R,Jafarian V,et al.Extraction and charaterization of tyrosinase from peanut grown in north of Iran[J].Iranian Journal of Plant Biology,2010,2(1):49-62.
[11] Dolashki A,Voelter W,Gushterova A,et al.Isolation and characterization of novel tyrosinase from Laceyella sacchari[J].Protein and Peptide Letters,2012,19(5):538-543.
[12] 王戈林,宁华,沈萍,等.酪氨酸酶基因工程菌产黑色素的发酵条件研究[J].中国医药工业杂志,1999,30(4):150-154.
[13] 何伟,阮丽芳,孙明,等.苏云金芽孢杆菌酪氨酸酶基因的克隆表达及应用初探[J].微生物学报,2004,44(6):824-826.
[14] Ren Q,Henes B,Fairhead M,et al.High level production of tyrosinase in recombinant Escherichia coli[J].BioMed Central Biotechnology,2013,13(1):18.
[15] 屈佳玉.微生物固定化技术及其在污水处理领域的研究进展[J].工业水处理,2010,30(10):14-16.
[16] Müller G H,Lang A,Seithel D R,et al.An enzyme-initiated hydroxylation-oxidation carbo Diels-Alder domino reaction[J].Chemistry-A European Journal,1998,4(12):2513-2522.
[17] 徐迪,庞朝乐,郭新东,等.酪氨酸酶催化对位取代苯酚和芳香胺的反应及其意义[J].有机化学,2003,23(7):724-727.
[18] 徐迪,黄成红,郭新东,等.无溶剂体系酪氨酸酶催化对位苯酚类化合物与芳香胺的反应研究[J].分子催化,2004,18(1):10-14.
[19] Casella L,Granata A,Monzani E,et al.New aspects of the reactivity of tyrosinase[J].Micron,2004,35(1/2):141-142.
[20] Stratford M R L,Riley P A,Ramsden C A.Rapid halogen substitution and dibenzodioxin formation during tyrosinasecatalyzed oxidation of 4-halocatechols[J].Chemical Research in Toxicology,2011,24(3):350-356.
[21] Brooks S J,Nikodinovic J,Martin L,et al.Production of a chiral alcohol,1-(3,4-dihydroxyphenyl)ethanol, by mushroom tyrosinase[J],Biotechnology Letters,2013,35(5):779-783.
[22] 陈景华,王兴焱,王雪,等.当归提取物对黑素瘤细胞与角质形成细胞共培养模型黑素合成的影响[J].中国实验方剂学杂志,2012,18(17):205-208.
[23] 朴香兰,杨静,楼彩霞,等.连翘对酪氨酸酶的抑制活性[J].中央民族大学学报:自然科学版,2012,21(4):19-22.
[24] 唐建阳,苏明星,刘凤娇,等.砂仁提取物对蘑菇酪氨酸酶活力的抑制效应[J].厦门大学学报:自然科学版,2012,51(2):258-262.
[25] 穆燕,魏海柳,李琳,等.白附子酪氨酸酶活性抑制成分的提取与分离[J].食品工业科技,2012,33(11):247-249.
[26] 孙培冬,王小洪.二氢杨梅素对酪氨酸酶抑制作用研究[J].化学研究与应用,2013,25(6):871-874.
[27] 沈晓佳,赵黎明,周家春,等.紫娟茶提取物对酪氨酸酶活性的抑制作用[J].食品工业科技,2012,33(24):75-80.
[28] 严航,唐婷,干丽,等.薏苡仁提取物对酪氨酸酶抑制作用[J].中成药,2013,35(4):696-699.
[29] 李红艳,刘艳杰,王倩,等.红花中酪氨酸酶抑制成分的快速筛选和分析[J].现代药物与临床,2013,28(2):170-174.
[30] Dung N T,Bajpai V K,Rahman A,et al.Phenolic contents,antioxidantand tyrosinase inhibitory activities ofLonicera Japonica Thumb[J].Journal of Food Biochemistry,2011,35(1):148-160.
[31] Zhang L,Ding Z Y,Xu P,et al.Methyl lucidenate F isolated from the ethanol-soluble-acidic components of Ganoderma lucidum is a noveltyrosinase inhibitor[J].Biotechnology and Bioprocess Engineering,2011,16:457-461.
[32] Kim J H,Lee E S,Lee C H.Melanin biosynthesis inhibitory effects of claycosin-7-O-β-D-glucoside isolated from Astragalus(Astragalus membranaceus)[J]. Food Science and Biotechnology,2011,20(6):1481-1485.
[33] Ding H Y,Chou T H,Lin R J,et al.Antioxidant and antimelanogenic behaviors of Paeonia suffruticosa[J].Plant Foods for Human Nutrition,2011,66:275-284.
[34] Li H T,Ruan S W,Huang J C,et al.Antioxidant and tyrosinase inhibitor from Leucaena leucocephala[J].African Journal of Biotechnology,2012,11(77):14182-14185.
[35] Zheng Z P,TanH Y,WangM F.Tyrosinaseinhibition constituents from the roots of Morus australis[J].Fitoterapia,2012,83:1008-1013.
[36] Chen Y S,Lee S M,Lin C C,et al.Kinetic study on the tyrosinase and melanin formation inhibitory activities of carthamus yellow isolated from Carthamus tinctorius L.[J].Journal of Bioscience and Bioengineering,2013,115(3):242-245.
[37] Wada S,Ichikawa H,Tatsumi K.Removal of phenols from wastewater by soluble and immobilized tyrosinase[J].Biotechnology and Bioengineering,1993,42(7):854-858.
[38] 段穗芳,万学勤.酪氨酸酶的固定化技术在医院污水处理中的应用[J].中国热带医学,2010,10(4):513-514.
[39] Ikehata K,Nicell J A.Characterization of tyrosinase for the treatment of aqueous phenols[J].Bioresource Technology,2000,74(3):191-199.
[40] Yamada K,Akiba Y,Shibuya T,et al.Water purification through bioconversion of phenol compounds by tyrosinase and chemical adsorption by chitosan beads[J].Biotechnology Progress,2005,21(3):823-829.
[41] Palma M S A,Horn H,Zilli M,et al.A new enzymatic process for the treatment of phenolic pollutants[J].Brazilian Archives of Biology and Technology,2013,56(4):653-662.
[42] 安林坤,马林,全军民,等.固定化酪氨酸酶去除水中酚及胺类物质的研究[J].中山大学学报:自然科学版,2000,39(5):1-5.
[43] Seetharam G B,Saville B A.Degradation of phenol using tyrosinase immobilized on siliceous supports[J].Water Research,2003,37(2):436-440.
[44] 邵健,王亚玲,季美娟.ALG/SiO2杂化凝胶固定酪氨酸酶处理含酚废水[J].化学研究与应用,2007,19(10):1169-1172.
[45] Bayramoglu G,Akbulut A,Yakup A M.Immobilization of tyrosinase on modified diatom biosilica:enzymatic removal of phenoliccompoundsfrom aqueoussolution[J].Journalof Hazardous Materials,2013(244/255):528-536.
[46] Xu D Y,Yang Z.Cross-linked tyrosinase aggregates for elimination ofphenolic compoundsfrom wastewater[J].Chemosphere,2013,92(4):391-398.
[47] Mukherjee S,Basak B,Bhunia B,et al.Potential use of polyphenol oxidases(PPO)in the bioremediation of phenolic contaminants containing industrial wastewater[J].Reviews in Environmental Science and Biotechnology,2013,12(1):61-73.
[48] 郭小群.生物传感器应用与发展[J].广东化工,2012,39(12):9-10.
[49] 柳亚玲.酪氨酸酶生物传感器的研制及其应用于有机磷类农药的检测[D].广州:广东工业大学,2012.
[50] Wu L D,Deng D H,Jin J,et al.Nanographene-based tyrosinase biosensor for rapid detection of bisphenol A[J].Biosensors and Bioelectronics,2012,35(1):193-199.
[51] Yang L J,Xiong H Y,Zhang X H,et al.A novel tyrosinase biosensor based on chitosan-carbon-coated nickel nanocomposite film[J].Bioelectrochemistry,2012,84:44-48.
[52] Jiang T F,Liang T T,Wang Y H,et al.Immobilized capillary tyrosinase microreactor for inhibitor screening in natural extracts by capillary electrophoresis[J].Journal of Pharmaceutical and Biomedical Analysis,2013,84:36-40.
[53] Sigolaeva L V,Dubacheva G V,Porus M V,et al.A layer-by-layer tyrosinase biosensor for assay of carboxylesterase and neuropathy target esterase activities in blood[J].Analytical Methods,2013,5(16):3872-3879.
[54] Singh S,Mishra S K,Gupta B D.SPR based fibre optic biosensor for phenolic compounds using immobilization of tyrosinase in polyacrylamide gel[J].Sensors and Actuators B:Chemical,2013,186:388-395.

