自组装金片表面化学功能团对骨肉瘤细胞黏附的影响
邓英虎,李丽华,李 梅,夏 虹
基础研究
自组装金片表面化学功能团对骨肉瘤细胞黏附的影响
邓英虎,李丽华,李 梅,夏 虹
目的探讨自组装金片表面化学功能团对骨肉瘤细胞黏附的影响。方法将标准统一的金片,放入带有1%不同功能团的硫醇试剂中浸泡12 h,自组装为甲基、氨基、羧基和羟基功能团的单一表面膜,并对其表面接触角进行测定。将U2-OS细胞接种于不同功能团及对照组(裸金片)表面,培养3、6、9 h后,光镜下观察各组细胞黏附数及形态学变化,选择培养6 h的金片进行扫描电镜观察。结果羟基、羧基、氨基和甲基表面接触角为9.5°±1.2°、18.3°±3.9°、59.7°±3.8°和105°±9.1°,不同化学基团修饰表面的接触角比较,差异有统计学意义(P<0.05)。培养3 h,各组黏附于金片表面的细胞基本呈小圆形,甲基表面黏附的细胞不紧密,呈将脱落状;培养6 h,氨基、羧基、羟基及对照组金片表面细胞体积增大,可见大椭圆形、梭形及多边形细胞,而在甲基组金片表面细胞仍呈小圆形;培养9 h,各组细胞形态变化差异更加明显,而甲基表面的细胞多数仍呈圆形或椭圆形。随着培养时间的延长,甲基金片表面的细胞数增加最不明显,不同时相点各组细胞数比较,差异有统计学意义(P<0.05);各组金片表面黏附细胞数总体趋势为甲基<<羟基<羧基≈氨基。扫描电镜下细胞在羟基和羧基表面多为椭圆形和多边形,细胞体积较大,胞浆丰富,可见较多伪足伸出,部分较大伪足相互融合;氨基表面细胞多数为长梭形;甲基表面的细胞仍呈小圆形,细胞体积较小。结论甲基功能团可能对自组装金片表面骨肉瘤细胞的黏附行为具有抑制作用。
骨肉瘤;肿瘤细胞,培养的;细胞黏附;自组装膜;化学功能团
随着组织工程学和材料科学的发展,有关材料表面细胞黏附行为的研究越来越受到学者们的关注。而甲基、羟基、氨基、羧基等功能团不仅对神经干细胞[1]、间充质干细胞[2-3]等正常组织细胞的黏附造成影响,而且还会改变材料对肝癌、乳腺癌等肿瘤细胞的黏附能力[4-5]。本研究观察自组装金片单一规律化学功能团对骨肉瘤细胞黏附行为的影响,试图寻找出有效抑制骨肉瘤细胞黏附的化学功能团,为今后制备抑瘤型人工假体材料提供实验依据。
1 材料与方法
1.1 主要实验仪器与试剂
头基分别为甲基、氨基、羧基和羟基的4种硫醇(美国Sigma公司),RPMI 1640培养基(美国Gibco公司),优等胎牛血清、胰蛋白酶(美国Hyclone公司),硅片、OCA20接触角测量系统(德国Dataphysics公司),S-3700N扫描电镜(日本Hitachi公司),HBOSO/AC光学显微镜(德国Zeiss公司),AIRTECH超净工作台(苏净集团安泰公司),TY-80s摇床(江苏省金坛市医疗仪器厂),CO2细胞培养箱(美国Precision Scientific公司),HCP-2临界点干燥仪(北京海德生物公司),SC-7自动喷金仪(美国Pelco公司)。
1.2 金片制备
采用真空蒸镀或等离子溅射方法在硅(110)光滑面上镀一层Ti,然后在Ti层上镀一层厚约10 nm的金制备镀金硅片,取回后切割成相应24孔板大小的形状,面积为0.8 cm×1.2 cm,于蒸馏水中清洗3次,浓硫酸和双氧水3∶1混合溶液中浸泡10 min,无水乙醇清洗,再用蒸馏水清洗,置于小皿中保存。
1.3 金片表面不同化学功能团的接种
将带有1%不同功能团浓度的硫醇溶液加入小皿中浸泡金片,以封口胶带封口、锡箔纸包装后全程避光,浸泡12 h。此间硫醇分子与金片表面发生共价结合,自行组装于金片表面,最后将这些表面分别带有甲基、羟基、氨基和羧基功能团的金片放入24孔培养板中,在培养细胞前以灭菌的PBS反复浸洗5次。
1.4 不同化学功能团的接触角测量
本项目委托清华大学材料科学与工程系再生与仿生材料研究所完成。首先用氮气烘干接枝好的样品,然后在每种化学官能团材料表面滴4 mL超纯水。使用接触角测量系统在大气环境下分别测量4种化学官能团材料表面的接触角,每次3个标本,每种化学功能团共重复测量6次。
1.5 骨肉瘤细胞的培养及传代
骨肉瘤细胞株由广州军区广州总医院医学实验科细胞库提供。从液氮罐中取出U2-OS细胞盒,经快速复苏、平衡离心后用RPMI 1640培养基重悬细胞,吸管反复吹打细胞至浓度为5×105/mL的单细胞悬液。分装入培养瓶内,加入2~3 mL含10%胎牛血清的RPMI 1640培养基,37℃、5% CO2恒温培养箱内过夜,待细胞完全贴壁生长后换液继续培养。细胞几乎布满整个培养瓶底时进行传代培养。
1.6 光镜观察U2-OS细胞黏附情况
将接种有4种不同功能团的金片放入24孔板中,含甲基组、氨基组、羟基组和羧基组功能团金片各3孔,每孔1片金片,裸金片作为对照组。用含10%胎牛血清的RPMI 1640培养基将细胞稀释为1×104/mL的单细胞悬液,每孔250µL,再加入250µL培养液成等比例稀释,轻轻吹打,避免细胞因加液过程中的重力作用而堆积于金片表面,放入37℃、5%CO2恒温培养箱内培养24 h,更换培养液继续培养3、6、9 h,光镜下观察各组细胞黏附情况,200倍视野下随机选取5个视野进行细胞计数。
1.7 扫描电镜观察U2-OS细胞黏附形态
将接种有4种不同功能团的金片放入24孔板中,含甲基、氨基、羟基和羧基功能团金片各3孔,每孔1片金片,裸金片作为对照组。呈对数生长期的U2-OS细胞消化、离心和稀释后通过含10%胎牛血清的RPMI 1640培养基继续稀释为1×104/mL的单细胞悬液,每孔250µL,再加入250µL培养液成等比例稀释,轻轻吹打,置入37℃、5%CO2恒温培养箱内培养24 h后更换培养基,继续培养6 h,吸净各孔培养基,每孔加入3%戊二醛溶液250µL,封口于4℃下静置30 min;PBS洗4次,每次15 min;30%、50%乙醇每个浓度依次脱水2次,每次10 min;70%乙醇脱水15 min或置于70%乙醇中保存过夜;90%乙醇脱水5 min;无水乙醇脱水2次,每次5 min;无水丙酮脱水5 min;乙酸异戊酯置换2次,每次5 min;HCP-2临界点干燥仪干燥3 h,黏样品上铜台,自动喷金仪镀金,最后经扫描电镜观察拍照。
1.8 统计学分析
应用SPSS 13.0统计软件进行分析,符合正态分布的计量资料以均数±标准差(x-±s)表示,多组比较采用One-WayANOVA分析,不同时相点的表面黏附细胞数采用重复测量数据的方差分析法(General Linear Model法)进行比较,方差齐时组间多重比较采用LSD-t法,方差不齐时采用Welch法和Dunnetts T3法进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 化学功能团表面接触角
镀金硅片与不同的硫醇试剂反应后,分别得到表面结构均匀的单分子自组装膜,这种单分子膜的表面分别为单一的甲基、氨基、羧基和羟基化学功能团。羟基化、羧基化、氨基化、甲基化化学基团表面的接触角分别为9.5°±1.2°、18.3°± 3.9°、59.7°±3.8°和105°±9.1°;不同化学基团修饰表面的接触角比较,差异有统计学意义(W= 1 488.411,P=0.000)。
2.2光镜下细胞黏附情况
培养3 h,各组黏附于金片表面的细胞基本呈小圆形,少许呈小椭圆形,甲基表面黏附的细胞不紧密,呈将脱落状;培养6 h,各组细胞形态开始多样化,氨基、羧基、羟基及对照组金片表面细胞体积增大,可见大椭圆形、梭形及多边形细胞,而在甲基表面细胞仍呈小圆形;培养9 h,各组细胞形态变化差异更加明显,有更多梭形、不规则形细胞出现,而甲基表面的细胞多数仍呈圆形或椭圆形,梭形、不规则形细胞较少。
随着培养时间的延长,甲基组细胞数增加最不明显,羟基组和对照组细胞数增长较少,氨基和羧基组细胞数明显增加,进一步统计学结果不拒绝球形假设(W=0.813,P=0.394),且检测时间点与组间有交互作用(F=89.315,P=0.000),不同时相点各组细胞数比较,差异有统计学意义(F= 122.008,P=0.000)。见图1,表1。
具体来说,培养3 h黏附细胞以氨基组金片表面稍多,甲基组、羟基组和对照组表面较少(图2)。氨基组与甲基组、羟基组和对照组比较,差异有统计学意义(P<0.05);与羧基组比较,差异无统计学意义(P>0.05);甲基组、羟基组和对照组比较,差异无统计学意义(P>0.05)。如图3所示,培养6 h甲基表面细胞数增加不明显,其他各组表面细胞数均有不同程度增加,氨基组增加最明显,与其他组比较,差异有统计学意义(P<0.05),而甲基组与对照组表面细胞数差异无统计学意义(P>0.05)。如图4所示,培养9 h氨基组、羧基组和羟基组细胞数均明显增多,其中氨基组增加最明显,甲基组增加不明显,各组比较,差异均有统计学意义(P<0.05);各组金片表面黏附细胞数均数总体趋势为甲基<<羟基<羧基≈氨基。
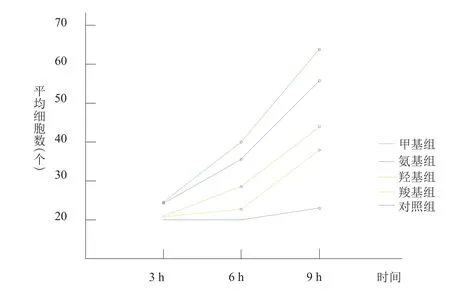
图1 不同时相各组功能团表面细胞数
表1 不同化学功能团表面黏附细胞数比较(±s,n=3,个)
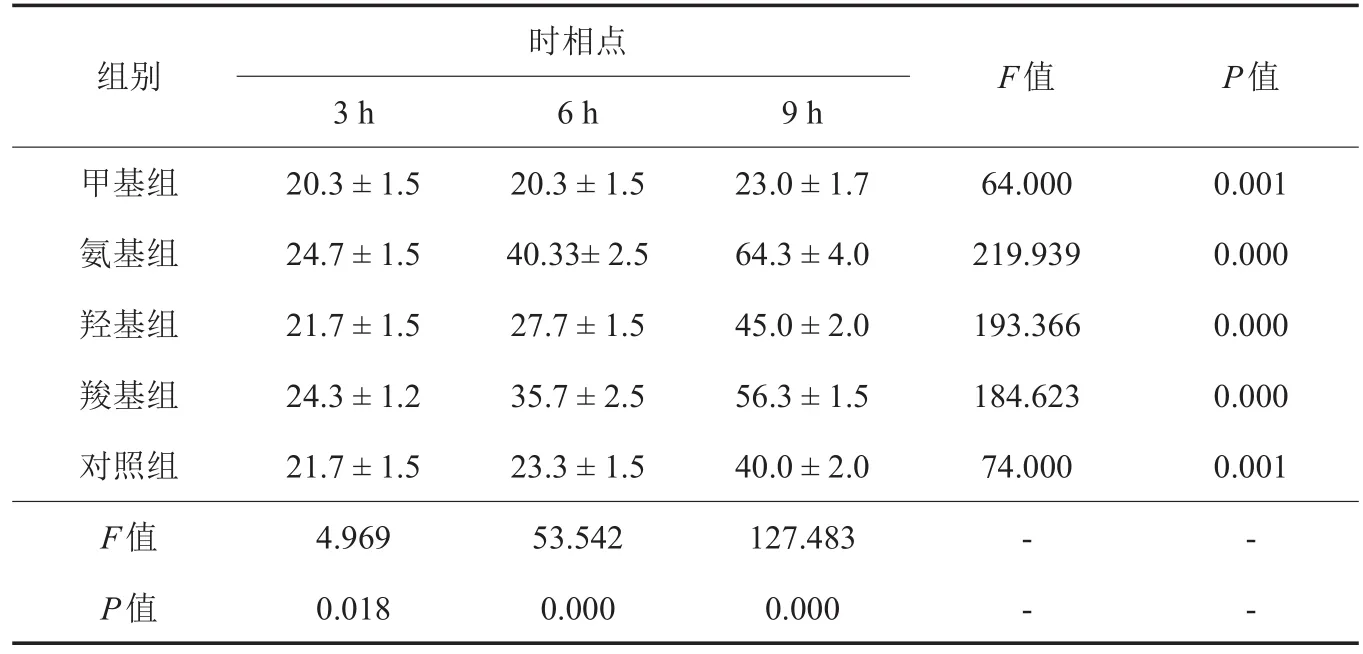
表1 不同化学功能团表面黏附细胞数比较(±s,n=3,个)
时相点组别F值P值甲基组氨基组羟基组羧基组对照组F值P值3 h 20.3±1.5 24.7±1.5 21.7±1.5 24.3±1.2 21.7±1.5 4.969 0.018 6 h 20.3±1.5 40.33±2.5 27.7±1.5 35.7±2.5 23.3±1.5 53.542 0.000 9 h 23.0±1.7 64.3±4.0 45.0±2.0 56.3±1.5 40.0±2.0 127.483 0.000 64.000 219.939 193.366 184.623 74.000 0.001 0.000 0.000 0.000 0.001 ----
2.3 扫描电镜观察细胞黏附形态
扫描电镜下各组功能团表面黏附细胞的形态学变化如图5所示,U2-OS细胞与各组金片混合培养6 h,细胞在羟基和羧基组金片表面多呈椭圆形和多边形,细胞体积较大,胞浆丰富,可见较多伪足伸出,部分较大伪足相互融合;而氨基功能团表面的细胞多数为长梭形;甲基表面的细胞仍呈小圆形,细胞体积较小。

图2 U2-OS细胞在不同化学功能团表面培养3 h镜下观察(200×)2A甲基 2B氨基2C羟基 2D羧基 2E对照组

图3 U2-OS细胞在不同化学功能团表面培养6 h镜下观察(200×)3A甲基 3B氨基3C羟基 3D羧基 3E对照组
3 讨论
骨肉瘤属于间叶组织来源的恶性肿瘤,目前尚缺乏行之有效的治疗方案。随着新辅助化疗技术的开展,保肢手术成为主要的外科治疗方式,但仍面临着局部肿瘤复发、肿瘤切除后骨与软组织重建等问题。抗肿瘤人工骨移植材料的研制是目前的一个发展方向[6-7]。从这个角度出发,如果将具有抗骨肉瘤细胞黏附的化学功能团用于骨移植材料或假体的表面修饰,达到局部应用时降低骨肉瘤细胞黏附、增殖,甚至诱导骨肉瘤细胞凋亡、坏死的作用,就能够起到治疗或降低骨肉瘤复发的效果。自组装膜是利用固体表面在稀溶液中吸附活性物质而形成的有序分子,金片自组装膜具有金表面稳定、S-Au键强度高、反应条件易控制以及单分子膜高度有序均匀等特点,可排除材料表面其他各种生物物理因素的干扰,有利于考察材料单一化学因素对细胞生物学行为的影响[8-10]。有鉴于此,我们采用自组装膜技术,观察自组装金片表面化学功能团对骨肉瘤细胞黏附的影响,以期筛选出适合用于抑瘤型人工骨移植材料的化学功能团。

图4 U2-OS细胞在不同化学功能团表面培养9 h镜下观察(200×)4A甲基 4B氨基4C羟基 4D羧基 4E对照组
3.1 细胞黏附性能的影响因素
骨肉瘤细胞在不同化学功能团表面黏附异常可能受到多种因素影响,如化学功能团的亲疏水性[11-12]、细胞黏附蛋白和黏附分子[13-15]和化学功能团表面的流剪切应力[16-17]等。
Ren等[1]报道,甲基具有非常强的疏水性,而羟基、羧基均具有亲水性,其中羟基亲水性较强;甲基组的神经干细胞与材料表面接触面积最小,细胞最圆,在甲基、羧基表面细胞则有长的突起形成。Barrias等[12]的观测结果表明,不同的羟基和甲基组成,其接触角各不相同。本研究结果显示,甲基、羟基、羧基和氨基具有不同的亲疏水性,其中羟基、羧基和氨基的表面接触角均<90°,提示三者均存在亲水性,其中羟基表面接触角最小,最具亲水性;羧基表面的接触角稍大,亲水性居中;氨基表面的接触角进一步增大,亲水性降低,相对具有疏水性,但仍属于亲水基团;而甲基表面的接触角最大,具有最强的疏水性。
化学功能团表面吸附的黏附蛋白和细胞表面黏附分子的共同作用也会直接影响细胞在材料表面的黏附。Faucheux等[18]发现,在聚乙二醇和羟基组表面吸附的血清蛋白明显少于氨基、甲基和羧基表面,且主要吸附的蛋白成分为玻连蛋白,很少检测到纤连蛋白;甲基和氨基、羧基表面吸附的血清蛋白相似,但甲基表面的成纤维细胞数明显少于羧基和氨基组,可能是由于氨基和羧基可以提高细胞表面的整合素家族活性,从而促进成纤维细胞在氨基和羧基表面的黏附。Keselowsky等[19]的研究结果同样证实,细胞与材料的黏附过程主要受α5β1整合素受体调控,羟基团能吸附大量有利于黏附的蛋白成分,氨基和羧基具有中等程度的蛋白吸附能力,而甲基吸附蛋白的能力最弱。
亦有学者探讨不同化学功能团表面流剪切应力对细胞黏附行为的影响。Tegoulia等[16]发现甲基、羧基、磷酰胆碱、氧化乙烯和羟基功能团表面的剪切速率不同,剪切速率越大,细胞的黏附情况越差。Li等[17]的研究结果则显示,氨基扩大了细胞对流剪切应力的反应,而甲基和羟基则作用相反。

图5 扫描电镜观察培养6 h各组化学功能团表面黏附细胞形态 5A甲基 5B氨基 5C羟基 5D羧基
3.2 自组装膜表面功能团对骨肉瘤细胞黏附影响
骨肉瘤细胞具有贴壁生长的生物学特性,同样存在吸附、接触、贴壁和扩展等4个基本过程。本研究结果表明,在氨基、羟基和羧基表面,骨肉瘤细胞也同样具有良好的黏附性及扩展能力,这与之前其它细胞的相关研究报道一致[4-5]。然而,在甲基表面黏附的骨肉瘤细胞呈小圆形,体积非常小,黏附的细胞数也较少。一方面可能与甲基功能团具有较强的疏水性,不利于细胞的黏附有关;另一方面甲基化学功能团可能抑制了整合素家族的活性,阻止了黏附蛋白的有效吸附。本研究结果还发现在羟基和羧基表面的细胞早期呈现出多边形态,氨基表面的细胞形态更加多样化,主要为长梭形和多边形,提示氨基表面的细胞活性可能高于羟基和羧基;各组细胞数随着培养时间的延长均呈现增加趋势,表明化学功能团随着时间的延长可能存在一定程度的衰减或脱落可能。
然而,骨肉瘤细胞在甲基、氨基、羧基和羟基表面黏附的多样性需要从多角度进行分析。如果简单从化学功能团的亲水特性来分析,羟基具有最强的亲水性,甲基具有最强的疏水性,甲基表面黏附的细胞数应该最少,羟基表面最多;如果按照Keselowsky等[19]的整合素受体调控机制来分析,同样也是羟基组细胞数最多,甲基组细胞数最少。但本实验结果却显示,氨基和羧基组表面黏附的骨肉瘤细胞数最多。究其原因,我们认为细胞在材料表面的黏附情况是非常复杂的,可能有多种作用机制存在,既要考虑材料的亲水性,又要考虑材料的化学特性和流剪切应力等,同时细胞自身不同的生物学特性也可能影响细胞黏附的过程。
综上所述,甲基功能团具有较强的抑制骨肉瘤细胞黏附的作用,下一步我们将深入研究其在抑制骨肉瘤细胞增殖和促进凋亡过程中所扮演的角色,以期为骨肉瘤的治疗选择提供实验依据。
[1]Ren YJ,Zhang H,Huang H,et al.In vitro behavior of neural stem cells in response to different chemical functional groups[J].Biomaterials,2009,30(6):1036-1044.
[2]Curran JM,Chen R,Hunt JA.Controlling the phenotype and function of mesenchymal stem cells in vitro by adhesion to silane-modified clean glass surfaces[J].Biomaterials,2005, 26(34):7057-7067.
[3]Bauer S,Park J,von der Mark K,et al.Improved attachment of mesenchymal stem cells on super-hydrophobic TiO2 nanotubes[J].Acta Biomater,2008,4(5):1576-1582.
[4]Yan H,Zhang S,He J,et al.Self-assembled monolayers with different chemical group substrates for the study of MCF-7 breast cancer cell line behavior[J].Biomed Mater,2013,8 (3):035008.
[5]Yu XL,Xu SJ,Shao JD,et al.Different fate of cancer cells on several chemical functional groups[J].Surface Coating Technol,2013,228(Suppl 1):S48-S54.
[6]杨进城,张余,尹庆水.自制抗肿瘤珊瑚羟基磷灰石人工骨的制备及性能评价[J].广东医医学,2010,31(24):3160-3163.
[7]冯伟,靳安民,刘纪恩,等.5-氟尿嘧啶纳米微球复合材料填充骨缺损及抗肿瘤作用[J].中国组织工程,2013,17(12): 2131-2137.
[8]Smith RK,Lewis PA,Weiss PS.Patterning self-assembled monolayers[J].Prog Surf Sci,2004,75(1-2):1-68.
[9] Poirier GE,Pylant ED.The self-assembly mechanism of alkanethiols on Au(111)[J].Science,1996,272(5265): 1145-1148.
[10]Thevenot P,Cho J,Wavhal D,et al.Surface chemistry influences cancer killing effect of TiO2 nanoparticles[J]. Nanomedicine,2008,4(3):226-236.
[11]Wijenayaka AK,Colby CB,Atkins GJ,et al.Biomimetic hydroxyapatite coating on glass coverslips for the assay of osteoclast activity in vitro[J].J Mater Sci Mater Med,2009, 20(7):1467-1473.
[12]Barrias CC,Martins MC,Almeida-Porada G,et al.The correlation between the adsorption of adhesive proteins and cellbehaviouron hydroxyl-methylmixed self-assembled monolayers[J].Biomaterials,2009,30(3):307-316.
[13]Lee J,Choi I,Yeo WS.Preparation of gradient surfaces by using a simple chemical reaction and investigation of cell adhesion on a two-component gradient[J].Chemistry,2013, 19(18):5609-5616.
[14]Yoon SH,Mofrad MR.Cell adhesion and detachment on gold surfaces modified with a thiol-functionalized RGD peptide [J].Biomaterials,2011,32(30):7286-7296.
[15]Kim DJ,Lee JM,Park JG,et al.A self-assembled monolayer-based micropatterned array for controlling cell adhesion and protein adsorption[J].Biotechnol Bioeng,2011,108(5): 1194-1202.
[16]Tegoulia VA,Cooper SL.Leukocyte adhesion on model surfaces under flow:effects of surface chemistry,protein adsorption,and shear rate[J].J Biomed Mater Res,2000,50 (3):291-301.
[17]Li Y,Luo YF,Huang K,et al.The responses of osteoblasts to fluid shear stress depend on substrate chemistries[J]. Archives of Biochem Biophys,2013,539(1):38-50.
[18]Faucheux N,Schweiss R,Lützow K,et al.Self-assembled monolayerswith differentterminating groupsasmodel substrates for cell adhesion studies[J].Biomaterials,2004,25 (14):2721-2730.
[19]Keselowsky BG,Collard DM,García AJ.Surface chemistry modulates focal adhesion composition and signaling through changes in integrin binding[J].Biomaterials,2004,25(28): 5947-5954.
Effects of chemical groups of gold surface with self-assembled monolayers on osteosarcoma cells adhesion
DENG Yinghu*,LI Lihua,LI Mei,XIA Hong.*Department II of Orthopaedics,Tongling People's Hospital, Tongling,Anhui 244000,China.
XIA Hong,E-mail:gzxiahong2@126.com
ObjectiveTo observe the effects of chemical groups of gold surface with self-assembled monolayers(SAMs)on U2-OS sarcoma cells adhesion.Methods After immersion into thiol solutions with 1%different chemical groups for 12 h respectively,the methyl(-CH3),amino(-NH2),carboxyl(-COOH)and hydroxyl(-OH)functional groups were self-assembled on Au layers,and the surface contact angles were determined respectively to evaluate the equivalent surface densities of chemical functional groups.U2-OS cells were seeded on these substrates,and the surface of bare Au layers was as control.Cell adhesion was observed under light microscope after 3,6,9 hours'culture,and further examination was undertaken by scanning electron microscopy(SEM)after 6 hours'culture.Results The contact angle of-OH,-COOH,-NH2 and-CH3 surface was 9.5°±1.2°,18.3°±3.9°,59.7°±3.8°and 105°±9.1°respectively,which there had statistical differences among these chemical groups(P<0.05).Under light microscope,after 3 hours'culture,almost all of U2-OS cells adhered onto the surface of the gold subtrates began to present a small round shape,the cells on the-CH3 surface seemed to be very loose.Six hours later,cells volume on the surface of-NH2,-COOH,-OH and control group increased,and large oval,polygonal,spindle cells had been found,but the cells on-CH3 surface were still small round.After 9 hours'incubation,there existed significant differences of cell morphology in different groups,while cells on-CH3 surface still remained round or oval.As the culture time went by,cell number increase on-CH3 surface was the least,the differences of cell number among groups at each time point had statisticalsignificance (P <0.05);The adhesion numberofU2-OS cellsfollowed the trend:-CH3< <-OH<-COOH≈-NH2.SEM results indicated that U2-OS cells cultured on-OH and-COOH surfaces after 6 hours'incubation often exhibited polygonal and oval morphology with bigger volume and adbundant cytoplasm, and more pseudopodia extended and partial fused with each other;Most of cells on-NH2 surface showed a spindle shape,while cells cultured on-CH3 surface were smaller and in a spherical shape.Conclusion-CH3 functional group probably inhibit the adhesion of osteosarcoma cells on the gold surface with SAMs.
Osteosarcoma;Tumorcells,cultured;Celladhesion;Chemicalfunctionalgroup; Self-assembled monolayer
R738,R361.3
A
1674-666X(2014)04-0238-08
2014-05-10;
2014-06-13)
(本文编辑:张 辉)
10.3969/j.issn.1674-666X.2014.04.008
国家自然科学基金项目(81272057);全军医学科学技术研究“十二五计划”(81271957)
244000安徽,铜陵市人民医院骨2科(邓英虎);510010广州军区广州总医院骨科医院(李丽华,李梅,夏虹)
夏虹,E-mail:gzxiahong2@126.com

