超声结合苹果酸处理对双孢蘑菇多酚氧化酶活性及失活动力学的影响
周 磊 刘 伟 熊志强 邹立强 方志超
ZHOU Lei LIU Wei XIONG Zhi-qiang ZOU Li-qiangFANG Zhi-chao
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang,Jiangxi 330047,China)
多酚氧化酶(polyphenoloxidase,PPO)普遍存在于植物、真菌及昆虫的质体中,是自然界中分布极广的一种氧化还原酶,PPO在植物细胞组织中的位置会因原料的品种、种类及成熟度的不同而存在差异[1,2]。由PPO诱导的酶促反应使果蔬在贮藏、运输及加工过程中发生褐变反应,褐变反应在很大程度上影响果蔬的营养及感官等各种品质。因此,抑制褐变反应在果蔬贮藏、运输过程中十分的重要。
对PPO进行改性一直是PPO研究的热点,其中主要的应用手段有:化学方法(如添加亚硫酸盐[3]、有机酸[4,5]等);物理方法(如热处理[6,7]、脉冲电场[8]、静高压[9])等;多种处理手段结合使用的方法(如超声结合热处理[10]、高压与温度相结合[11]、抗坏血酸结合热处理[12]等)。在本课题组先前的研究中利用了动态高压微射流[13,14]对PPO进行处理。目前,关于有机酸单独处理对PPO活性影响的报道较多,顾林等[4]研究发现抗坏血酸及柠檬酸能有效抑制山药PPO的活性,赵东海等[5]报道了半胱氨酸及抗坏血酸对蘑菇PPO具有较强的抑制效果。本课题组研究报道了柠檬酸对蘑菇PPO的抑制效果,PPO经60 mmol/L的柠檬酸处理后基本失活[15]。超声作为一种非热手段在食品行业有着广泛运用,有许多研究报道了超声结合其它手段处理PPO,如Cheng等[10]运用超声结合热处理对PPO失活动力学进行研究,Ba?lar等[16]研究了超声结合紫外对苹果汁PPO活性的影响。苹果酸与超声结合对PPO活性及失活动力学的研究则还没有报道,苹果酸作为一种有机酸存在于许多果蔬中,在食品行业中常作为酸味调节剂来使用,因此,超声结合苹果酸的运用在工业上具有一定的可行性。
本试验以双孢蘑菇PPO为原料,首先用不同浓度的苹果酸对蘑菇PPO进行处理,测定处理后PPO的相对活性。选取中等浓度的苹果酸结合超声对PPO进行处理,测定中等浓度的苹果酸结合超声处理对PPO活性的影响,计算失活速率常数 (k)、D 值及半衰期(t1/2)的变化。本研究为更好的利用苹果酸及超声抑制PPO的活性提供理论基础,对控制果蔬的酶促褐变具有重要意义。
1 材料与方法
1.1 材料与试剂
双孢蘑菇PPO:活性700 U/mg,美国 Worthington Biochemical公司;
苹果酸:分析纯,阿拉丁试剂上海有限公司;
邻苯二酚、磷酸氢二钠、磷酸二氢钠:分析纯,天津市大茂化学试剂厂。
1.2 仪器与设备
超声波细胞破碎仪:JY88-II型,宁波新芝生物科技有限公司;
紫外光谱仪:PC-1600型,上海美谱达公司。
1.3 方法
1.3.1 PPO活性的测定 参照Liu等[14]的方法,反应底物共2.9 m L,其中含2.7 m L 50 mmol/L、p H 6.8的磷酸缓冲溶液与0.2 m L 2 mmol/L的邻苯二酚溶液,反应前将底物溶液在水浴锅中于37℃下恒温20 min。取酶液0.1 m L与底物混合,立即于420 nm波长下测定反应5 min前后其吸光度的变化。
酶活力的定义:每分钟内每毫升酶液于420 nm波长处吸光度变化0.001定义为1个酶活力单位。相对活性的定义见式(1)。
1.3.2 苹果酸对PPO溶液的处理 称取不同质量的苹果酸,分别用10 m L 50 mmol/L、p H 6.8的磷酸缓冲液溶解成浓度为20,30,40,50,60,80,100,120 mmol/L 的苹果酸溶液。称取20.00 mg PPO,将其溶解于100 m L 50 mmol/L磷酸缓冲液(p H 6.8)配制成0.2 mg/m L PPO 溶液。分别取10 m L不同浓度的苹果酸溶液与10 m L PPO溶液混合,最后PPO的浓度为0.1 mg/m L,苹果酸的最终浓度分别为10,15,20,25,30,40,50,60 mmol/L。处理20 min后测定不同浓度的苹果酸对PPO活性的影响。
1.3.3 超声对PPO溶液的处理 称取2 mg PPO溶解于20 m L 50 mmol/L磷酸缓冲液(p H 6.8)配制成0.1 mg/m L PPO溶液,立即将超声波细胞破碎仪的探针置于装有PPO溶液的烧杯中,于冰浴条件下进行超声处理,探针伸入液面3 cm。超声频率为25 k Hz,功率为250 W,超声时间分别为10,20,30,40,50,60 min。
1.3.4 超声结合苹果酸对PPO溶液的处理 选取中等浓度的苹果酸(15,20,25 mmol/L)结合超声对PPO进行处理:按方法1.3.2得到中等浓度苹果酸(15,20,25 mmol/L)处理后的20 m L PPO溶液,立即将超声波细胞破碎仪的探针置于装有PPO溶液的烧杯中,于冰浴条件下进行超声处理,探针伸入液面3 cm。超声频率为25 k Hz,功率为250 W,超声时间分别为10,20,30,40,50,60 min。
1.3.5 失活动力学的分析 酶的失活动力学可用一级方程进行表达:

式中:
At—— 样品经过t min处理后的相对酶活,U/min;
t—— 处理的时间,min;
k—— 失活速率常数,min-1。
可将上述一级反应方程式转变成式(3):

式中:
A0—— 原酶活,U/min。
可根据上述式(3),以t为横坐标,相对酶活的对数ln(At/A0)为纵坐标作出失活曲线图,并通过曲线斜率计算出各浓度苹果酸结合超声处理PPO的失活速率常数(k)。
可通过式(4)、(5)分别计算出半衰期t1/2和10倍减少时间D值。

式中:
t1/2—— 酶失活50% 所需的时间,min;
D——酶失活90%所需时间,min。
1.3.6 数据分析及处理 每个试验重复3次,取平均值。用SAS软件进行显著性分析。
2 结果与分析
2.1 不同浓度苹果酸处理对PPO相对活性的影响
由图1可知,PPO相对活性随着苹果酸浓度的增加逐渐下降,苹果酸浓度低于25 mmol/L时PPO活性变化较小;苹果酸浓度为30,40,50 mmol/L时PPO受到比较明显的抑制。当苹果酸浓度达到60 mmol/L时PPO活性受到强烈抑制。由此可见高浓度的苹果酸对蘑菇PPO的抑制效果比较明显。

图1 不同浓度的苹果酸对PPO相对酶活性的影响Figure 1 Effect of malic acid on relative activity of PPO
于新等[17]研究发现100 mg/L的苹果酸、柠檬酸、酒石酸可有效抑制草菇PPO的活性,李晓莉等[18]报道了0.1 mol/L的L-抗坏血酸、柠檬酸及苹果酸对山药PPO具有抑制作用,但苹果酸的抑制效果比L-抗坏血酸及柠檬酸弱一些。本课题组先前研究[15]发现蘑菇PPO经60 mmol/L的柠檬酸处理后其相对活性仅剩4.3%,这比本研究中60 mmol/L的苹果酸对蘑菇PPO的抑制效果更加明显。由此可见,有机酸对PPO相对活性的影响与PPO的来源、有机酸的种类及浓度有关。
2.2 超声结合苹果酸对PPO活性的影响
由图2可知,PPO经30 min超声处理后其相对活性保持在90%以上,经60 min超声处理后其相对活性仍有81.8%,由此可见单独超声对PPO活性的影响较小,抑制效果不明显;PPO经15 mmol/L苹果酸处理30 min后其相对活性为86.6%,之后随时间的变化比较缓慢,经60 min处理后,抑制效果也不明显。超声结合15 mmol/L苹果酸的处理对PPO活性影响较大,PPO相对活性随处理时间的增长不断下降。处理60 min后其相对活性为40.6%;超声结合20 mmol/L苹果酸对PPO的抑制效果明显;PPO 经25 mmol/L苹果酸处理60 min后,显示出一定的抑制作用,但与超声结合处理60 min后PPO完全失活。超声结合25 mmol/L苹果酸对PPO具有强烈的抑制作用。
单独使用超声或中等浓度(15,20,25 mmol/L)苹果酸对蘑菇PPO的抑制效果均不明显,但超声与苹果酸结合处理则能使PPO活性得到明显的抑制。Cheng等[10]报道超声结合热处理对PPO的抑制效果明显强于单独超声或单独热处理对PPO的抑制作用。Jang等[19]报道利用超声结合抗坏血酸处理苹果鲜切片,其PPO在鲜切片的储藏过程中受到更加显著的抑制。Ba?lar等[16]则报道了超声结合紫外处理对PPO的抑制效果更加明显。超声对PPO具有抑制作用可能是因为声激波产生强大的剪切力破坏了蛋白质多肽链上的氢键及范德华力[20]。
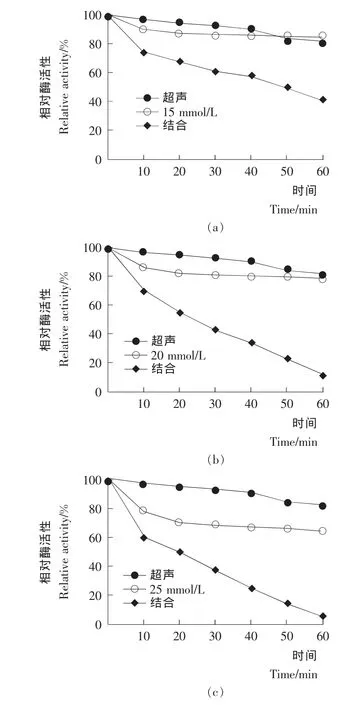
图2 超声结合苹果酸处理对PPO活性的影响Figure 2 Effect of combing ultrasound with malic acid on activity of polyphenol oxidase
2.3 超声结合苹果酸对PPO失活动力学的影响
由图3可知,经超声以及超声结合中等浓度苹果酸处理后的PPO的失活动力学符合一级动力学方程,相关系数R2如表1所示,范围为0.934~0.971。由图3得到各曲线的斜率从而得出失活速率常数(k),进而计算得到超声结合各浓度的苹果酸处理PPO的D值及半衰期t1/2。由表1可知,单独超声处理的PPO的k 值为0.33×10-2min-1,超声与苹果酸结合处理后其失活速率常数随苹果酸浓度的增加而变大,其中25mmol/L的苹果酸所对应的k值达到4.36×10-2min-1,这与单独超声相比具有明显的升高。超声与苹果酸结合处理后PPO的D值明显变小,苹果酸浓度越高D值越小,当苹果酸的浓度为0,25 mmol/L时D 值分为690.9,52.6 min。半衰期t1/2随苹果酸浓度的升高也逐渐变小,当苹 果 酸 的 浓 度 为0,25 mmol/L 时t1/2分 别 为208,15.9 min。
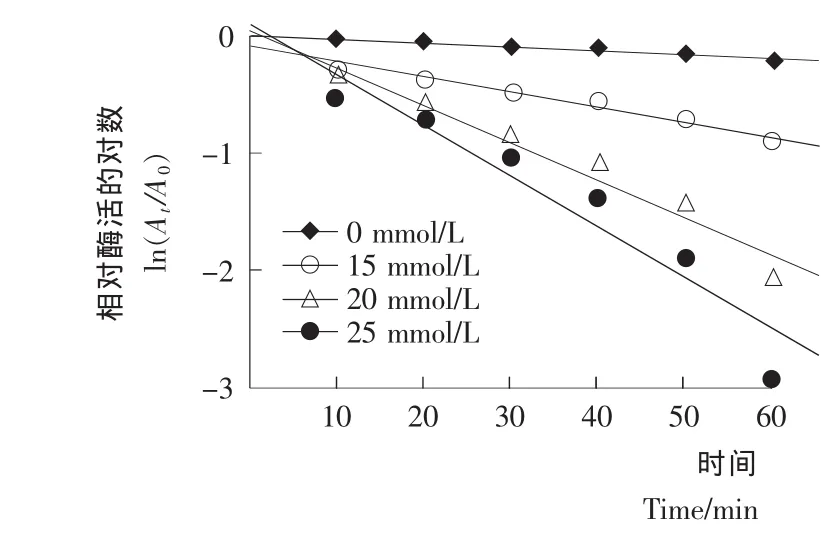
图3 超声结合苹果酸处理PPO的失活曲线Figure 3 Inactivation curve of PPO treated with the combination of malic acid and ultrasound
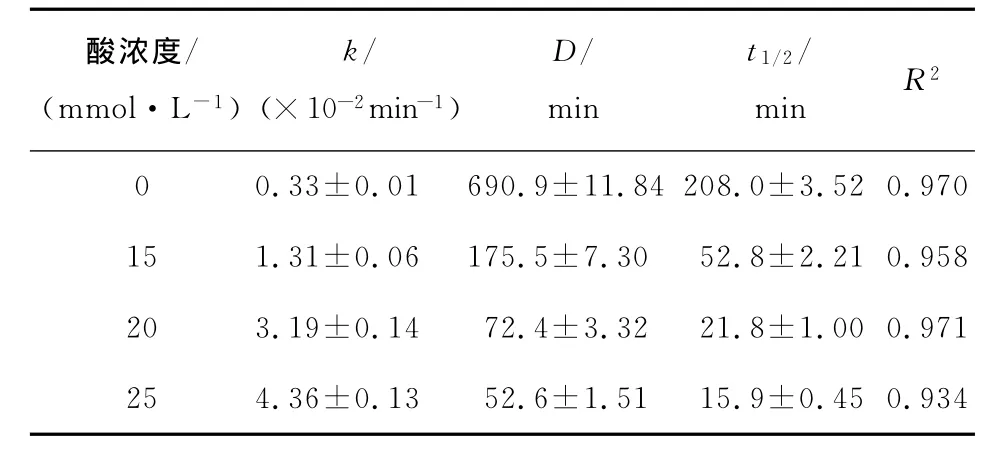
表1 超声结合苹果酸处理PPO的k值、D值、t 1/2Table 1 The value of k、D、t 1/2 of PPO treated with the combination of malic acid and ultrasound
有研究[10]报道超声结合热处理PPO与单独超声或单独热处理相比,其失活速率常数k明显增大,且其k值随热处理温度的升高而变大,D值及半衰期t1/2则随热处理温度的升高而变小,这与本研究结果相似。由此可见,单独超声对PPO的抑制效果较弱,但与其它处理手段相结合可起到明显的抑制效果。
3 结论
随着苹果酸浓度的增加,PPO的相对活性逐渐降低,当苹果酸浓度达到60 mmol/L时,PPO基本完全失活,其酶活性仅为9.1%。单独的超声处理和中等浓度的苹果酸处理对PPO抑制效果并不是很明显。但是超声结合中等浓度的苹果酸处理能够显著的降低PPO酶活性。如分别经单独超声处理、20 mmol/L苹果酸处理和超声结合20 mmol/L苹果酸处理60 min后PPO 活性分别为81.8%,79.7%,12.6%。超声结合中等浓度苹果酸处理PPO失活过程均符合一级动力学方程,且失活速率常数(k)随着酸浓度的增加而增大,当苹果酸浓度分别为0,25 mmol/L时,其失活速率常数 (k)为0.33×10-2,4.36×10-2min-1。同时 D 值、半衰期(t1/2)随着苹果酸浓度增大而变小并且明显低于单独超声处理的PPO,当苹果酸浓度分别为0,25 mmol/L时,其D 和t1/2分别为690.9,208.0 min和52.6,15.9 min。
1 García S C,Buzaleh A M.Polyphenoloxidase:An enzyme widespread in fruits[J].Biochemical Education,1994,22(3):152~153.
2 Dicko M H,Hilhorst R,Gruppen H,et al.Comparison of content in phenolic compounds,polyphenol oxidase,and peroxidase in grains of fifty sorghum varieties from Burkina Faso[J].Journal of Agricultural and Food Chemistry,2002,50(13):3 780~3 788.
3 Zhao Z,Zhu L,Yu S,et al.Partial purification and characterization of polyphenol oxidase from sugarcane(Saccharum officinarum L.)[J].Zuckerindustrie,2011,136(5):296~301.
4 顾林,鲁茂林,姜军,等.山药多酚氧化酶酶学特性及褐变控制研究 [J].食品与机械,2006,22(6):26~29.
5 赵东海,张建平,侯菊花.蘑菇中多酚氧化酶的酶学特性研究[J].食品与机械,2004,20(5):12~13.
6 Gouzi H,Depagne C,Coradin T.Kinetics and thermodynamics of the thermal inactivation of polyphenol oxidase in an aqueous extract from Agaricus bisporus[J].Journal of Agricultural and Food Chemistry,2012,60(1):500~506.
7 Chutintrasri B,Noomhorm A.Thermal inactivation of polyphenoloxidase in pineapple puree[J].LWT-Food Science and Technology,2006,39(5):492~495.
8 Zhong K,Wu J,Wang Z,et al.Inactivation kinetics and secondary structural change of PEF-treated POD and PPO[J].Food Chemistry,2007,100(1):115~123.
9 Yi J,Jiang B,Zhang,et al.Effect of ultrahigh hydrostatic pressure on the activity and structure of mushroom(Agaricus bisporus)polyphenoloxidase[J].Journal of Agricultural and Food Chemistry,2012,60(2):593~599.
10 Cheng X,Zhang M,Adhikari B.The inactivation kinetics of polyphenol oxidase in mushroom(Agaricus bisporus)during thermal and thermosonic treatments[J].Ultrasonics sonochemistry,2013,20(2):674~679.
11 Weemaes C A,Ludikhuyze L R,Van den Broeck I,et al.Kinetics of combined pressure-temperature inactivation of avocado polyphenoloxidase[J].Biotechnology and Bioengineering,1998,60(3):292~300.
12 Chow Y N,Louarme L,Bonazzi C,et al.Apple polyphenoloxidase inactivation during heating in the presence of ascorbic acid and chlorogenic acid[J].Food Chemistry,2011,129(3):761~767.
13 Liu W,Liu J,Xie M,et al.Characterization and high-pressure microfluidization-induced activation of polyphenoloxidase from Chinese pear(Pyrus pyrifolia Nakai)[J].Journal of Agricultural and Food Chemistry,2009,57(12):5 376~5 380.
14 Liu W,Liu J,Liu C,et al.Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J].Innovative Food Science and Emerging Technologies,2009,10(2):142~147.
15 Liu W,Zou L,Liu J,et al.The effect of citric acid on the activity,thermodynamics and conformation of mushroom polyphenoloxidase[J].Food Chemistry,2013,140(1~2):289~295.
16 Ba?lar M,Ertugay M F.The effect of ultrasound and photosonication treatment on polyphenoloxidase (PPO)activity,total phenolic component and colour of apple juice[J].InternationalJournal of Food Science & Technology,2013,48(4):886~892.
17 于 新,冯 彤,李远志,等.食品添加剂对草菇PPO和POD活性的影响[J].食品工业科技,2002,23(5):10~13.
18 李晓莉,沈金玉,黄家音.山药多酚氧化酶特性研究[J].精细化工,2005,22(7):527~529.
19 Jang J H,Kim S T,Moon K D.Inhibitory effects of ultrasound in combination with ascorbic acid on browning and polyphenol oxidase activity of fresh-cut apples[J].Food Science and Biotechnology,2009,18(6):1 417~1 422.
20 Feng H,Barbosa-Caanovas G V,Weiss J,et al.Ultrasound technologies for food and bioprocessing [M].New York:Springer,2011:369~404.

