镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响
刘奋武,高诗颖,王 敏,卜玉山,崔春红,周立祥
(1.山西农业大学资源环境学院,环境工程实验室,山西 太谷 030801;2.南京农业大学资源与环境科学学院环境工程系,江苏 南京 210095;3.湖北大学资源环境学院环境工程系,湖北 武汉 430062)
镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响
刘奋武1,2*,高诗颖1,王 敏3,卜玉山1,崔春红2,周立祥2
(1.山西农业大学资源环境学院,环境工程实验室,山西 太谷 030801;2.南京农业大学资源与环境科学学院环境工程系,江苏 南京 210095;3.湖北大学资源环境学院环境工程系,湖北 武汉 430062)
通过摇瓶实验,在Mg2+分别为48,4.8mg/L,其他元素组成与9K液体培养基一致的体系中,采用氧化亚铁硫杆菌A. ferrooχidans催化合成次生铁矿物.考察了Mg2+含量对生物合成次生铁矿物体系pH值、氧化还原电位(ORP)、Fe2+氧化率、总Fe沉淀率、次生铁矿物矿相及矿物晶体尺寸的影响.结果表明,经过48h培养,Mg2+浓度为48,4.8mg/L生物成矿体系pH值分别从原来的2.50降低至2.30,2.19,ORP分别从初始259mV增加至269mV,276mV.两体系Fe2+氧化率培养至第48h均达到100%,然而两体系总Fe沉淀率及矿物形态及却不尽相同.Mg2+浓度为48mg/L生物成矿体系,总Fe沉淀率为23.7%,次生矿物紧密粘附于三角瓶底部.而Mg2+浓度为4.8mg/L生物成矿体系,总Fe沉淀率达到32.2%,次生矿物却均匀分散于溶液中.两体系合成次生铁矿物均为黄铁矾与施氏矿物共存的混合物,Mg2+含量4.8mg/L体系合成黄铁矾单个晶体长度(~1.60μm)约为Mg2+含量48mg/L体系的1.2倍.
镁离子;氧化亚铁硫杆菌;次生铁矿物;矿相;晶体尺寸
在煤炭的开采过程中,煤层及围岩中以硫铁矿为主的硫化矿物与氧气及水接触,在嗜酸性氧化亚铁硫杆菌(A. ferrooχidans)等微生物生物氧化作用下可形成pH 2.0~6.0,含大量Fe2+、Fe3+、SO42-及多种重(类)金属离子的酸性煤矿废水[1-2].酸性煤矿废水的形成不仅会腐蚀管道、水泵等井下设备,若未经有效处理而任意排放,将严重污染地表水及土地资源,进而危害农作物生长及人体的健康[3].研究证实,在类似酸性煤矿废水等铁离子和硫酸盐丰富的酸性环境中, A.ferrooχidans可促进施氏矿物或黄铁矾类等次生铁矿物的形成,且其对Cr、Cd、Hg、Pb、As等有毒有害元素存在显著的吸附与共沉淀作用[4-5],常被看作为酸性矿山废水重金属的沉淀库[6-7].同时,次生铁矿物的形成过程对去除酸性矿山废水中Fe2+、Fe3+与SO42-同样具有积极意义[8].
由于地下水向矿井不断汇入,及煤炭中含镁矿物(白云石等碳酸盐矿物等)的存在,使得煤炭所处潮湿环境中含有一定量的Mg2+.研究证实,丰富的铁离子与硫酸盐并存的环境中,A. ferrooχidans菌体及其胞外多聚物可以作为次生铁矿物合成的晶种[9].在污水处理领域,常通过加入 Mg2+在微生物胞外多聚物形成架桥使得微生物菌体团聚,进而促进污水处理体系颗粒污泥的形成[10-11].但在次生铁矿物合成体系,Mg2+浓度对矿物合成的影响却鲜见报道.鉴于此,本研究在Mg2+浓度不同,其他元素组成与9K培养基一致的体系中,采用A. ferrooχidans催化合成次生铁矿物,探讨Mg2+含量对体系Fe2+氧化率、总Fe沉淀率、次生铁矿物矿相及矿物晶体尺寸的影响.
1 材料与方法
1.1 嗜酸性氧化亚铁硫杆菌(A. ferrooχidans)菌液的制备
[12]提供的方法,将本实验室保藏的A. ferrooχidans LX5(CGMCC No.0727)接种于150mL改进型 9K 液态培养基(FeSO4·7H2O 44.24g、(NH4)2SO43.0g、KCl 0.10g、K2HPO40.50g、Ca(NO3)2·4H2O 0.01g、MgSO4·7H2O 0.50g,去离子水1L)中,用H2SO4调节pH值至2.5,后将混合液置于180r/min往复式振荡器(ZD-85A恒温振荡器)中,28℃培养 2~3d至体系 Fe2+氧化完全.将培养液经定性滤纸过滤以除去沉淀,过滤所得的液体即为嗜酸性氧化亚铁硫杆菌菌液.将所得菌液15mL接种于135mL改进型9K液态培养基中,重复上述过程 2次后获得的菌液即为本研究后续次生铁矿物合成的接种菌液,其中 A. ferrooχidans LX5密度约为107cells/mL.
1.2 A. ferrooχidans催化合成次生铁矿物试验
分别将15mL的A. ferrooχidans LX5菌液盛放于一系列250mL三角瓶中,(1)加入浓缩10倍的改进型 9K液体培养基(Mg2+浓度为 480mg/L,以MgSO4·7H2O形式加入)15mL,后补充去离子水至溶液总体积为 150mL,即相应体系中 A. ferrooχidans LX5密度分别约为106cells/mL,体系Mg2+浓度为48mg/L(记作“Mg2+-48mg/L”处理);(2)其他试验设计同处理(1),而体系 Mg2+设计浓度为4.8mg/L(记作“Mg2+-4.8mg/L”处理).每个处理设置3个平行.用H2SO4将上述不同体系pH值调至2.50后,将混合液在28℃,150r/min条件下振荡培养,每12h动态监测体系pH值及ORP值,且从体系均匀取样 1mL,过 0.45μm滤膜,测定滤液 Fe2+及总Fe浓度,进而计算Fe2+氧化率及总Fe沉淀率的变化情况.培养 48h后将两体系产生的矿物沉淀用定性滤纸收集,酸化的去离子水(pH 2.0)洗 3次,再用去离子水洗涤 2次后,在 50℃环境中烘干[13],分析矿物的矿相及单个晶体尺寸.
1.3 测定方法
溶液pH值及ORP用PHS-3C型酸度计测定,Fe2+与总Fe浓度测定采用邻菲罗啉比色法[14],利用可见分光光度计(722-E型可见分光光度计)测定.某时刻Fe2+氧化率=(初始体系Fe2+浓度-某时刻体系Fe2+浓度/初始体系Fe2+浓度)×100%.某时刻总Fe沉淀率=(初始体系总Fe浓度-某时刻体系总Fe浓度/初始体系总Fe浓度)×100%.次生铁矿物矿相用 X射线衍射仪(XRD,MiniFles II,日本理学)测定,测试工作条件为∶管电压30kV,管电流 15mA,扫描区间 10~70°(2θ),步长 0.02°,Cu靶(弯晶单色器).次生铁矿物单个晶体尺寸采用热场发射扫描电子显微镜(SEM,JSM-7001F)扫描矿物形貌来分析,加速电压5.0kV,工作距离(样品表面到物镜的距离)9.7mm.
2 结果与讨论
2.1 Mg2+含量对生物合成次生铁矿物体系pH值与ORP的影响
Fe2+生物氧化至Fe3+是一个导致体系pH值升高的过程,而Fe3+水解产生次生铁矿物却是pH值降低的过程[12],具体反应方程式如下∶

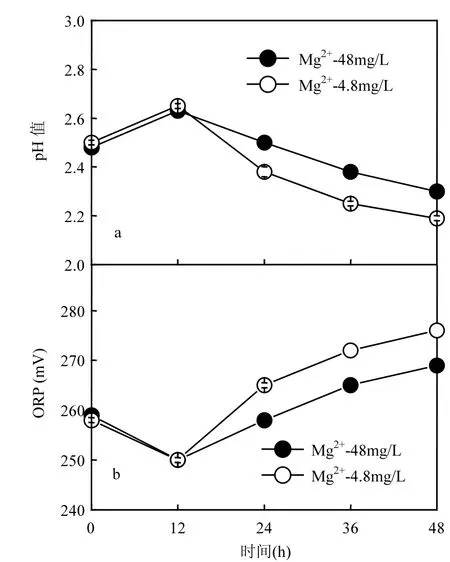
图1 A. ferrooχidans催化合成次生铁矿物体系pH值与ORP的变化Fig.1 Change of pH and ORP during secondary iron minerals catalytic synthesis by A. ferrooχidans
另外,Fe3+与Fe2+浓度的相对高低及体系pH值的变化对体系ORP有着直接的影响[15].由图1可见,“Mg2+-48mg/L”与“Mg2+-4.8mg/L”两处理体系 pH值均呈现先增加后降低的变化趋势,相反,两体系ORP却呈现先降低后增加的变化规律,这一现象与刘晓燕等[16]研究结论相类似.刘晓燕等[16]研究表明,氧化亚铁硫杆菌对 11.39g/L Fe2+氧化过程中,体系pH值首先从原始2.35逐渐增加至2.60,后逐渐降低至2.10.而体系ORP却先由原来的 272mV降低至 258mV,后逐渐升高至288mV.
本研究发现,在前12h内,两体系pH值及ORP的变化规律几乎一致.具体表现在,12h内两体系pH值均从原始的2.50升高至2.65,相应体系ORP均由初始的259mV降低至250mV.而在12~48h培养过程中,两体系pH值与ORP的变化规律不尽相同.“Mg2+-48mg/L”体系中,pH值从12h的2.63逐渐降低至48h的2.30,降低速率为0.009/h.ORP从12h的250mV升高至48h的269mV,升高速率为0.528mV/h.而“Mg2+- 4.8mg/L”体系中,pH值逐渐从12h的2.65降低至48h的2.19,降低速率为0.013/h.ORP却以约0.722mV/h的速率,从12h的 250mV 升高至 48h的 276mV.可见,“Mg2+-4.8mg/L”体系后期(12~48h)pH值的下降速率约为“Mg2+-48mg/L”体系的1.44倍,而ORP升高速率约为Mg2+含量为48mg/L体系的1.37倍.换言之,Mg2+含量降低可在一定程度上加速体系酸化及体系ORP的增加.
2.2 Mg2+含量对生物合成次生铁矿物体系Fe2+氧化率与总Fe沉淀率的影响
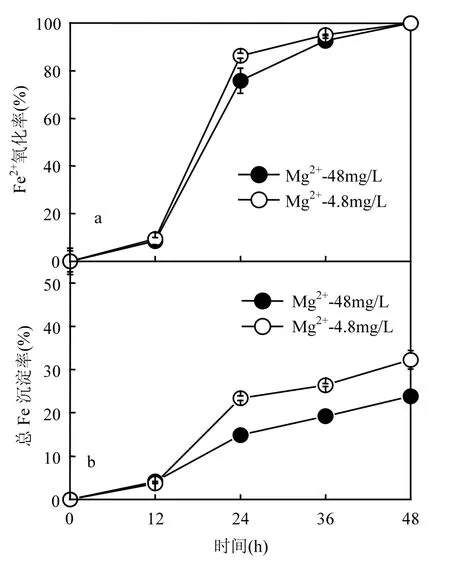
图2 A. ferrooχidans催化合成次生铁矿物体系Fe2+氧化率与总Fe沉淀率变化趋势Fig.2 Fe2+oxidation rate and total Fe precipitation rate during secondary iron minerals catalytic synthesis by A. ferrooχidans
从图2可以发现,与pH值与ORP的变化规律相类似,在前12h内,两体系Fe2+氧化率与总Fe沉淀率的变化规律几乎一致,两体系 Fe2+氧化率均达到8.4%~9.4%的水平,总Fe沉淀率约为0.7%~0.8%.
在12~48h培养过程中,两体系Fe2+氧化率与总 Fe沉淀率变化差异较大.虽然两体系 Fe2+在48h均可被A. ferrooχidans完全氧化,而“Mg2+-48mg/L”体系在24,36h,Fe2+氧化率分别为75.8%与92.5%.而“Mg2+-4.8mg/L”体系在24,36h,Fe2+氧化率分别达到86.3%与95.0%.而就总Fe 沉淀率而言,“Mg2+-48mg/L”体系在24,36,48h,总Fe沉淀率分别达到 14.8%,19.2%,23.8%.而“Mg2+-4.8mg/L”体系在24,36,48h,总Fe 沉淀率却分别达到23.4%,26.4%,32.2%,即在体系Fe2+完全氧化时刻,“Mg2+-4.8mg/L”体系总 Fe 沉淀量较“Mg2+-48mg/L”体系提高了35.3%.
2.3 Mg2+含量对生物合成次生铁矿物形成过程的影响
从图 3可以看出,初始 0h,体系透明,两体系呈现以 Fe2+为主要驱导因素的浅绿色.培养至12h时,两体系透明,颜色为微黄色,间接证实体系部分Fe2+已被氧化为Fe3+(此时两体系系Fe2+氧化率为8.4%~9.4%),体系次生铁矿物形成却并不明显.在第24h,两体系黄色进一步加深,体系浑浊,有明显的矿物产生.
然而,值得注意的是,在“Mg2+-48mg/L”中,初始形成的次生铁矿物紧密的沉淀在三角瓶底部.相反,次生矿物却均匀分散于“Mg2+-4.8mg/L”的培养体系中.在第 36~48h,次生铁矿物在“Mg2+-48mg/L”体系黏附量越来越多,而“Mg2+-4.8mg/L”体系,培养过程中却未见矿物在三角瓶底的黏附现象.将 2体系 48h(Fe2+完全氧化时刻)培养液倾斜静置 1min后,可以观察到在 “Mg2+-4.8mg/L”体系中矿物迅速沉降,上清液呈现橙红色,与“Mg2+-48mg/L”体系上清液颜色一致.而“Mg2+-48mg/L”体系,矿物却紧实黏附于三角瓶底,无法观察到矿物沉降现象.综上所述,前 12h A. ferrooχidans培养过程中,“Mg2+-48mg/L”与“Mg2+-4.8mg/L”2处理体系pH值、ORP、Fe2+氧化率及总Fe沉淀率的变化幅度几乎一致.而在 12~48h,与 Mg2+含量相对较高(48mg/L)的体系相比较,Mg2+含量较低(4.8mg/L)的A. ferrooχidans培养体系,体系pH值降低幅度明显,Fe2+氧化率加快,且体系总Fe沉淀率增加.推测产生这一差异的主要原因在于两体系产生的次生铁矿物形态差异较大所致(图3).

图3 A. ferrooχidans催化合成次生铁矿物过程Fig.3 Picture of secondary iron minerals catalytic synthesis process by A. ferrooχidans
在 Mg2+浓度 较 高达 48mg/L 的 A. ferrooχidans培养体系中,由于 Mg2+可以在 A. ferrooχidan胞外多聚物间进行吸附形成架桥,使得A. ferrooχidans菌体团聚[10-11].A. ferrooχidans菌体团聚过程中,团聚体与体系初始产生的次生铁矿物相互包裹,在水力剪切条件不足的情况下,而共同紧密粘附于三角瓶底部(图3).
生物合成次生铁矿物大致可分为Fe2+氧化为Fe3+,Fe3+水解形成初期矿物晶核及晶核长大3个过程[17].由于初期合成的次生铁矿物可作为次生铁矿物后期合成的晶种[18],故在 Mg2+含量较高的体系,紧密粘附于三角瓶底部的矿物不仅包裹着大量的 A. ferrooχidans菌体,使得体系游离 A. ferrooχidans菌体减少,进而使得体系 Fe2+氧化率降低,同时,由于初期形成矿物在底部的大量粘附,将显著减少后期次生铁矿物合成所需要的晶种,而使得后期矿物合成受阻,进而使得体系总Fe沉淀率降低,相应体系 pH值降低幅度也随之减缓.而在Mg2+浓度仅为4.8mg/L的A. ferrooχidans培养体系体系中,由于A. ferrooχidans菌体团聚现象相对较弱,体系次生矿物可均匀分散于溶液中(图3),A. ferrooχidans菌体与初期合成的次生铁矿物几乎全部游离于溶液体系,进而而加速体系 Fe2+氧化及总Fe的沉淀.
2.4 Mg2+含量对生物合成次生铁矿物矿相的影响
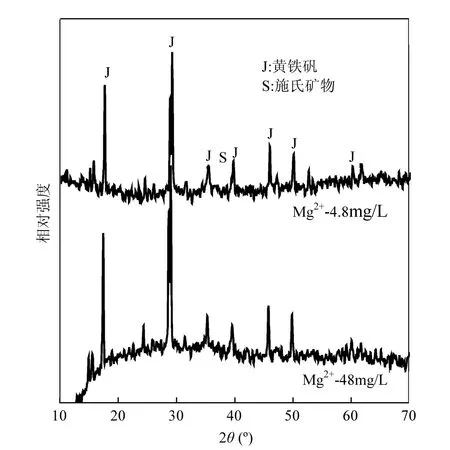
图4 生物合成次生铁矿物体系亚铁完全氧化时(48h)矿物X射线衍射图谱Fig.4 XRD patterns of biogenic secondary iron minerals when ferrous ions complete oxidized at 48h in systems
X射线衍射图谱(XRD)是鉴别矿物种类最有效地手段之一[19].经 Jade5.0软件寻峰分析,参考JCPDS[20]晶形黄铁矾类物质(黄钾铁矾∶ No.22-0827;黄铵铁矾∶No.26-1014;草黄铁矾∶ No.31-0650)与非晶形施氏矿物(No.47-1775)的标准衍射图谱,可以看出,体系产生的次生铁矿物衍射图谱(图4)中主要包含黄铁矾的特征尖锐衍射强峰[21-22]及相对微弱的施氏矿物特征衍射弱宽峰(2θ= 35.16°)[23-24].可以判定2体系产生的次生铁矿物应均为黄铁矾与施氏矿物共存的混合物.
2.5 Mg2+含量对生物合成次生铁矿物形貌的影响
从图5可以看出,两体系均存在结晶较好的“枕状”的晶形矿物与絮状的无定型态非晶形矿物.无定型矿物嵌套于晶形矿物之间,且相对较少.结合图4结果推断,“枕状”晶形矿物为结晶度较好的黄铁矾类物质,而絮状无定型态非晶形矿物应为施氏矿物.Wang等[25]在NH4+浓度为 805mmol/L 体系,利用氧化亚铁硫杆菌合成的黄铁矾形貌亦为与本研究结果相似的“枕状”形貌.
需要指出的是,本研究中“Mg2+-4.8mg/L”体系 Fe2+完全氧化时,黄铁矾单个晶体长度约为1.60μm,而Mg2+为48mg/L的相应体系,所形成的黄铁矾单个晶体长度仅为 1.30μm 左右,即前者约为后者的1.2倍.分析原因,可能由于在Mg2+浓度较高的 A. ferrooχidans培养体系中,由于初期形成矿物在底部的大量黏附,不能作为晶种供后续次生铁矿物在其表面进一步合成长大.而Mg2+浓度相对较低的体系中,由于初期合成的次生铁矿物几乎全部游离于溶液体系,其能够为后续次生铁矿物合成提供良好的模板,进而促进体系矿物尺寸增大.
由此可见,A. ferrooχidans合成次生铁矿物体系Mg2+浓度的降低,有利于体系次生铁矿物在体系分散及矿物大量合成,同时便于后续矿物的收集.然而,由于Mg2+是A. ferrooχidans生长的营养元素,故Mg2+浓度对A. ferrooχidans活性影响及次生铁矿物高效合成的平衡问题是作者后期关注的研究方向之一.

图5 生物合成次生铁矿物体系亚铁完全氧化时(48h)矿物扫描电镜照片Fig.5 SEM of biogenic secondary iron minerals when ferrous ions complete oxidized at 48h in systems
3 结论
3.1 Mg2+浓度对生物合成次生铁矿物体系合成得到矿物的矿相影响不明显,然而却能显著影响次生铁矿物在体系的存在形态.
3.2 在 Mg2+浓度较高的次生铁矿物合成体系中,体系产生的次生矿物越易紧密粘附于反应器底部,而在Mg2+含量较低的次生铁矿物合成体系,合成的矿物却易均匀分散于溶液.
3.3 在 Mg2+浓度较低体系中,前期均匀分散于溶液中次生铁矿物更易作为晶种而便于矿物后期生长,使得合成的次生矿物尺寸要大于Mg2+浓度较高体系中获得的矿物尺寸.同时,Mg2+浓度差异所导致的矿物存在形态不同直接影响次生铁矿物合成体系中pH值、ORP、Fe2+氧化率、总Fe沉淀率等参数的变化.
参考文献:
[1] 杨绍章,吴 攀,张瑞雪,等.有氧垂直折流式反应池处理煤矿酸性废水 [J]. 环境工程学报, 2011,5(4):789-794.
[2] Nicomrat D, Dick W A, Dopson M, et al. Bacterial phylogenetic diversity in a constructed wetland system treating acid coal mine drainage [J]. Soil Biology and Biochemistry, 2008,40(2):312-321.
[3] Lin C X, Long X X, Tong X L, et al. Guangdong Dabaoshan Mine:ecological degradation, acid drainage and possible measures for their Remediation [J]. Ecology Science, 2003,22(3):205-208.
[4] Baron D, Palmer C D. Solid-solution aqueous-solution reactions between jarosite (KFe3(SO4)2(OH)6) and its chromate analog [J]. Geochimica et Cosmochimica Acta, 2002,66(16):2841-2853.
[5] Drouet C, Baron D, Navrostsky A. On the thermochemistry of the solid solution between jarosite and its chromate analog [J]. American Mineralogist, 2003,88(11/12):1949-1954.
[6] 廖岳华,周立祥.极端酸性环境下形成的施威特曼石(schwertmannite)及其环境学意义 [J]. 岩石矿物学杂志, 2007, 26(2):177-183.
[7] Asta M P, Cama J, Martínez M, et al. Arsenic removal by goethite and jarosite in acidic conditions and its environmental implications [J]. Journal of Hazardous Materials, 2009,171(1-3):965-972.
[8] 刘奋武,王 敏,卜玉山,等.酸性硫酸盐环境中菌密度对生物成因次生铁矿物形成的影响 [J]. 环境科学学报, 2013,33(11):3025-3031.
[9] Chan C S, Stasio G D, Welch S A, et al. Microbial polysaccharides template assembly of nanocrystal fibers [J]. Science, 2004,303(5664):1659-1658.
[10] 刘倩倩,李小明,杨 麒,等.Mg2+对SBR中好氧颗粒污泥培养的影响研究 [J]. 中国给水排水, 2008,24(17):31-35.
[11] Othman I, Anuar A N, Ujang Z, et al. Livestock wastewater treatment using aerobic granular sludge [J]. Bioresource Technology, 2013,133:630-634.
[12] Liu F W, Zhou L X, Zhou J, et al. 2012. Improvement of sludge dewaterability and removal of sludge-borne metals by bioleaching at optimum pH [J]. Journal of Hazardous Materials, 221-222,170-177.
[13] 李浙英,梁剑茹,柏双友,等.生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附 [J]. 环境科学学报, 2011,31(3):460-467.
[14] 刘奋武,周立祥,周 俊,等.生物沥浸处理提高城市污泥脱水性能的中试研究:批式运行模式 [J]. 环境科学, 2011,32(7):2023-2029.
[15] 王亚娥,冯娟娟,李 杰.不同 Fe(III)对活性污泥异化铁还原及除磷影响研究 [J]. 中国环境科学, 2013,33(6):993-998.
[16] 刘晓燕,王向东,蒋文举,等.氧化亚铁硫杆菌对亚铁离子的氧化及其动力学研究 [J]. 环境污染与防治, 2005,27(4):244-246.
[17] Sasaki K, Konno H. Morphology of jarosite-group compounds precipitated from biologically and chemically oxidized Fe ions [J]. The Canadian Mineralogist, 2000,38(1):45-56.
[18] 王 敏,梁剑茹,周立祥.晶种和钾离子促进生物成因黄铁矾形成的作用机制 [J]. 南京农业大学学报, 2013,36(2):97-102.
[19] 柏双友,周立祥.微生物接种密度和矿物收集时间对生物沥浸中次生矿物形成的影响 [J]. 微生物学通报, 2011,38(4):487-492.
[20] JCPDS (Joint Committee on Powder Diffraction Standards). Mineral Powder Diffraction Files [Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania. 2002.
[21] 刘新锋,张丽清,周华锋,等.黄铵铁矾的制备及其催化性能 [J].中南大学学报(自然科学版), 2011,42(12):3657-3662.
[22] Wang H M, Bigham J M, Tuovinen O H. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms [J]. Materials Science and Engineering C, 2006,26(4):588-592.
[23] 柏双友,梁剑茹,周立祥.一价阳离子和水溶性有机质对生物沥浸中次生铁矿物形成的影响 [J]. 矿物学报, 2011,33(1):118-125.
[24] Eskandarpour A, Onyango M S, Ochieng A, et al. Removal of fluoride ions from aqueous solution at low pH using schwertmannite [J]. Journal of Hazardous Materials, 2008,152(2):571-519.
[25] Wang H M, Bigham J M, Jones F S, et al. Synthesis and properties of ammoniojarosites prepared with iron-oxidizing acidophilic microorganisms at 22—65℃ [J]. Geochimica et Cosmochimica Acta, 2007,71(1):155-164.
2014年或成最热的一年 科学家预言厄尔尼诺现象
眼下我们还被严寒困扰,不少人已经开始期盼温暖的春天了,不过据英国《每日邮报》2014年 2月11日报道,科学家称2014年人们或许需要早早用上太阳镜等“装备”,因为今年可能会成为有记录以来最热的一年.科学家预言今年发生厄尔尼诺现象的几率高达75%,这种现象会向大气中喷射大量的热量.
厄尔尼诺现象主要指太平洋东部和中部的热带海洋海水温度异常地持续变暖,使整个世界气候模式发生变化,造成一些地区干旱而另一些地区又出现降雨量过多的情况.这种现象往往持续好几个月甚至一年以上,影响范围极广,属于一种准周期气候变化.德国科学家相信他们能提前一年预测厄尔尼诺现象,计算出2014年发生这一现象的几率为75%.他们希望这样的预测能让世界各国制定更好的策略,有效地应对厄尔尼诺现象所带来的负面影响.
在西班牙语中,厄尔尼诺是“小男孩”的意思,科学家通常能在它发生前半年内做出预测.目前科学家通过分析赤道附近东部太平洋的水温,来对厄尔尼诺现象进行预测.但因为水温受到赤道附近风的强烈影响,可做出预测的期限还是只有半年甚至更短.德国吉森市加斯特斯·李比希大学的阿明·邦德和同事不是分析太平洋中某一特定区域的水温,而是勘查太平洋所有区域的大气温度,然后研究厄尔尼诺流域的温度跟太平洋其他区域温度的联系.研究人员表示,他们使用的这一方法正确预言了过去两年不会发生厄尔尼诺现象,而现在他们预测2014年这种现象发生的可能性高达约75%,称2014年由此可能成为有记录的最热一年.
对此有些专家表达了不同的看法.来自加州拉霍亚美国斯克里普斯海洋研究所的气候学家蒂姆·巴尼特评论说,这些德国科学家使用的研究方法已经过时,“研究人员使用的技术让我觉得好像回到了上世纪八九十年代.”也有其他专家认为,邦德等研究人员没有考查海洋和大气的物理学特征,而只是研究了温度的统计学模式.澳大利亚气象局气候预测部门的负责人安德鲁·沃特金斯表示,“2014年下半年厄尔尼诺现象发生的风险会增加,最早或于6月份发生.”
近期,另一项研究发现,由这种异常强烈的厄尔尼诺现象引发的极端天气状况预计可能会加剧.气候科学家警告说,以后每十年很多国家可能就会遭受严重的干旱、野火和洪水灾害.
摘自中国环境网
2014-02-14
Effect of magnesium ions on the formation of secondary iron minerals facilitated by Acidithiobacillus ferrooxidans.
LIU Fen-wu1,2*, GAO Shi-ying1, WANG Min3, BU Yu-shan1, CUI Chun-hong2, ZHOU Li-xiang2
(1.Environmental Engineering Laboratory, College of Resource and Environment, Shanxi Agricultural University, Taigu 030801, China;2.Department of Environmental Engineering, College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;3.Department of Environmental Engineering, Faculty of Resources and Environmental Science Hubei University, Wuhan 430062, China). China Environmental Science, 2014,34(3):713~719
In this study, secondary iron minerals was synthesized by A. ferrooχidans in the solution with 48 or 4.8mg/L magnesium ions and other elements in consistent with 9K liquid medium. pH, oxidation reduction potential, Fe2+oxidation rate, total Fe precipitation rate, secondary iron minerals phase and mineral crystal size in two systems were investigated. pH in the treatment with 48or 4.8mg/L of magnesium ion decreased from 2.50at 0h to 2.30or 2.19at 48h, whereas ORP increased from 259mV to 269mV or 276mV, respectively. Ferrous ions could be completely oxidized by A. ferrooχidans within 48h, secondary iron minerals morphology and total Fe precipitation rate, however, were different in two systems. With 48mg/L of magnesium ion, the total Fe precipitation rate was 23.7% after 48h reaction, while it rose to 32.2% in the presence of 4.8mg/L of magnesium ion. The precipitates formed in the two treatments were a mixture of jarosite and schwertmannite. However, unlike the precipitates closely adhered to the flask bottom in the treatment with 48mg/L of magnesium ion, the precipitates formed in the presence of 4.8mg/L of magnesium ion uniformly dispersed in the solution, and the crystal length (~1.60µm) of jarosite was 1.2times larger than it in the former.
magnesium ions;A. ferrooχidans;secondary iron minerals;mineral phase;crystal size
X703
:A
:1000-6923(2014)03-0713-07
刘奋武(1984-),男,山西大同人,讲师,博士,主要从事固体废弃物处理、处置与资源化,酸性矿山废水治理等方面的研究.发表论文20余篇.
2013-07-08
国家自然科学基金项目(40930738,21277071);山西农业大学博士科研启动基金项目(2012YJ06);山西农业大学科技创新基金项目(201301)
* 责任作者, 讲师, lfwlfw2008@sina.com

