化学反应中的质量“不守恒”现象
2014-04-29 00:44李瑞臣
初中生学习·低 2014年11期
李瑞臣
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这就是质量守恒定律。质量守恒定律是一个普遍规律,应用于一切化学反应,但在很多情况下,我们所看到的现象却不是这样,这就需要我们分析一下出现不守恒现象的原因。
一、质量增多了
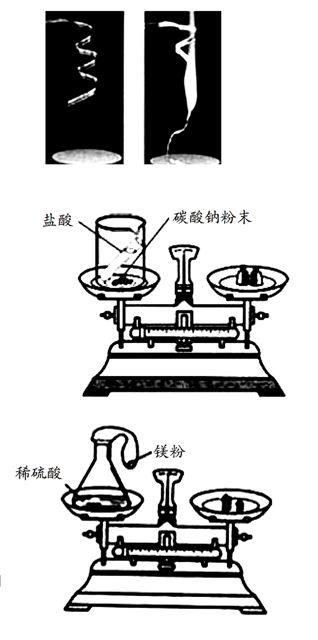
如下图:镁条的燃烧。
通过称量发现:反应后生成的白色固体的质量比反应前镁条的质量增加了,这是因为根据质量守恒定律,反应后氧化镁的质量等于参加反应的镁条的质量与参加反应的氧气的质量之和。铁生锈等缓慢氧化也属于这种现象。
二、质量减轻了
如下图:盐酸与碳酸钠粉末反应前后质量的测定。
通过称量发现:反应后烧杯中物质的总质量小于反应前物质的总质量,这是因为根据质量守恒定律,反应前物质的总质量等于反应后烧杯中物质和逸出的二氧化碳质量之和。因此,用这样的实验验证质量守恒定律时,必须在密闭仪器内进行。
三、其他影响
某课外研究性学习小组用如下图所示的装置做实验,瓶内放了足量的硫酸,可充气的气球内放有一定量的镁粉,将它紧紧套在瓶口上,放在托盘天平上称量,质量为W1,然后将气球内的镁粉全部倒入瓶内,立即产生气体,气球逐渐胀大,充分反应后最终再次称量,质量为W2,结果W1>W2。
此反应符合质量守恒定律,但天平显示W1>W2的原因是(装置不漏气)氢气球受到浮力的作用。
人教版化学九年级上册第五单元《化学方程式》课内知识拓展
猜你喜欢
冶金动力(2023年6期)2023-12-21
小学生学习指导·中年级(2022年2期)2022-02-14
阅读(科学探秘)(2021年5期)2021-08-04
发明与创新(2018年2期)2018-05-25
草原歌声(2017年3期)2017-04-23
发明与创新(2016年18期)2016-12-23
发明与创新·中学生(2016年5期)2016-05-14
中国医药指南(2014年33期)2014-03-27
环球时报(2014-03-07)2014-03-07
化学教与学(2011年12期)2011-07-19