氟吡菌胺对斑马鱼的毒性效应
林 琎,王红艳,王开运*,范维娣,许 辉,刘 杰(1.山东农业大学植物保护学院,山东 泰安71018;.山东农业大学农药环境毒理研究中心,山东 泰安 71018;.山东棉花研究中心,山东 济南 50100;.山东省联合农药工业有限公司,山东 济南 50100)
氟吡菌胺对斑马鱼的毒性效应
林 琎1,2,王红艳3,王开运1,2*,范维娣2,许 辉4,刘 杰4(1.山东农业大学植物保护学院,山东 泰安271018;2.山东农业大学农药环境毒理研究中心,山东 泰安 271018;3.山东棉花研究中心,山东 济南 250100;4.山东省联合农药工业有限公司,山东 济南 250100)
采用斑马鱼胚胎发育技术和传统毒理学方法, 研究了氟吡菌胺对斑马鱼胚胎、成鱼及仔鱼的毒性效应.结果发现,氟吡菌胺对3个阶段斑马鱼均具有致死能力,对仔鱼LC50(48h)值为0.204mg/L,成鱼LC50(96h)为0.286mg/L,幼鱼LC50(96h)为1.489mg/L.研究表明,0.0596mg/L以上浓度的氟吡菌胺对斑马鱼胚胎均有一定程度的致死效应,高浓度处理组胚胎出现心包囊肿、卵黄囊不吸收、黑色素沉积少及鱼体弯曲等症状;氟吡菌胺对斑马鱼成鱼进行14d暴露后,处理组成鱼体重下降,产卵量减少,有效卵量降低; 0.0298mg/L处理组144h子代仔鱼存活率虽然比较高,但存活鱼大部分出现心包囊肿、体弯曲等畸形.上述结果说明,水体中残留的氟吡菌胺对于斑马鱼各生命阶段的生长发育均具有潜在的危害.
氟吡菌胺;斑马鱼;胚胎;成鱼;急性毒性
氟吡菌胺(fluopicolide)化学名称为 2,6-二氯-N-[(3-氯-5-三氟甲基-2-吡啶基)甲基]苯甲酰胺[1],是德国拜耳公司开发的一种新型苯甲酰胺类内吸性杀菌剂,对各种作物的霜霉病、晚疫病、疫病等均有良好的防治效果,其主要作用于细胞膜和细胞间的特异性蛋白,对病原菌的各主要形态均有很好的抑制活性[2-3].拜耳公司用氟吡菌胺和强内吸传导性杀菌剂霜霉威盐酸盐复配成商品制剂银法利,因其见效快和耐雨水冲刷的特点赢得许多农民的喜爱,自2006年在中国上市以来,在番茄、辣椒、马铃薯、西瓜、黄瓜、葡萄、烟草上均有使用报道[4-7].住友化学美国分公司生产的氟吡菌胺已经登记用于水果、蔬菜和田间作物,以及草皮和观赏植物等非作物使用.美国环保署也已经对氟吡菌胺启动公开审议,预计氟吡菌胺的审议在 2021年完成[8]. 氟吡菌胺对哺乳动物毒性为:大鼠急性经口、经皮 LD50> 5000mg/kg,对兔皮肤无刺激性,兔眼睛有轻度刺激性,豚鼠皮肤无致敏性,对兔、大鼠无潜在致畸性,对大鼠无致癌作用;氟吡菌胺对环境生物急性毒性为:山齿鹑急性经口 LD50>2250mg/kg,鸭急性 经 口 LD50>2250mg/kg,虹 鳟 鱼 LC50= 0.36mg/L(96h),蓝鳃太阳鱼LC50=0.75mg/L(96h),大型溞 EC50>1.8mg/L(48h),水藻 EC50>4.3mg/L (72h), 蚯蚓 LC50>1000mg/kg(14d),蜜蜂触杀LD50>100mg/只[9];综上所述,氟吡菌胺对蜜蜂、鸟和水藻的急性毒性均为低毒,对大型溞为中毒,而对两种鱼的急性毒性则为高毒.目前,氟吡菌胺对水生生物的研究主要集中在急性毒性方面,其对鱼类繁殖和生长发育的影响尚未见报道.本实验采用EPA和国际OECD认可的测定单一化学物毒性实验用鱼——斑马鱼为试验材料[10-12],观察研究了氟吡菌胺对斑马鱼成鱼、胚胎及仔鱼生长发育的影响,以期为氟吡菌胺的水生生物毒理实验研究及其安全使用提供参考.
1 材料与方法
1.1 仪器与试剂
BM2100数码生物显微镜,PQX-330A-3H人工气候箱,孵化器, 5L玻璃水族箱,曝气装置,微量移液枪.
96%氟吡菌胺(CAS号:239110-15-7)由山东农业大学农药环境毒理研究中心提供,氟吡菌胺用宁乳-34和黄原胶助溶后,用超纯水配制成1000mg/L储备液备用,本实验使用的助溶剂浓度不高于0.1mg/L,实验用水为实验室制备的超纯水.
1.2 受试生物
野生型斑马鱼成鱼和 3个月大的幼鱼均购自泰安市于氏水族馆.斑马鱼成鱼雌鱼抽检体长为(4.32±0.026)cm,体重为(0.749±0.0491)g,雄鱼抽 检 体 长 (4.61±0.031)cm,体 重 为 (0.614± 0.0615)g,3个月大的幼鱼抽检体长为(2.08± 0.12)cm,体重为(0.060±0.012)g;斑马鱼成鱼购入后雌雄分开饲养在超纯水中,水中溶解氧大于5.8mg/L,用加热棒和光照恒温箱控制温度为28℃,光周期为 14h:10h(昼/夜).每日早晚各喂食一次经紫外消毒处理过的红线虫或孵化后的丰年虾幼体,每次喂食5min后将剩余的饵料和粪便及时吸出,每日换水 1/3.繁殖前一天晚上将雌雄斑马鱼(雌雄斑马鱼数量比约为1:2)鱼缸靠近,次日凌晨合缸,在鱼缸底部放置隔离网,以防斑马鱼自食其卵,给光让其产卵受精.利用虹吸法收集鱼卵,用超纯水迅速清洗受精卵以除去其间混有的杂质和污物,剔除受损受精卵或未受精卵,选取卵裂期的受精卵供试.将清洗过的正常受精卵分为两部分:一部分用作胚胎实验;另一部分放在28℃人工气候箱中孵化,待仔鱼游泳平衡后用于仔鱼暴露实验.斑马鱼成鱼和幼鱼试验前在实验室内水簇箱中驯养至少 7d,温度 24~28℃,试验前1d不喂食.
1.3 试验方法
1.3.1 三个阶段斑马鱼急性毒性试验 对斑马鱼成鱼、3个月大幼鱼的急性毒性试验依据OECD203标准方法[13]进行,根据预实验结果,分别设定试验浓度,幼鱼为 1.00,1.20,1.40,1.60, 1.80mg/L,成 鱼 为 0.0596,0.121,0.246,0.499, 1.012mg/L,每个试验浓度重复3次,在5L的烧杯中,放入4L的药液和10条鱼.对刚具有平衡能力的仔鱼,其急性毒性试验使用静水法生物测试进行了稍加修改.试验浓度为 0.120,0.150,0.188, 0.234,0.293mg/L,每个浓度重复3次,在100mL的烧杯中装入50mL供试药液和10条仔鱼.
幼鱼和成鱼试验持续暴露 96h,仔鱼试验暴露 48h,做最高浓度相应的溶剂对照和空白对照.试验药液每24h更新一次,以保持药剂浓度.人工气候培养箱中培养温度为(28±1)℃;湿度:70%;光照周期:14h:10h.每24h观察一次成鱼和幼鱼的行为反应,随时记录成鱼和幼鱼的死亡数和中毒症状,判断死亡的标准是用玻璃棒碰触其尾部无明显运动.仔鱼的中毒症状每24h用显微镜观察一次,判断死亡的标准是没有心跳,在急性毒性试验过程中,均不喂食,死亡个体立即清除.
1.3.2 胚胎体外直接染毒 按照 OECD212[14]方法,设计胚胎毒性试验.在预实验基础上,设计了 9个测试浓度,分别为 0.0149,0.0298,0.0596, 0.149,0.298,0.350,0.595,1.012,1.720mg/L.胚胎受精后约1h转移到盛有2mL试验药液的24孔板中,每孔加入一枚受精卵.以超纯水作为空白对照,并设最高浓度相对应的溶剂对照.每个试验浓度20枚卵.试验药液每24h更新一次,以保持氟吡菌胺的浓度.观察 24h胚胎自主运动, 检查 48h、72h、96h胚胎的心跳速率和72h孵化数,120h仔鱼体长.每24h通过显微镜观察胚胎形态并拍照. 1.3.3 成鱼短期重复浓度试验 根据 OECD204准则[15],稍作修改,进行成鱼短期重复浓度试验,即连续14d进行氟吡菌胺暴露试验,其染毒浓度为 0.0149,0.0298,0.0596,0.149,0.298mg/L,为减少加药过程对斑马鱼的影响,采用静态方式染毒.并设空白对照和最高浓度的溶剂对照.试验用成年斑马鱼随机分组,将10条雌鱼和10条雄鱼分别称重后放入5个不同浓度药剂,染毒14d,染毒期间每天早晚各喂食1次;染毒结束后,将剩余存活亲鱼称重后,将1条雌鱼和1条雄鱼转入盛有5L清水的孵化器中,孵化器底部有纱网隔离,给光刺激每一对单独产卵,产卵结束后取出亲鱼,检查每对亲鱼的产卵量,24h检查无效卵量,72h检查孵化数, 144h检查子代斑马鱼的存活数和畸形数.
1.4 试验浓度检测分析
在对斑马鱼成鱼和幼鱼的急性毒性试验过程中,依次在试验第0h和96h时对试验每组浓度的1个平行样进行质量浓度分析,重复2次.取氟吡菌胺水样40mL于150mL分液漏斗中,用15mL二氯甲烷萃取3次,合并有机相45mL于圆底烧瓶中,38℃减压浓缩至干,再用20mL甲醇溶解,进行液相分析.
液相分析条件参考张小军的方法[16]:安捷伦1200HPLC,色 谱 柱 Agilent Zorbaysb-C18 (4.6mm×150mm×5µm),紫外检测器,流动相为甲醇:水=75:25;流速1.0mL/min,检测波长265nm;进样体积20µL.
1.5 数据处理
数据采用寇氏法分析,分别计算氟吡菌胺对斑马鱼 3个阶段的急性毒性⁃半致死浓度 LC50值及其95%置信区间.
用DPS V13.5统计分析软件进行ANOVA分析,将试验数据进行统计分析.本文毒性数据均表示为:与空白对照组相比,所得试验结果呈显著性差异(P<0.05*)或极显著差异(P<0.01**).
2 结果与讨论
2.1 试验液质量浓度分析结果
斑马鱼成鱼和幼鱼的急性毒性试验过程中,各浓度暴露液实际质量浓度与理论质量浓度比较结果见表1.氟吡菌胺保留时间为7.017min.由表 1可知,试验过程中氟吡菌胺的实际质量浓度与试验设计理论浓度误差范围均在 80%~120%内(表1),符合OECD203试验准则有关质量浓度要求,因此本研究中氟吡菌胺的暴露液质量浓度数据可采用理论设计浓度.
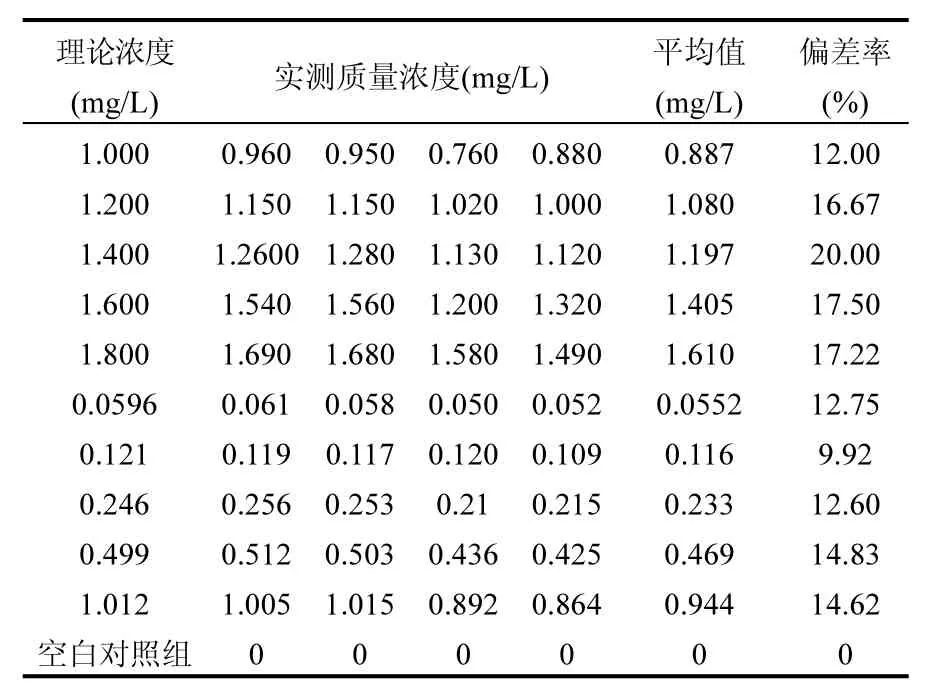
表1 氟吡菌胺质量浓度检测分析Table 1 The concentration detection and analysis of fluopicolide in test
2.2 三个阶段斑马鱼急性毒性结果
在氟吡菌胺对 3个阶段斑马鱼的急性毒性试验过程中,空白对照及助剂对照受试鱼在试验期间未出现死亡,各项体征正常.氟吡菌胺对3个阶段的斑马鱼均有致死效应(表2),仔鱼LC50(48h)值为0.204mg/L,成鱼LC50(96h)为0.286mg/L,幼鱼LC50(96h)为1.489mg/L,表明氟吡菌胺对仔鱼和成鱼毒性高于对幼鱼的毒性.换而言之,对氟吡菌胺,仔鱼最敏感,成鱼次之,幼鱼最不敏感.

表2 氟吡菌胺对3个阶段斑马鱼急性毒性结果Table 2 The acute-toxicity result of fluopicolide to three stages zebrafish
3个阶段斑马鱼对氟吡菌胺呈现出相似中毒症状:低浓度药剂暴露期间,鱼侧翻肚皮在水面游动,鱼肚发白.中高浓度药剂暴露开始时,即出现快速游动,上下旋转游动,表现异常兴奋,4h即侧翻游,12h后静止不游动,玻棒碰触尾部仍可迅速游开;最后出现鱼体下沉、游动减弱等,最终死亡.
本试验得出,氟吡菌胺对斑马鱼幼鱼LC50(96h)值为 1.489mg/L,按照化学农药环境安全评价试验准则划分的毒性等级,其对鱼类急性毒性为中毒;而 EPA数值显示:氟吡菌胺对虹鳟鱼LC50(96h)值为0.36mg/L,对鱼类急性毒性结果为高毒[17].因在毒性评价试验中所用鱼的种类不同,本试验的LC50(96h)值是EPA数值的4.1倍,毒性等级也不同.因此,在农药对环境安全评价过程中,不但要考虑农药本身的成份和乳化剂等,还要考虑评价用鱼种类的不同导致的结果差异性.
2.2 氟吡菌胺对斑马鱼胚胎的致死毒性效应
斑马鱼胚胎暴露在含氟吡菌胺的水环境中,胚胎出现死亡,表现为48h卵凝结、72h已成形但无法从卵壳中脱出且无心跳、胚胎趋于死亡或者已经死亡,对不同浓度氟吡菌胺引起的斑马鱼致死效应的统计结果见图1.
由图1可知,在氟吡菌胺作用下,斑马鱼胚胎的死亡率随其浓度的增大而增强, 0.0596mg/L以上浓度的氟吡菌胺对斑马鱼胚胎均有一定程度的致死效应;当氟吡菌胺浓度高于 0.35mg/L时,胚胎的死亡率明显增大,浓度达1.72mg/L时,72h可导致一半以上的受试胚胎死亡,至96h受试胚胎全部死亡.
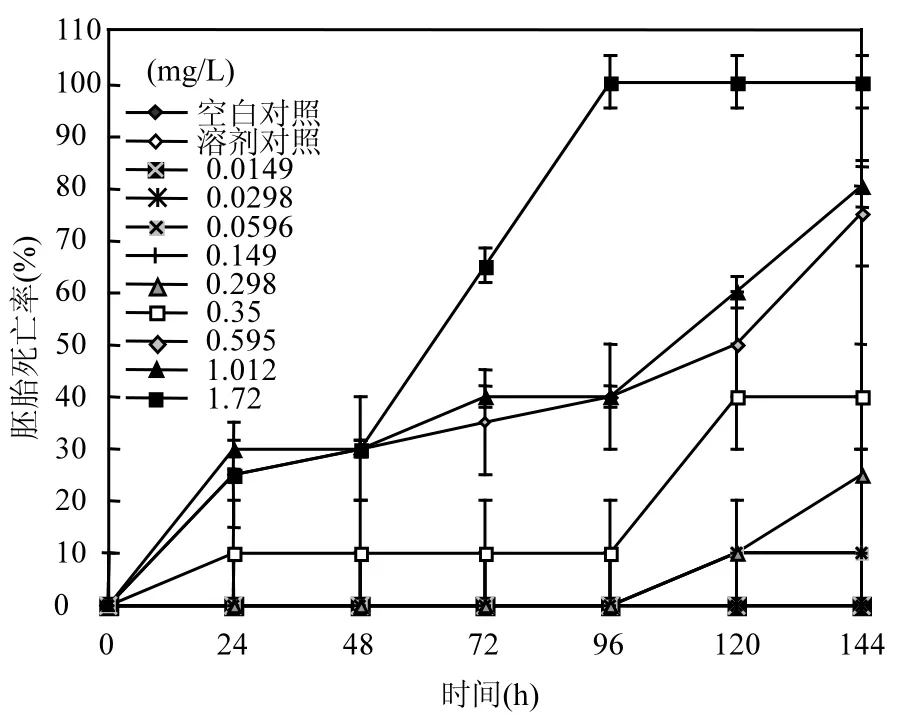
图1 氟吡菌胺对斑马鱼胚胎的死亡率Fig.1 The Lethal toxicity of Fluopicolide to zebrafish embryo
2.3 氟吡菌胺对斑马鱼胚胎的非致死毒性效应
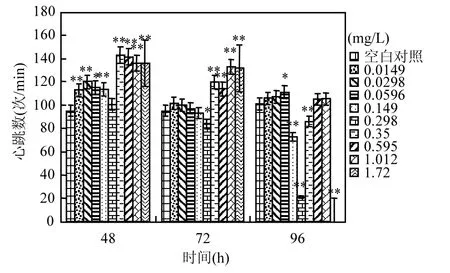
图2 氟吡菌胺对斑马鱼胚胎心跳数的影响Fig.2 Effects of Fluopicolide to zebrafish embryo heartbeats
将斑马鱼胚胎在系列浓度氟吡菌胺中暴露48h时,空白对照胚胎有自主运动,平均心跳数在(95±1.7)次/min,同期所有浓度氟吡菌胺处理的胚胎心跳均比对照快,暴露72h和96h时,处理胚胎心跳减慢,但仍比对照胚胎心跳快(图 2);96h时,0.149mg/L以上浓度氟吡菌胺处理胚胎所孵化仔鱼均出现心跳无规律、忽快忽慢的症状.
72h时,对照胚胎全部孵化,仔鱼体表黑色素比较密集,0.35mg/L浓度氟吡菌胺处理的胚胎孵化率为85.71%,1.720mg/L浓度氟吡菌胺处理的胚胎均未孵化出壳,但可见已成鱼形,且均表现出明显的心包囊肿;且经氟吡菌胺处理的胚胎所孵化出的仔鱼体表黑色素均比较稀少(图3).

图3 72h仔鱼Fig.3 The zebrafish larvae at 72h
96h时,0.298mg/L及以下浓度氟吡菌胺处理的胚胎全部孵化,但均有轻微的心包囊肿和卵黄囊不吸收,0.35mg/L以上浓度氟吡菌胺处理后孵化出的仔鱼均出现明显心包囊肿和卵黄囊不吸收,且仔鱼体表黑色素仍然比对照稀少(图4).

图4 96h仔鱼Fig.4 The zebrafish larvae at 96h
120h时,0.0596mg/L及以下浓度的氟吡菌胺处理的胚胎孵化出的仔鱼未出现心包囊肿的症状,且孵化出的仔鱼平均体长都比对照长; 0.149mg/L及以上浓度的氟吡菌胺处理的胚胎孵化出的仔鱼均出现不同程度的心包囊肿、卵黄囊不吸收和脊柱弯曲等症状,且孵化出的仔鱼平均体长都比对照短(图5).表明低浓度氟吡菌胺可促进斑马鱼体长增加,但高浓度氟吡菌胺可造成仔鱼出现心包囊肿等症状,最终导致处理仔鱼体长比对照仔鱼短.
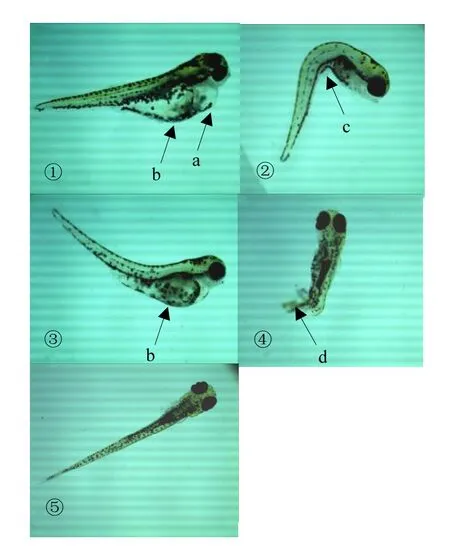
图5 120h仔鱼Fig.5 The treated zebrafish larvae at 120h
在斑马鱼胚胎暴露试验中,可将72h孵化抑制率和120h心包囊肿作为氟吡菌胺的毒理学终点;本试验中,72h孵化抑制率达到 100%的最低浓度为 1.720mg/L,120h时出现全致畸效应的最低浓度为0.149mg/L.
120h时将氟吡菌胺处理胚胎后存活仔鱼放入清水中进行恢复,低浓度无中毒症状的仔鱼均可正常生存,高浓度有中毒症状的仔鱼其症状不可消除,且心跳减缓,144h后均死亡.
美国EPA数据库中显示氟吡菌胺的生物富集系数为 121,属于中等富集性农药[18],因该药剂主要施用于蔬菜和水果,具有强内吸性,在施用过程中,不仅通过内吸进入植株,而且还可通过各种农耕措施和雨水冲刷流入水体,导致水体污染.目前,国内对该药的残留尚无报道,欧盟及韩国、日本2011年时规定氟吡菌胺最大残留限量,其范围在 0.01~0.3mg/kg之间[19],而本研究结果表明,0.0298mg/L的氟吡菌胺处理胚胎后,其孵化的仔鱼心跳数比对照快,孵化出的仔鱼体长也比对照长,说明该浓度氟吡菌胺已经影响了斑马鱼心脏发育和仔鱼体长.斑马鱼属于脊椎动物,与人类基因的保守度高达85%[20],考虑到人类及脊椎动物的健康,应当加强对氟吡菌胺施用后相邻水体的残留检测,并注意在水系统相邻的作物生产区域慎用该农药.
2.4 氟吡菌胺对斑马鱼成鱼的毒性效应
斑马鱼成鱼暴露在不同浓度的氟吡菌胺药液中14d后,对照组雌鱼和雄鱼平均体重分别增加0.1140g和0.0952g,处理组雌鱼和雄鱼平均体重均有减少,其中0.0298mg/L浓度处理的雌鱼和雄鱼体重减少最多,减少量分别达到原体重的38.36%和38.31%(图6);
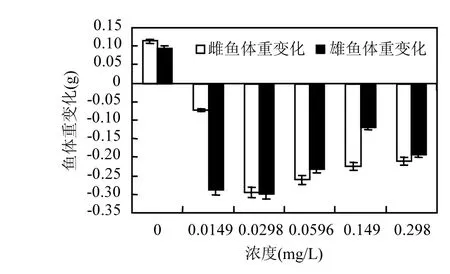
图6 氟吡菌胺对斑马鱼成鱼14d后体重的影响Fig.6 Effects of fluopicolide to the adult zebrafish body weight
暴露 14d后,处理组雌鱼和雄鱼均有死亡个体,死亡数与浓度成正比,且雄鱼死亡数均高于雌鱼(图 7),说明氟吡菌胺对雄鱼毒性高于雌鱼.对照组成鱼平均产卵量(246.3±16.1)个/对,有效卵率为95.60%,72h有效卵孵化率为100%,144h子代仔鱼全部存活,无畸形.处理组成鱼平均每对产卵量均低于对照组,无效卵量多,72h有效卵孵化率低,0.0298mg/L处理组144h子代仔鱼存活率虽然比较高,但存活鱼也大部分出现心包囊肿、体弯曲等畸形(表3).
在氟吡菌胺对斑马鱼成鱼短期重复浓度试验和胚胎体外直接染毒试验结果中,仔鱼均出现心包囊肿和卵黄囊不吸收,这是氟吡菌胺所致典型症状,可作为其毒性学观察终点.
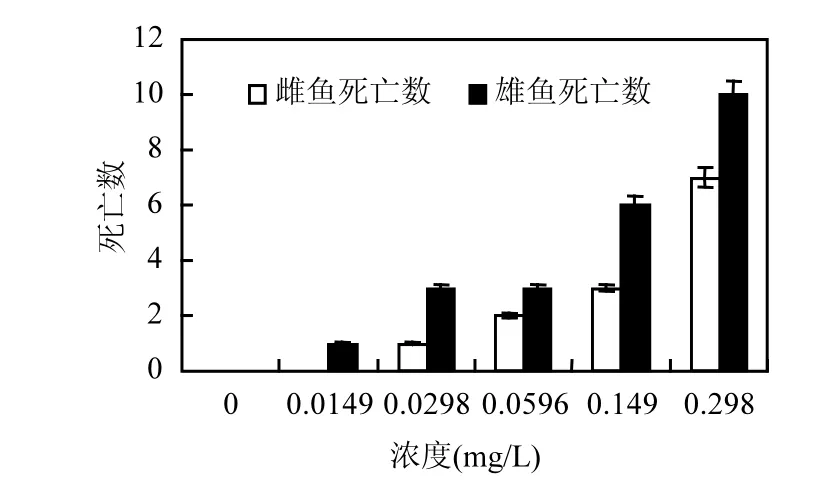
图7 氟吡菌胺对斑马鱼成鱼死亡数的影响Fig.7 Effects of Fluopicolide to the adult zebrafish mortality
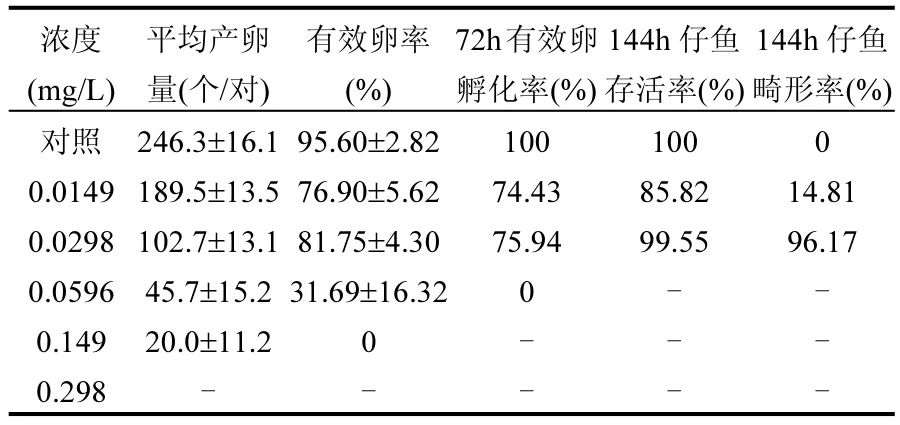
表3 氟吡菌胺对斑马鱼成鱼的繁殖毒性Table 3 The reproductive toxicity of fluopicolide to the adult zebrafish
在成鱼试验中, 0.0298mg/L浓度氟吡菌胺处理的雌鱼和雄鱼体重减少最多,14d后亲鱼即出现3雄1雌的死亡,且有效卵率和有效卵孵化率也比对照低.由此可知,氟吡菌胺在水体中浓度超过0.0298mg/L时,即会对斑马鱼胚胎、仔鱼的生长发育及成鱼的繁殖造成影响.因此,建议其在近鱼类养殖区附近的水体中最大残留限量不要超过0.0298mg/L,约为欧盟等规定残留限量范围最大值的1/10.
3 结论
3.1 氟吡菌胺对斑马鱼仔鱼、成鱼及幼鱼3个阶段斑马鱼急性毒性结果为,对仔鱼LC50(48h)值为0.204mg/L,成鱼LC50(96h)为0.286mg/L,幼鱼LC50(96h)为1.489mg/L.
3.2 当氟吡菌胺浓度达1.72mg/L时,72h可导致一半以上的受试胚胎死亡,96h受试胚胎全部死亡;氟吡菌胺处理斑马鱼胚胎后,出现了心包囊肿、心跳无规律、忽快忽慢、卵黄囊不吸收、黑色素沉积少及鱼体弯曲等症状;其中,心包囊肿和卵黄囊不吸收是其典型症状,可作为其毒理学观察终点.
3.3 氟吡菌胺对斑马鱼雄鱼毒性高于雌鱼.氟吡菌胺对斑马鱼成鱼进行14d暴露后,成鱼体重下降,产卵量减少,有效卵量降低;子代仔鱼存活率下降,且存活子代仔鱼大部分出现心包囊肿、体弯曲等畸形.
3.4 氟吡菌胺在水体中浓度超过0.0298mg/L时,即会对斑马鱼胚胎、仔鱼的生长发育及成鱼的繁殖造成影响.建议其在近鱼类养殖区附近的水体中最大残留限量不要超过0.0298mg/L.
[1] 张小军,张宗俭,刘尚钟,等.氟吡菌胺原药的高效液相色谱分析[J]. 农药, 2011,50(9):661-662.
[2] 闫 磊,王文桥,孟润杰,等.氟吡菌胺与吡唑醚菌酯混合物对黄瓜霜霉病菌的毒力增效及其抗药性的影响 [J]. 农药, 2013, 52(1):53-56.
[3] 朱卫刚,胡伟群,张蕊蕊,等.新型杀菌剂氟吡菌胺室内杀菌活性[J]. 农药, 2012,51(12):922-923.
[4] 刘春艳,郝永娟,王 勇,等.氟吡菌胺·霜霉威(银法利)悬浮剂对番茄晚疫病和黄瓜霜霉病的防治效果 [J]. 中国蔬菜, 2008(1): 26-27.
[5] 欧阳水平,唐常胜,陈诗亮.银法利悬浮剂防治辣椒疫病田间药效试验 [J]. 河北农业科学, 2007,11(6):26-27,35.
[6] 马光恕,徐晓东,廉 华,等.银法利对马铃薯晚疫病的防治效果研究 [J]. 安徽农业科学, 2010,38(13):6745-6746,6749.
[7] 李德建.银法利--拜耳全新蔬菜杀菌剂 [J]. 中国农药, 2006(4): 54.
[8] 段丽芳(译).美国环保署启动更多农药审议 [J]. 农药科学与管理, 2013,34(7):11.
[9] 李 淼,李 洋,杨 浩,等.防治卵菌纲病害的新型杀菌剂氟啶酰菌胺 [J]. 农药, 2006,45(8):556-557.
[10] 杜青平,刘伍香,袁保红,等.1,2,4-三氯苯对斑马鱼生殖和胚胎发育毒性效应 [J]. 中国环境科学, 2012,32(4):736-741.
[11] 李志斐,谢 骏,龚望宝,等.三甲基氯化锡对水生生物的毒性效应 [J]. 中国环境科学, 2011,31(4):642-646.
[12] 朱 琳,史淑洁.斑马鱼胚胎发育技术在毒性评价中的应用 [J].应用生态学报, 2002,13(2):252-254.
[13] OECD. OECD guidelines for the testing of chemicals. [C]//Section 2:Effects on biotic systems test No 203:Acute toxicity for fish. Paris, France: Organization for Economic Cooperation and Development, 1992.
[14] OECD. OECD Guidelines for the testing of hemicals. [C]//No. 212: Fish, short-term toxicity test on embryo and sac-fry stages, Paris, France: Organization for Economic Cooperation and Development, 1998.
[15] OECD. OECD guidelines for the testing chemicals. [C]//No. 204: fish, prolonged toxicity test: 14-day study. Paris, France: Organization for Economic Cooperation and Development, 1984.
[16] 张小军,张宗俭,刘尚钟,等.氟吡菌胺原药的高效液相色谱分析[J]. 农药, 2011,50(9):661-662.
[17] http://sitem.herts.ac.uk/aeru/iupac/index.htm [EB/Z]. global availability of information on agrochemicals, Pesticide Properties Database, 2007.
[18] 蔡道基,杨佩芝,龚瑞忠,等.化学农药环境安全评价试验准则[M]. 北京:国家环保局, 1989.
[19] European Food Safety Authority .Reasoned opinion of EFSA: Modification of the current MRLs for fluopicolide in various commodities. EFSA Journal, 2011,9(1):1977.
[20] 全珊珊,吴新荣.斑马鱼.人类疾病研究的理想模式动物 [J]. 生命的化学, 2008,28(3):260-263.
致谢:在此,谨对慕卫老师在试验方案和文章修改方面给予的悉心帮助表示衷心的感谢.
Toxic effects of fluopicolide on zebrafish.
LIN Jin1,2, WANG Hong-yan3, WANG Kai-yun1,2*, FAN Wei-di2, XU Hui4,
LIU Jie4(1.College of Plant Protection, Shandong Agriculture University, Taian 271018, China;2.Center of Pesticide Environmental Toxicology, Shandong Agriculture University, Taian 271018, China;3.Shandong Cotton Research Center, Jinan 250100, China;4.United Pesticide Industry Co., Ltd., Shandong Province, Jinan 250100, China). China Environmental Science, 2014,34(12):3230~3236
The zebrafish embryos technology and traditional toxicology methods were used to determined the toxicity of fluopicolide to zebrafish embryos、adult fish and larvae. Fluopicolide had lethal capabilities to the three stages of zebrafish with the LC50(48h) values to larvae and LC50(96h) to adult fish and juvenile was 0.204mg/L, 0.286mg/L and 1.489mg/L. 0.0596mg/L or more concentrations fluopicolide have a certain degree of lethal effect to zebrafish embryos, and the embryos which were treated with high concentrations displayed many of the symptoms, such as pericardial cyst, yolk sac does not absorb, less melanin deposition and fish bending. After 14days exposure with fluopicolide, the adult zebrafishs expressed the following symptoms: weight loss, reduction in fecundity, the amount of effective eggs were reduced; After treated by 0.0298mg/L fluopicolide, though 144h offspring larval’s survival relatively high, but most surviving fish has still emerged as deformity: pericardial edema and abnormal body bending, etc. Fluopicolide residue in water have the potential hazards to the growth and development of each life stage of zebrafish.
fluopicolide;zebrafish;embryo;adult fish;acute toxicity
X171.5
A
1000-6923(2014)12-3230-07
林 琎(1978-),女,四川三台人,实验师,山东农业大学博士研究生,研究方向为农药毒理及有害生物抗药性.发表论文8篇.
2014-03-10
国家“十二五”科技支撑计划(2011BAE06B02)
* 责任作者, 教授, kywang@sdau.edu.cn

