铜尾矿库重金属Cu、Zn对细菌群落结构的影响
林 海,崔 轩,董颖博,张国华,李笑晴,季 振 (北京科技大学土木与环境工程学院,北京 100083)
铜尾矿库重金属Cu、Zn对细菌群落结构的影响
林 海*,崔 轩,董颖博,张国华,李笑晴,季 振 (北京科技大学土木与环境工程学院,北京 100083)
以湖北某铜矿尾矿库为主要研究对象,采集库内尾矿样品11个、对照样某小型废弃尾矿库尾矿样品2个和附近耕地土壤样品1个,采用变性梯度凝胶电泳方法对上述样品中细菌的16S rRNA V3~V6可变区扩增片段进行分析,利用分析得到的图谱数据与所测得样品的理化性质及重金属Cu、Zn含量进行相关性及冗余度(RDA)分析.结果表明,尾矿库内Cu、Zn污染严重并波及周边,与尾矿样品的理化性质存在不同的相关性,其中Zn的污染程度与有机质存在极显著正相关[R=0.668(P<0.01)].DGGE图谱分析结果发现,样品细菌多样性较低,相似性较高(最低相似度53.1%),优势菌群相对稳定,PCA分析表明,Cu和Zn对细菌多样性具有抑制作用.RDA分析结果说明Cu和Zn的含量对细菌种群分布影响很大,Cu对大部分种群具有抑制作用,而Zn一方面能促进某些种属数量,另一方面又能抑制其他种群的结构变化,这种影响并不是实验室研究的简单线性关系.
铜尾矿库;细菌群落;Cu;Zn;DGGE
重金属在这个特殊环境中有着独特的地球化学行为及生物有效性.尾矿颗粒细小、易随风扬尘,
导致空气污染,特别是长期堆存条件下的尾矿在微生物和风化作用影响下,尾矿中重金属元素将发生大规模活化、迁移、形态转化,外排的废液或扬尘进入周边环境,从而对周边环境产生重金属污染和危害,对周围生态系统造成潜在的、长期的巨大威胁[2].
重金属污染能够明显影响土壤微生物群落结构,已有研究表明微生物群落结构的变化能够较早地预测土壤养分及环境质量的变化过程,被认为是最有潜力的敏感性生物指标[3].随着现代分子生物学技术的发展,在分子水平上研究重金属对微生物群落的影响已成为可能.变性梯度凝胶电泳技术(DGGE)是目前研究微生物遗传多样性比较有力的分子生物技术之一,这一技术能够提供群落中优势种类信息,同时分析多个样品,具有可重复和易操作等特点,适合于调查群落结构变化[4-5].Gomes[6]等通过向土壤中投加富含Cd、Zn的污泥观察细菌的DGGE图谱发现,不管是短期还是长期污染过程中其基因图谱都产生了显著变化.潘雪莲等[7]通过对黄土高原 5个土壤样品进行DGGE分析发现不同微生物群落结构的成因与季风性气候引起的温湿环境变化及冰期有关.
近年来,国内外学者对铜尾矿、铅锌尾矿污染区重金属污染现状,包括重金属含量、形态特征以及对污染区微生物及植被的影响等方面进行了研究[8-13].但有关尾矿库这个污染源内在的微生物群落结构的研究报道较少.据此,本研究通过对湖北某铜矿尾矿库重金属污染及对其最为敏感的微生物—细菌特性进行研究,旨在探讨重金属污染与细菌特征指标间的内在关系,以期为土壤重金属污染程度与细菌群落结构的相互影响研究提供新的证据.
1 尾矿库自然概况与研究方法
1.1 尾矿库自然概况
所取样铜尾矿库位于湖北省大冶市西南,距大冶市区约 3km.地表土壤旱地主要为红壤和砖红壤,农田主要为稻田土[14].库长 1km,宽 0.7km,库面面积为0.6km2,近似卵圆形,坝内已堆存尾矿500余万t.尾矿砂的主要矿物组分为铁矿物和铜矿物以及少量含锌矿物,如黄铜矿、赤铁矿及黄铁矿等;主要脉石矿物为方解石、石英和玉髓等[15].
1.2 研究方法
1.2.1 样品的采集和保存 在尾矿库里设置 5个相互距离较远的样点,每个样点根据尾矿样形态、色泽、土质取表层和深层样品;另取附近距离约1km一小型废弃铜尾矿库样品和附近长有植物的耕土作对照,样品装入塑料保鲜袋,24h内带回实验室,取样结果如表 1.一部分新鲜土壤置于 4℃保存供土壤生物性指标分析,一部分土样风干保存,研磨过1mm网筛,用于测定理化性质.
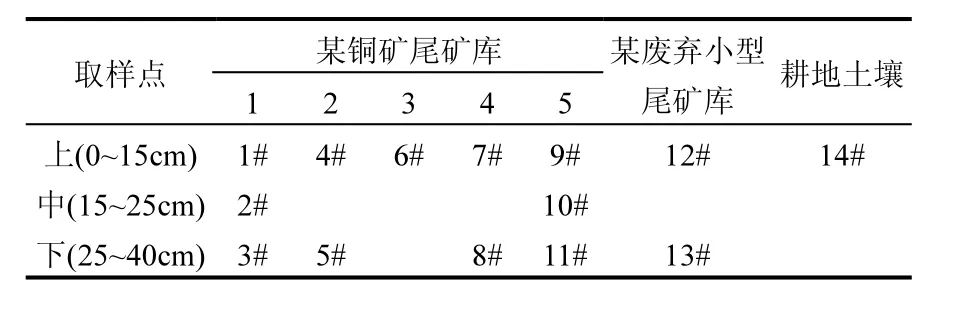
表1 取样点的选择及编号Table 1 The number of sampling points
1.2.2 样品理化性质及重金属测定 土壤理化性质按常规方法测定[9],分别测定pH值、氧化还原电位(Eh)、电导率(κ).阳离子交换量(CEC)采用BaCl2交换法测定;有机质采用K2Cr2O7容量法测定.鉴于取样尾矿库仅有 Cu和 Zn超标(Pb、Cd、Cr含量均低于检出限—Pb≤0.05%、Cd、Cr≤0.01%,由北京科技大学化学分析中心提供),所以重点对Cu和Zn进行检测.Cu离子用水质分析仪测定,Zn离子采用比色法测定[16].
1.2.3 土壤微生物DNA提取及细菌16S rRNA的PCR扩增 土壤总DNA采用康为世纪生物公司生产的土壤 DNA提取试剂盒提取,提取的DNA经纯化后置于-20℃下储存.采用英骏公司合 成 的 细 菌 特 异 性 引 物 GC-357F(5′-CGCCGGGGGCGCGCCCCGGGCGGGGCGGG GGCACGGGGGGCCTACGGGAGGCAGCAG-3′,下划线部分为 GC夹子序列)和通用引物518R(5′-ATTACCGCGGCTGCTGG-3′)对土壤细菌的16S rRNA的V3~V6区进行PCR扩增. 25μL的 PCR反应体系:2×Taq MasterMix for PAGE 12.5μL,上下游引物(10μmol/L)各 0.5μL, DNA模板0.5μL,去离子水11μL.扩增条件:95℃预变性3min,94℃变性1min,55℃退火1min,72℃延伸1min,35个循环,最后72℃延伸10min.PCR产物采用1%的琼脂糖凝胶电泳检测.
1.2.4 变性梯度凝胶电泳 各样品的PCR扩增产物经纯化后进行DGGE电泳,然后用Quantity One 4.6.7软件对DGGE图进行条带识别和图谱分析使用北京君意东方电泳公司生产的JY-TD331A型号对细菌16S rRNA PCR产物进行DGGE测试.使用8%的聚丙烯酰胺凝胶,电泳缓冲液为1×TAE,变性梯度区间30%~45%,上样量为10μL.60℃、100V恒温恒压电泳10h,采用银染:先用固定液固定 15min,然后避光银染15min,最后用显色液显色至条带清晰,凝胶显色后拍照.
1.2.5 数据分析方法 采用 SPSS进行差异性和相关性分析,利用quantity one(Version 4.6.7)进行DGGE图谱识别和统计,确定各个样品电泳条带的数量和亮度峰值,利用Canoco for Windows软件进行细菌群落和理化因子的冗余度分析(RDA).
2 结果与讨论
2.1 样品理化性质与重金属污染之间的关系
由表2和表3可见,样品的pH都在8.0以上,属碱性土且普遍比耕土土壤的pH值高,可能是因为选矿过程中碱性浮选药剂的添加导致pH值普遍偏高[17].土壤电导率是测定土壤水溶性盐的指标,而所测电导率普遍较低,与pH值相关性不高,说明不溶性盐的存在导致电导率较低,并不是碱性环境的原因.氧化还原电位可以影响土壤中重金属的形态和化合价等,从而影响其活性和毒性.样品的氧化还原电位变化不大,与 pH值有着极显著的负相关性(P<0.01),在此情况下,重金属既不能形成难溶的硫化物(Eh<8mV),又不能以氧化难溶物的形式沉积[18],有可能导致重金属毒性增强.样品的 CEC均值为452mmol/kg,比耕土的68mmol/kg高很多,可能由于尾矿库内样品粒度较细、黏粒含量较多有关[19].样品与耕地土的有机质相差不大,均较低,不适合作物生长[20].
而重金属 Cu、Zn的含量均超过了GB15618-1995一级标准[21],结合内梅罗污染指数分析[22]得出所有样品均属于重度污染.由表 3得出ω(Zn)与OM成极显著正相关(P<0.01),可以推测Zn与有机质的络合能力强于Cu且对有机质的地球化学过程有重要影响[23].
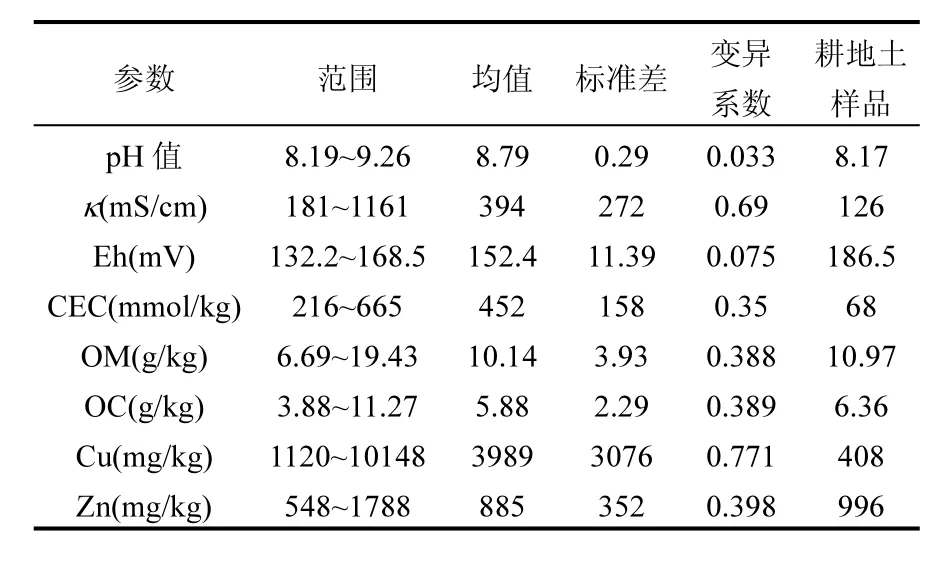
表2 尾矿样品基本理化性质及重金属含量(含耕地样品)(n=13)Table 2 Physico-chemical characteristics and mental content of soil samples (n=13)

表3 重金属含量与理化性质的相关性系数Table 3 The relationship between soil characterisitics and total metal content
2.2 土壤细菌群落DGGE图谱分析
由图1可见,14个样品基因组总DNA的16S rRNA-PCR扩增产物全部扩增出来且位置正确、亮度明显,大小在250bp左右,片段大小符合下一步实验需求.
DGGE图谱中不同位置的条带代表不同的微生物类群,不同泳道同一位置条带的明暗程度(光密度值大小)则反映该菌群在不同环境样品中的相对丰度[24].电泳条带越多说明生物多样性丰富,条带信号越强,表明该种属数量越多,从而确定不同样品中所含的微生物的种类和数量关系,得出其中微生物多样性的信息[25].由图2可见,样品中的条带数目整体都较少(最多只有15条),相似性较高(与样品1最低相似度53.7%),不同条带的亮度在不同样品间有差异,有些条带较亮,有些条带较模糊,但差异主要表现在较弱的条带上,表明优势菌种相对稳定,但较弱的条带代表的细菌类群存在较大差异.根据图谱中条带数目以及强度(软件中计算峰面积值来表示)进一步对样品进行 UPGMA(unweighted pair~group method with arithmetic means,非加权组算术平均数)聚类分析,结果如图 3.从中发现大部分同一剖面的样品聚在一起,1#、2#、3#样品相似度达到67%,4#和5#相似度达到74%.只有12#和14#聚在一起且与其他样品相似度较低,可能原因是植物的生长改善了土壤本身的一些细菌群落结构,而废弃的尾矿库表层的 12#土壤样品则是在气候与时间的综合作用下跟周边土壤达到相似的生物性,但其与尾矿库内部的其他样品相似度还是达到了45%,从侧面说明了污染仍是较为严重.

图1 细菌PCR产物琼脂糖凝胶电泳图谱Fig.1 PCR detection of bacterial 16SrRNA based on ethidium bromide~stained gel

图2 样品细菌DGGE图谱及泳道对比Fig.2 DGGE fingerprint and lane comparison of sample bacteria
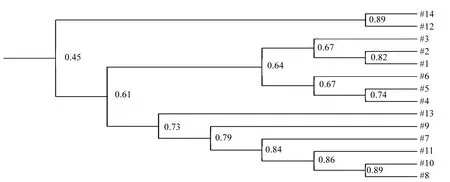
图3 基于DGGE的细菌群落聚类分析Fig.3 The cluster analysis of bacterial community based on DGGE
2.3 群落结构与理化因子及重金属的 RDA分析
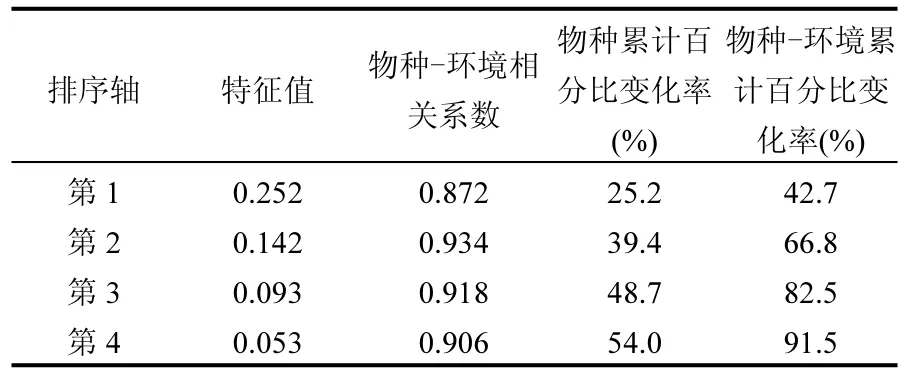
表4 冗余分析结果Table 4 Main variance composition of the first four significant axes as revealed by RDA

图4 土壤细菌群落样品~环境RDA分析Fig.4 Redundancy discrimination analysis relating environmental variables to community structure of bacteria
采用线性回归的冗余分析(RDA)对引起微生物群落结构变化的因素进行分析,结果见表4.RDA是一种直接梯度分析方法,能从统计学的角度来评价一个或一组变量与另一组多变量数据之间的相互关系[26].将细菌的种属作为解释变量,将理化因子及重金属含量作为 RDA分析中的响应变量,通过进一步选择(forward selection)和蒙特卡罗检验(Monte Carlo permutation test)(P<0.05,n = 999)得到解释细菌群落变化的显著变量[27].由表4中可见,第1排序轴解释了影响土壤细菌群落结构因素的 25.2%,第2排序轴解释了14.2%,而前4排序轴中共解释了54.0%的影响因素.这说明本研究中所测得 pH、ω(OM)等理化因子及ω(Cu)、ω(Zn)是影响土壤细菌群落结构的重要因素,但是还存在其他可能对细菌群落结构产生较大影响的因素尚待考察[28].
图4为土壤细菌群落样品~环境RDA排序.环境因子的矢量线的长短表示样点或种群与该过程因子相关系数的大小,从箭头的连线长度可以看出,选取的环境因子对细菌种群的梯度分布有着不同程度的影响[29].从图4中可以看出,重金属铜和锌的量对细菌群落有显著影响.铜对大部分物种都是抑制作用,少量锌对某些物种反而有促进作用.一些理化因子pH值、有机质、阳离子交换量等对物种分布无显著关系.
2.4 多样性指数分析
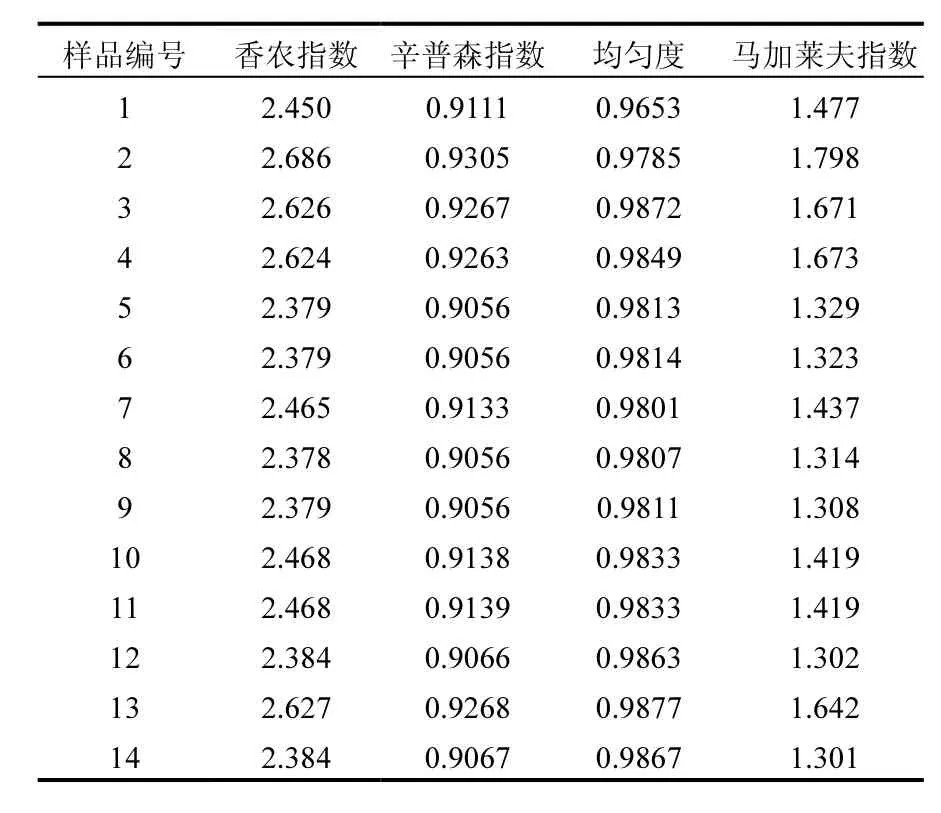
表5 基于DGGE的细菌种群结构多样性分析Table 5 The Diversity analysis of bacteria communities based on DGGE
DGGE指纹图谱中的1个条带被称作1个操作分类单元(OTU),根据DGGE图谱中OTU的数量、种类及丰度,分别计算每个样品的土壤细菌多样性指数,结果见表 5.物种多样性是指群落中物种数目的多少,它是衡量群落规模和重要性的基础[30].一般来说种类越多, 各种个体数量分布越均匀,物种多样性指数越大[31].从表5中可看出,所取样品的剖面深度与种群多样性并无直接关系,例如 2#样品的多样性比更表层的 1#更丰富.图 5揭示了铜和锌对多样性指数都起到了抑制作用.而对于同一样品,不管从多样性指数或丰富度指数,还是优势度指数都具有较好的一致性,不过 3个主成分因子却把均匀度指数区分开来,证明还存在影响多样性指数的其他因素.
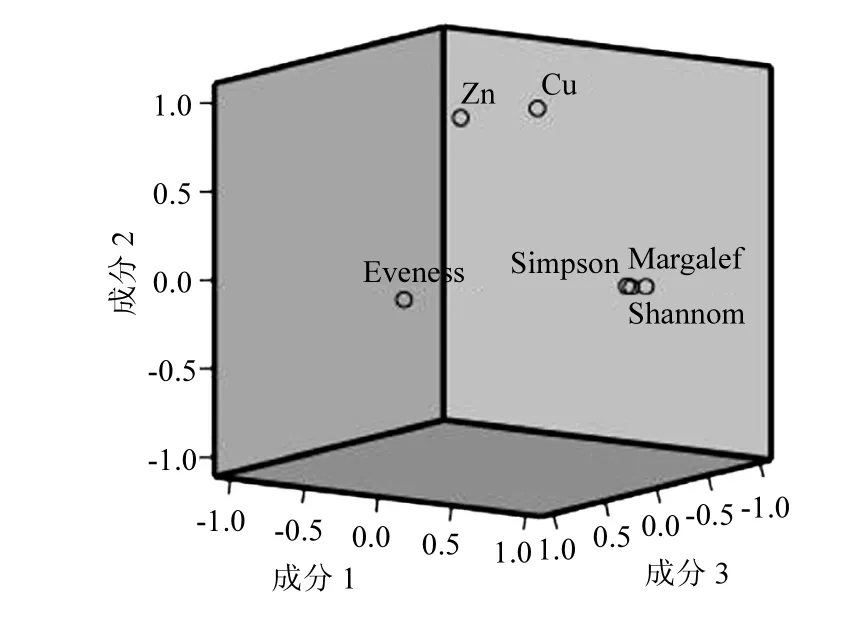
图5 重金属含量与细菌多样性的主成分分析Fig.5 PCA of the heavy mental contents and bacteria community
3 结论
3.1 对铜尾矿库所采各个样品的理化性质及重金属Cu、Zn含量进行测试分析,结果表明,重金属含量远远超标(Cu平均值为3989mg/kg, Zn平均值为 885mg/kg)并影响了样品的理化性质(Cu与pH和Eh、Zn与CEC和OM都呈显著相关性)导致其并不适于作物生长.
3.2 图谱结果表明土壤细菌的多样性较低,与样品所取深度并无直接关系.铜和锌对群落多样性有抑制作用.而在尾矿库这个大环境的长期作用下各个样品之间的种群相似性较高(相似度在45%以上),存在的大部分菌群是对重金属铜和锌具有抗性的菌群,一些对污染敏感的菌类相对较少.长有作物的耕土样品与尾矿库的样品多样性相差不多均较低,说明土壤根本上已受到污染.
3.3 冗余度分析证明了影响细菌群落的理化因素还有很多并不是简单的只有本研究所测的因子;Cu和Zn对于细菌群落的影响作用不完全相同,Cu的抑制作用较明显,而 Zn体现了两面性,一方面促进了群落结构多样性的丰富,另一方面又抑制了种群的分布,并不是简单的实验室研究的线性关系.
[1] 谢学辉,范凤霞,袁学武,等.德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响 [J]. 微生物学通报, 2012,(5):624-637.
[2] L. Rodrıguez E R J A. Heavy metal distribution and chemical speciation in tailings and soils around a Pb-Zn mine in Spain [J]. Environ Manage, 2009,90(2):1106-1116.
[3] 李 晔,孙丽娜,杨继松,等.基于PCR-DGGE的重金属污染土壤微生物种群指纹分析 [J]. 生态环境学报, 2010,(9):2204-2208.
[4] Wang S, He J. Two-step denaturing gradient gel electrophoresis (2S-DGGE), a gel-based strategy to capture full-length 16S rRNA gene sequences [J]. Applied Microbiology And Biotechnology, 2012,95(5):1305-1312.
[5] Nam Y, Yi S, Lim S. Bacterial diversity of cheonggukjang, a traditional Korean fermented food, analyzed by barcoded pyrosequencing [J]. Food Control, 2012,28(1):135-142.
[6] Gomes N C M, Landi L, Smalla K, et al. Effects of Cd- and Zn-enriched sewage sludge on soil bacterial and fungal communities [J]. Ecotoxicology and Environmental Safety, 2010, 73(6):1255-1263.
[7] 潘雪莲,黄 晟,方 昊,等.黄土高原土壤中细菌群落结构多样性的PCR-DGGE分析 [J]. 生态与农村环境学报, 2009,(3):39-43.
[8] 高焕梅,孙 燕,和林涛.重金属污染对土壤微生物种群数量及活性的影响 [J]. 江西农业学报, 2007,(8):83-85.
[9] 谢学辉.德兴铜矿污染土壤重金属形态分布特征及微生物分子生态多样性研究 [D]. 上海:东华大学, 2010.
[10] 滕 应,黄昌勇,骆永明,等.重金属复合污染下土壤微生物群落功能多样性动力学特征 [J]. 土壤学报, 2004,(5):735-741.
[11] 龙 健,黄昌勇,滕 应,等.铜矿尾矿库土壤—海洲香薷(Elsholtzia harchowensis)植物体系的微生物特征研究 [J]. 土壤学报, 2004(1):120-125.
[12] 涂 从,郑春荣,陈怀满.铜矿尾矿库土壤-植物体系的现状研究[J]. 土壤学报, 2000,(2):284-287.
[13] Wakelin S A, Chu G, Lardner R, et al. A single application of Cu to field soil has long-term effects on bacterial community structure, diversity, and soil processes [J]. Pedobiologia, 2010, 53(2):149-158.
[14] 马 光.鄂东南铜绿山铜铁金矿床地质特征、成因模式及找矿方向 [D]. 长沙:中南大学, 2005.
[15] 束文圣,杨开颜,张志权,等.湖北铜绿山古铜矿冶炼渣植被与优势植物的重金属含量研究 [J]. 应用与环境生物学报, 2001, (1):7-12.
[16] 王志楼,谢学辉,王慧萍,等.典型铜尾矿库周边土壤重金属复合污染特征 [J]. 生态环境学报, 2010,(1):113-117.
[17] Moreno L, Neretnieks I. Long-term environmental impact of tailings deposits [J]. Hydrometallurgy, 2006,83(1-4):176-183.
[18] 李俊莉,宋华明.土壤理化性质对重金属行为的影响分析 [J].环境科学动态, 2003,(1):24-26.
[19] 赵之重.青海省土壤阳离子交换量与有机质和机械组成关系的研究 [J]. 青海农林科技, 2004,(4):4-6.
[20] 胡克林,余 艳,张凤荣,等.北京郊区土壤有机质含量的时空变异及其影响因素 [J]. 中国农业科学, 2006,(4):764-771.
[21] GB15618-1995 土壤环境质量标准 [S].
[22] 姚荣江,杨劲松,孟庆峰,等.苏北沿海某滩涂区土壤重金属含量及其污染评价 [J]. 环境科学研究, 2012,(5):512-518.
[23] 贺 勇,黄 河,严家平.淮河中下游底泥中的重金属与有机质研究 [J]. 安徽建筑工业学院学报(自然科学版), 2005,(6):79-82.
[24] Lyautey E, Lacoste B, Ten-Hage L, et al. Analysis of bacterial diversity in river biofilms using 16S rDNA PCR-DGGE: methodological settings and fingerprints interpretation [J]. Water Research, 2005,39(2/3):380-388.
[25] Machado A, Magalhaes C, Mucha A P, et al. Microbial communities within saltmarsh sediments: Composition, abundance and pollution constraints [J]. Estuarine Coastal And Shelf Science, 2012,99:145-152.
[26] Borcard D, Legendre P, Drapeau P. Partialling out the Spatial Component of Ecological Variation [J]. Ecology, 1992,73(3): 1045-1055.
[27] 洪 晨,邢 奕,司艳晓,等.铁矿区内重金属对土壤氨氧化微生物群落组成的影响 [J]. 中国环境科学, 2014,34(5):1212-1221.
[28] 张 杰,余 潮,王自海,等.不同植被群落表层土壤中细菌群落多样性 [J]. 环境科学研究, 2013,(8):866-872.
[29] 邢 奕,司艳晓,洪 晨,等.铁矿区重金属污染对土壤微生物群落变化的影响 [J]. 环境科学研究, 2013,(11):1201-1211.
[30] Thanh V N, Mai L T, Tuan D A. Microbial diversity of traditional Vietnamese alcohol fermentation starters (banh men) as determined by PCR-mediated DGGE [J]. International Journal of Food Microbiology, 2008,128(2):268-273.
[31] Hoshino Y T, Matsumoto N. DNA- versus RNA-based denaturing gradient gel electrophoresis profiles of a bacterial community during replenishment after soil fumigation [J]. Soil Biology and Biochemistry, 2007,39(2):434-444.
Impact on bacterial community structure of heavy mental of Cu and Zn in copper mine tailings.
LIN Hai*, CUI Xuan,
DONG Ying-bo, ZHANG Guo-hua, LI Xiao-qing, JI Zhen (School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China). China Environmental Science, 2014,34(12):3182~3188
To examine the spatial changes of bacterial community in a copper mine tailing of Hubei, 14soil samples were collected, including 12 tailing samples and 3 compared samples (one from cultivated land ,two from another small copper mine tailing). DGGE (denaturing gradient gel electrophoresis) was employed to analyze V3~V6variable regions of bacterial 16S rRNA. Pearson correlation analysis and redundancy analysis (RDA) between bacterial community data and physicochemical parameters were carried out respectively to reveal relationships of the bacterial community structure, physical and chemical factors of the total samples, and contents of Cu, Zn. The results showed serious copper and zinc pollution, and there were significant differences for contents of Cu, Zn correlated with different physico~chemical characteristics of tailing samples, notably the significant position correlation [R=0.668(P<0.01)] between the content of Zn and organic matter. According to analysis of gene separated by DGGE the bacterial structures were different between samples. Overall, there was certain rule in the samples that low bacterial diversity, high similarity (the lowest similarity 53.1%) and relatively stable dominant bacteria. RDA demonstrated that the content of Cu, Zn influenced on bacteria community, Cu can inhibit microbial population, so can Zn, but in a certain concentration range, Zn may contribute to the development of microbial diversity, that is not laboratory studied simply linear relationship with their concentrations.
copper mine tailing;bacterial community;Cu;Zn;DGGE我国是有色金属矿产资源大国,由于大部分矿产资源品位较低,导致开采过程中产生大量尾矿,一般占入选矿石的 70%~95%.这些尾矿利用率极低,大部分长期存放于尾矿库中[1].而尾矿库是一个物理、化学以及生物条件复杂多变的场所,
X171.5
A
1000-6923(2014)12-3182-07
林 海(1966-),男,四川仪陇人,教授,博士,主要从事矿山环境保护、矿物环境材料和水处理技术研究.发表论文80余篇.
2014-03-25
国家自然科学基金资助项目(51204011);北京市优秀博士学位论文指导教师科技项目(20121000803)
* 责任作者, 教授, linhai@ces.ustb.edu.cn

