15种中成药微生物限度检查方法验证
赵会兰
(云南丽江市食品药品检验所,云南丽江 674100)
15种中成药微生物限度检查方法验证
赵会兰
(云南丽江市食品药品检验所,云南丽江 674100)
目的:建立15种中成药微生物限度检查方法。方法:按《中国药典》(2010年版)的规定,进行各品种微生物限度检查方法的验证。结果:8个品种(青叶胆片、开胸消食片、复方公英片、女金丸、妇舒丸、青阳参片、小儿导赤片、利胆止痛片)无抑菌作用,回收率均大于70%,可采用常规法进行细菌数测定;3个品种(通宣理肺片、田七花叶颗粒、七叶神安片)对枯草芽孢杆菌有不同程度的抑菌作用,可采用培养基稀释法(0.2 mL/皿)进行细菌数测定;2个品种(泻痢消片、七叶神安片)对白色念珠菌有抗菌作用,可采用培养基稀释法(0.2 mL/皿)进行霉菌及酵母菌数测定;3个品种(血塞通片、血塞通胶囊、七叶神安片)对金黄色葡萄球菌和枯草芽孢杆菌有较强的抑菌作用,可采用薄膜过滤法进行细菌数测定;其余品种的细菌、霉菌及酵母数和控制菌均采用常规法进行测定。结论:以上验证方法可作为各品种微生物限度检查方法。
中成药;微生物限度;方法验证试验;回收率
口服中成药中很多品种有抑菌作用,本研究中有的品种中含黄连、厚朴、木香、白芍、吴茱萸、槟榔、黄芩、蒲公英、板蓝根、大黄等具有明显抑菌作用的中药[1],如采用常规微生物限度检查法检查这些品种,测定的结果不准确,导致检验结果不可靠。按照《中国药典》(2010年版)的规定建立药品的微生物限度检查法时应进行方法学验证,以保证微生物限度检查法的可行性和结果的可靠性,而现行《中国药典》收载的各中成药品种检查项下,很少规定具体的微生物限度检查方法,为确保用药的安全与有效,本研究按《中国药典》(2010年版)并参考其他标准和资料的基础上[2-9],对以上品种微生物限度检查方法进行了验证试验,确立了15种中成药微生物限度检查方法。
1 仪器与材料
1.1 仪器
GSP-9270MBE型隔水式恒温培养箱,上海博讯实业有限公司医疗设备厂;HTY-2000A型集菌仪,杭州泰林生物技术设备有限公司;TG16-WS台式高速离心机,长沙湘仪离心机仪器有限公司。
1.2 样品
通宣理肺片,0.3 g/片,批号:20110601;泻痢消片,0.35 g/片,批号:20100302;小儿导赤片,0.3 g/片,批号:20110301;妇舒丸,6 g/袋,批号:LJ1106;女金丸,5 g/袋,批号:20101104;青叶胆片,54片/盒,批号:20101104;复方公英片,36片/盒,批号:20110325;开胸消食片,0.3 g/片,批号:00309025;利胆止痛片,54片/盒,批号:20110301;青阳参片,100 mg/片,批号:00109002;以上药品均为云南白药集团丽江药业有限公司生产。血塞通片,0.173 g/片,批号:130562;血塞通胶囊,0.22 g/片,批号:130603;七叶神安片,50 mg/片,批号:130601,均为云南维和药业股份有限公司生产。田七花叶颗粒,10 g/袋,批号:130726;七叶神安片,50 mg/片,批号:20130501,为滇虹药业集团玉溪生物制药有限公司生产。
1.3 培养基及稀释剂
营养琼脂,批号:130422;玫瑰红钠琼脂,批号:1303202;胆盐乳糖,批号:130401;营养肉汤,批号:101124;麦康凯琼脂,批号:101018;改良马丁培养基,批号:101104,均为北京三药科技开发公司生产。4-甲基伞形酮葡糖苷酸(MUG)培养基,批号:20120701,为北京牛牛基因技术有限公司生产,经检查适用性符合《中国药典》(2010年版)要求。稀释剂:NaCl-蛋白胨缓冲液(pH7.0)。
1.4 菌种
枯草芽孢杆菌 [CMCC(B)63 501]、金黄色葡萄球菌[CMCC(B)26 003]、大肠埃希菌、[CMCC(F)44 102]、白色念珠菌[CMCC(F)98 001]、黑曲霉[CMCC(F)98 003]均由云南省食品药品检验所提供。本实验所用对照菌均在5代以内。
2 方法
按照《中国药典》(2010年版)一部微生物限度检查法附录进行。
2.1 菌液制备
2.1.1 金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌取经 35℃培养 18~ 24 h的金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌的营养肉汤培养物1 mL,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 cfu/mL的菌悬液,备用。
2.1.2 白色念珠菌取经25℃培养18~ 24 h的白色念珠菌的改良马丁液体培养物1 mL,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 cfu/mL的菌悬液,备用。
2.1.3 黑曲霉取1 mL黑曲霉孢子悬液,用0.9%无菌氯化钠溶液10倍稀释至约含50~100 cfu/mL的孢子悬液,备用。
2.2 供试液制备
称取样品 10 g,加 pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,摇匀,为1∶10供试液。
2.3 验证试验
2.3.1 常规法
2.3.1.1 试验组 取 1∶10供试液 1 mL和试验菌50~ 100 cfu,然后每皿加15~20 mL营养琼脂或玫瑰红钠琼脂培养基,摇匀,置规定温度培养48~72 h计数,进行细菌、霉菌和酵母菌数测定。2.3.1.2菌液组 取试验菌50~100 cfu,然后每皿加15~20 mL营养琼脂或玫瑰红钠琼脂培养基,摇匀,置规定温度培养48~ 72 h计数。
2.3.1.3 供试品对照组 取 1∶10供试液1 mL,然后每皿加15~20 mL营养琼脂或玫瑰红钠琼脂培养基,摇匀,置规定温度培养 48~ 72 h计数。结果见表1。
表1结果表明,小儿导赤片、妇舒丸、女金丸、青叶胆片、复方公英片、开胸消食片、利胆止痛片、青阳参片8个品种对5株试验菌的回收率均高于70%,说明无抑菌作用,可采用常规法进行细菌、霉菌和酵母菌数测定。通宣理肺片、田七花叶颗粒、七叶神安片3个品种对枯草芽孢杆菌有抑菌作用,泻痢消片对白色念珠菌有抑菌作用,血塞通片、血塞通胶囊2个品种对枯草芽孢杆菌和金黄色葡萄球菌有抑菌作用,七叶神安片对枯草芽孢杆菌、金黄色葡萄球菌和白色念珠菌有抑菌作用,回收率小于70%,采用培养基稀释法或薄膜过滤法重新进行细菌数、霉菌和酵母菌数验证。

表1 常规法(1 mL/皿)5株阳性试验菌回收率
2.3.2 培养基稀释法取1∶10供试液采用0.5 mL/皿、0.2 mL/皿再加入试验菌 50~ 100 cfu,方法同常规法进行试验,结果见表2。
2.3.3 薄膜过滤法取1∶10的供试液10 mL,离心3 min(500 r/min),取上清液2 mL注入100 mL缓冲液中,用薄膜过滤器减压抽滤至干,再用上述缓冲液少量多次冲洗,总冲洗量每膜400 mL,在最后一次冲洗液中加入试验菌50~ 100 cfu,滤干,取膜菌面朝上贴于营养琼脂平板,置规定温度培养48~ 72 h计数,见表3。
表2,3结果表明,培养基稀释法(0.2 mL/皿)可消除通宣理肺片、七叶神安片、田七花叶颗粒、泻痢消片的抗菌作用;薄膜过滤法(每膜冲洗400 mL)可消除血塞通片、血塞通胶囊、七叶神安片的抗菌作用,回收率均大于 70%,故上述方法可用于该品种的细菌数、霉菌及酵母菌数测定方法。
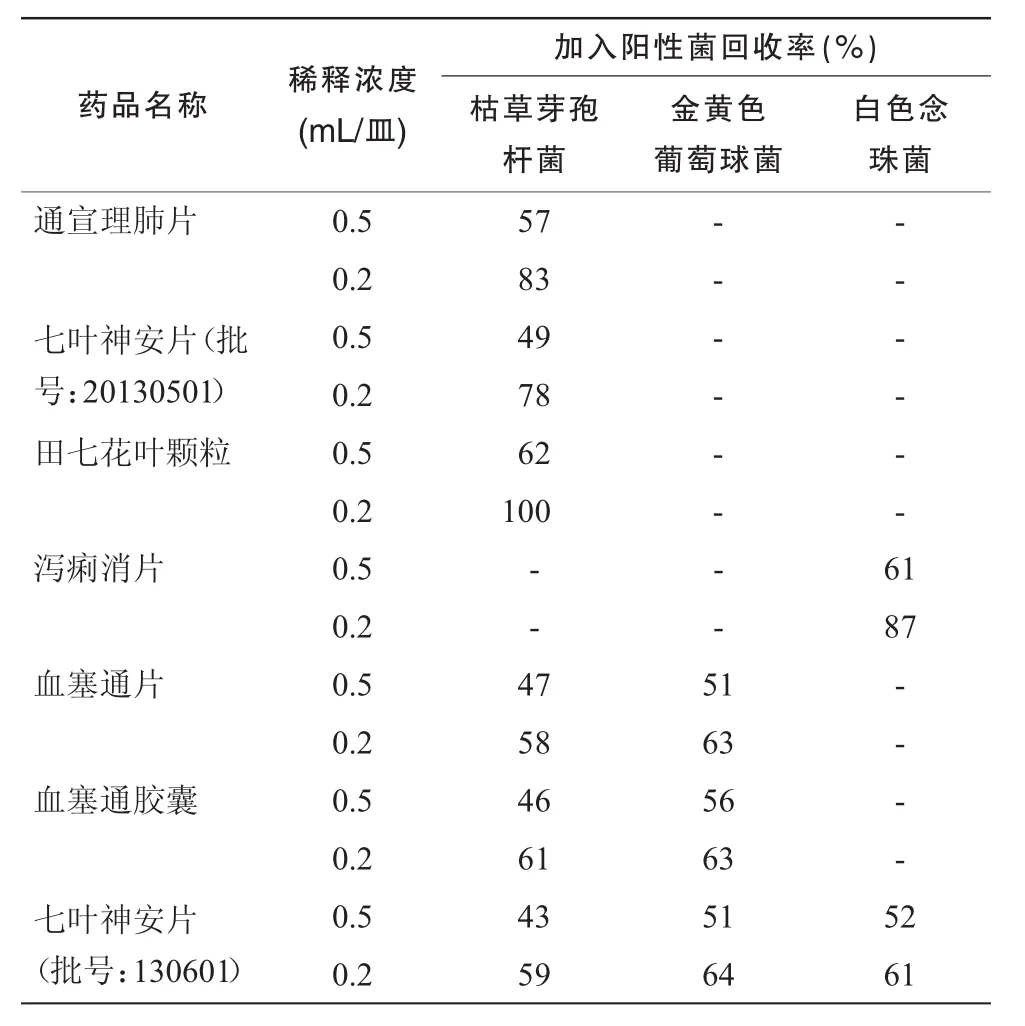
表2 培养基稀释法回收率
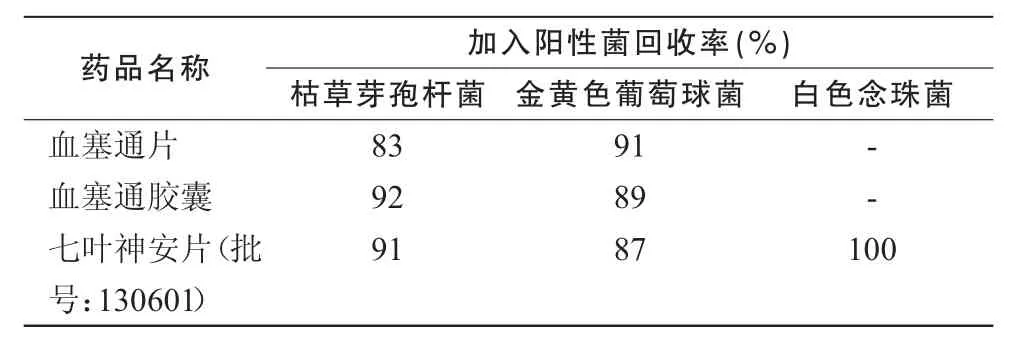
表3 薄膜过滤法回收率
2.4 控制菌检查方法验证(常规法)
2.4.1 试验组取1∶10供试液10 mL和大肠埃希菌液 50~100 cfu,加入到胆盐乳糖增菌培养基100 mL中,依据大肠埃希菌检查法进行试验。取10 mL胆盐乳糖发酵培养基3支,分别加入1∶10供试液1 mL、1∶100的供试液1 mL、1∶1 000的供试液1 mL,同时分别加入上述大肠埃希菌液50~100 cfu,依据大肠菌群检查法进行试验。
2.4.2 阳性对照组取大肠埃希菌液50~100 cfu分别加入100 mL胆盐乳糖增菌培养基和10 mL胆盐乳糖发酵培养基中,依据大肠埃希菌和大肠菌群检查法进行试验。
2.4.3 阴性对照组取规定的稀释剂,分别加入到100 mL胆盐乳糖增菌培养基和10 mL胆盐乳糖发酵培养基中,依据大肠埃希菌和大肠菌群检查法进行试验。
2.4.4 本研究中15个品种均为口服制剂,药典规定不含药材原粉的应检大肠埃希菌,含药材原粉的应检大肠埃希菌和大肠菌群,且试验组和阳性对照组应检出大肠埃希菌,阴性对照组应无菌生长。常规法试验结果表明,15个品种试验组和阳性对照组均检出大肠埃希菌,阴性对照组均无菌落生长,故该方法成立,可采用常规法进行控制菌检查。
上述结果表明,通宣理肺片、七叶神安片(20130501)、田七花叶颗粒可采用稀释法(0.2 mL/皿)进行细菌数测定;泻痢消片可采用(0.2 mL/皿)进行霉菌及酵母菌数测定;血塞通片、血塞通胶囊采用薄膜过滤法(每膜冲洗 400 mL)进行细菌数测定;七叶神安片(130601)采用薄膜过滤法(每膜冲洗400 mL)进行细菌数测定,(0.2 mL/皿)进行霉菌及酵母菌数测定;其余品种和项目均可采用常规法进行测定。
3 讨论
3.1 《中国药典》(2010年版)规定,当进行药品的微生物限度检查时,应采用大肠埃希菌、枯草芽孢杆菌、金黄色葡萄球菌、白色念珠菌、黑曲霉菌 5株试验菌逐一进行回收率测定,以确认所采用的方法适合该药品的检验,验证试验应包括细菌、霉菌和酵母菌及控制菌的验证。本研究的15个品种中通过5株试验菌回收率测定,有3个品种对枯草芽孢杆菌,有2个品种对白色念珠菌,有3个品种对金黄色葡萄球菌和枯草芽孢杆菌有不同程度的抗菌作用,说明《中国药典》规定进行方法学验证试验是必要的。
3.2 通过不同企业的七叶神安片验证试验显示,其中一个厂家的七叶神安片对金黄色葡萄球菌、枯草芽孢杆菌和白色念珠菌均具有较强的抑菌作用,另一个厂家的七叶神安片只对枯草芽孢杆菌有抑菌作用,对金黄色葡萄球菌和白色念珠菌的回收率差异太大,对枯草芽孢杆菌的回收率无明显差异,说明《中国药典》规定进行方法学验证的重要性,且方法学验证试验也可从侧面反映药品的质量,同一品种、不同生产企业的产品药物抗菌活性有如此大的差异,值得研究,可能与企业采用的原药材的产地、品质、成分的不同及含量,生产工艺有关。
[1] 《全国中草药汇编》编写组.全国中草药汇编(上册)[M].北京:人民卫生出版社,1982:62-871.
[2] 苏德模,马绪荣.药品微生学检验技术[M].北京:华龄出版社,2007:209-236.
[3] 国家药典委员会.中国药典(2010年版)一部[S].北京:中国医药科技出版社,2010:附录79.
[4] 中国药品生物制品检定所.中国药品检验标准操作规范(2010年版)[S].北京:中国医药科技出版社,2010:351-389.
[5] 肖双.不同企业来源安神丸微生物限度检查方法学验证比较[J].中国当代医药,2010,17(21):133-135.
[6] 特玉香,刘鹏,戴翚,等.黄连上清丸微生物限度检查方法验证浅析[J].药物分析杂志,2006,26(11):1674-1677.
[7] 向东.影响微生物限度检查及方法验证的因素分析[J].现代医药卫生,2007,23(15):2329-2330.
[8] 刘鹏,马仕洪,戴翚,等.不同企业来源活血止痛胶囊微生物限度检查结果分析[J].中国药事,2012,26(10):1112-1114.
[9] 王德启.珍珠冰硼散微生物限度检查方法学验证[J].中国执业药师,2011,8(2):37-39.
Method Validation of Microbial Limit Test of 15 Kinds of Traditional Chinese Patent Medicines
Zhao Huilan(Institute for Food and Drug Control of Lijiang City of Yunnan Province,Yunnan Lijiang 674100,China)
Objective:To establish a method for microbial limit test of 15 kinds of traditional Chinese patent medicines.Methods:According to the requirements set forth in the Chinese Pharmacopoeia of 2010 edition,method validation should be conducted of microbial limit test for different varieties.Results:Eight species(qingyedan tablets,kaixiongxiaoshi tablets,compound gongying tablets,nvjin pills,fushu pills,qingyangshen tablets,xiaoerdaochi tablets and lidan zhitong tablets)had no bacteriostasis effect with the recovery rate of more than 70%,and the conventional method can be used for bacterial number determination.Three species (tongxuanlifei tablets,tianqihuaye granules and qiyeshen’an tablets)had different degrees of inhibition on bacillus subtilis,and the culture medium dilution method (0.2 mL/plate)can be used for bacterial number determination.Tow species (xielixiao tablets and qiyeshen'an tablets)had antibacterial effect on candida albicans,and medium dilution method(0.2 mL/plate)should be used for the determination of mold and yeast counts.Three species (xuesaitong tablets,xuesaitong capsules and qiyeshen’an tablets)had stronger bacteriostasis on staphylococcus aureus and bacillus subtilis,and the bacterial numbers can be tested by membrane filtration.Other kinds of bacteria,mold and yeast counts and control bacteria can be measured by conventional methods.Conclusion:The above verification methods can be used for microbial limit tests of different varieties.
Chinese Patent Medicine;Microbial Limit;Method Validation Test;Recovery Rate
10.3969/j.issn.1672-5433.2014.05.005
2013-11-20)
赵会兰,女,副主任药师。研究方向:药品检验。E-mail:1145472590@qq.com

