血管内皮生长因子在乳腺癌表达的作用及意义*
刘春富 ,李 卫 ,许 军 ,宫金伟
(1.哈尔滨医科大学附属第四医院普外科,黑龙江 哈尔滨 150001;2.哈尔滨市第一人民医院骨科,黑龙江 哈尔滨 150001)
血管生成是肿瘤生长和转移的关键步骤[1],目前所知血管内皮生长因子(VEGF)是肿瘤血管生成过程中作用最强、特异性最高的促血管生长因子。在大多数实体瘤组织中VEGF呈高水平表达,并与肿瘤的生长及转移密切相关[2-3]。笔者以人类乳腺癌为观察材料,应用免疫组织化学检测法,分析VEGF在乳腺癌组织中的表达情况,以探讨VEGF在乳腺癌组织中的表达与肿瘤临床和病理的关系。
1 资料与方法
1.1 一般资料
选取2004年6月至2008年8月我院临床医院手术切除乳腺癌蜡块标本65例。患者均为女性;年龄25~77岁,平均53岁;术前均未经任何抗癌治疗;乳腺癌按世界卫生组织(WHO)1998年分类标准进行病理分型,导管内癌23例,浸润性导管癌20例,髓样癌10例,腺癌8例,湿疹样癌2例,鳞状细胞癌2例;组织学分级,Ⅰ级18例,Ⅱ级22例,Ⅲ级25例;有淋巴结转移46例,无淋巴结转移19例;肿瘤大小不超过3 cm 47例,大于3 cm 18例。每例标本均收集其相应的癌旁组织作对照组织。
1.2 材料与方法
应用链霉素抗生素蛋白-过氧化酶(S-P)免疫组化技术检测VEGF,每例标本做4μm厚的切片,肿瘤切片进行高压抗原修复,DAB显色,并以PBS缓冲液代替第一抗体做阴性对照,以血管内皮细胞着色为阳性对照。VEGF单克隆抗体购自上海长嘉生物技术有限公司,S-P免疫组化试剂盒和DAB试剂盒均购自福州迈新生物技术开发公司。
1.3 阴阳性结果判定标准[4]
以癌细胞胞浆或细胞核呈黄色或棕黄色为阳性,每张切片由2名病理医师双盲观测5个具有代表性的高倍视野,每个视野计数200个肿瘤细胞,依据镜下阳性染色细胞占癌细胞总数的百分率综合判定。阴性(-):无棕黄色染色或阳性细胞数平均少于10%;阳性(+):阳性细胞数平均大于10%。
1.4 统计学处理
应用 χ2检验和相关分析,P<0.05为差异有统计学意义。
2 结果
65例乳腺癌组织中VEGF阳性表达率为78.46%(51/65),VEGF阳性染色部位主要为细胞质及细胞膜,肿瘤周边以阳性为主,侵袭缘尤为明显(图1)。详见表1。
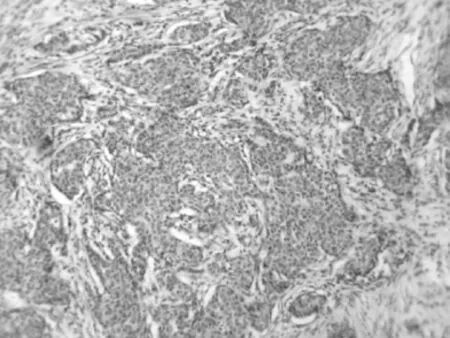
图1 VEGF蛋白位于乳腺癌细胞浆呈棕黄色颗粒阳性(×400)
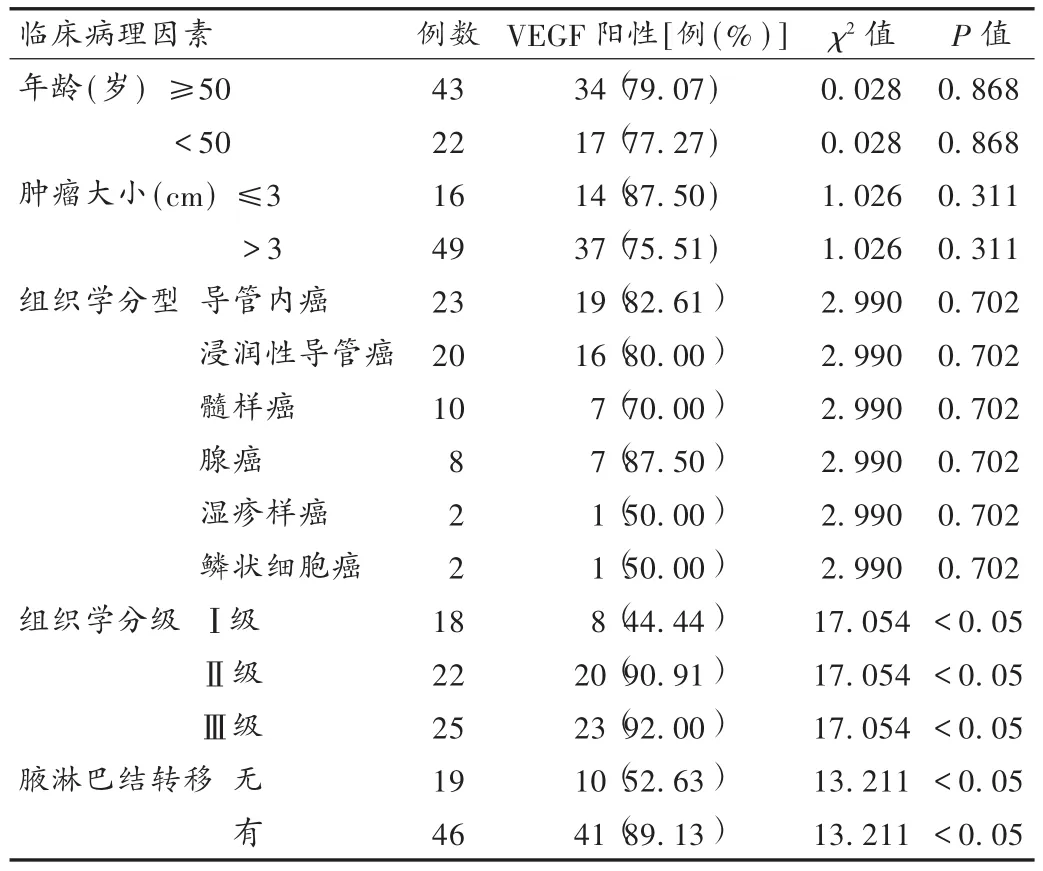
表1 VEGF表达与乳腺癌临床病理特征的关系
3 讨论
乳腺癌的生长和转移是一个复杂的过程,其中血管生成是癌肿物生长中的一个重要事件,肿瘤在表现其生长、转移等生物学行为时与其中的微血管增生有密切关系,无论原发性或转移性肿瘤,其持续生长都必须依赖于新生血管的形成[5]。目前发现,VEGF是可以特异地促进血管内皮细胞生长的一种多功能的细胞因子,可表达人体的多个正常组织及绝大多数的肿瘤组织[6]。VEGF作为肿瘤组织中最主要的促血管生成因子,不仅与乳腺癌血管发生和增殖有关,并直接与其浸润、转移有关[7]。黄选东等[8]用免疫组化RT-PCR法和S-P法检测42例乳腺癌和相应正常乳腺组织中VEGF的表达,结果显示,42例乳腺癌组织中VEGF阳性表达明显高于正常乳腺组织。刘兰芳等[9]认为,VEGF的表达与组织学分级呈正相关,随着组织学分级的增高,VEGF阳性率也升高;李日乐等[10]采用免疫组化检测VEGF在101例浸润性乳腺癌组织中的表达,结果显示,乳腺癌组织中的VEGF表达与组织分化、淋巴结转移、远处转移及早期死亡密切相关。刘鹏等[11]采用免疫组织化学检测109例乳腺癌组织中VEGF的表达情况,结果显示,VEGF强表达组淋巴结转移率高及病理分级也高。本试验结果显示,乳腺癌组织中VEGF表达阳性率明显高于其癌旁正常组织;Ⅲ级乳腺癌组织中VEGF表达阳性率明显高于Ⅰ~Ⅱ级乳腺癌组织,说明VEGF的表达与乳腺癌的分级密切相关。研究结果与相关文献报道一致。本试验还发现VEGF表达与乳腺癌的淋巴结转移情况相关,伴有淋巴结转移的乳腺癌组织中VEGF阳性表达率高,其原因可能是VEGF通过一系列复杂的机制诱导血管的形成,为肿瘤的生长提供充足的营养,从而促进肿瘤体积增大。Ohta等[12]认为,VEGF除了促进血管内皮细胞增殖外,对淋巴管内皮细胞同样具有促分裂和增殖作用,诱导“淋巴管生成”,有利于肿瘤细胞浸润淋巴管,促进肿瘤向淋巴结转移。本试验结果表明,乳腺癌组织中的VEGF表达与肿瘤生长和浸润以及淋巴结转移密切相关。
综上所述,VEGF可促进乳腺癌的浸润和转移,在乳腺癌的发展、转移中起重要作用,检测VEGF的表达可作为乳腺癌恶性程度、浸润转移等生物学行为的参考指标。
参考文献:
[1]Folkman J.What is the evidence that tumor are angiogenesis dependent[J].JNatl CancerInstl,1990,82(1):4.
[2] Nagata S,Golstein P.The Fas death factor[J].Science,1995,267(5203):1449-1456.
[3] Pamey IF,Hao KC.Glioma immunology and immunotherapy[J].Neurosurgery,2000,460(4):778 - 791.
[4]曾谷清,方松清,刘 彦,等.血管内皮生长因子在乳腺癌组织中的表达及其临床意义[J]. 南华大学学报:医学版,2003,31(3):269 -271.
[5]张文江,刘爱东,庞久玲,等.血管内皮生长因子在乳腺癌中的表达及其意义[J]. 临床医学,2007(4):43 -44.
[6]张 晓,徐文华,葛银林,等.VEGF基因特异性,siRNA转染后对人乳腺癌细胞增殖和凋亡的影响[J].细胞与分子免疫学杂志,2007,23(1):14 - 17.
[7]廖晓锋.血管内皮生长因子与肝细胞癌[J].国外医学:外科学分册,2001,28(2):68 -70.
[8]黄选东,周雪瑞,沈 阳,等.乳腺癌VEGF的表达与肿瘤生物学特性的关系[J]. 临床肿瘤学杂志,2005,10(6):625 -630.
[9]刘兰芳,申兴斌,赵晓明,等.乳腺浸润性导管癌血管内皮生长因子和雌激素、孕激素受体的表达及意义[J].陕西医学杂志,2005,34(3):295-297.
[10]李日乐,田明铭,汤如勇.乳腺癌血管内皮生长因子的表达及意义[J].中国癌症杂志,1998,8(3):163 -165.
[11]刘 鹏,孙 慧,宁连胜,等.血管内皮生长因子与乳腺癌临床病理因素及预后的关系[J]. 天津医科大学学报,2002,8(2):144 -146.
[12]Ohta Y,Watanabe Y,Murakami S,etal.Vascular endothelial grow th factor and lymph nodemetastasis in primary lung cancer[J].Br JCancer,1997,76(8):1041 - 1045.

