一例高致病性蓝耳病病毒、圆环病毒2型和副猪嗜血杆菌混合感染的诊断
蒋建国1 张显浩2 刘好朋2 贺东生3*
(1广西桂林市蔬菜研究所,广西桂林 541004;2广东大华农动物保健品股份有限公司,广东新兴 527400;3华南农业大学兽医学院,广东广州 510642)
一例高致病性蓝耳病病毒、圆环病毒2型和副猪嗜血杆菌混合感染的诊断
蒋建国1 张显浩2 刘好朋2 贺东生3*
(1广西桂林市蔬菜研究所,广西桂林 541004;2广东大华农动物保健品股份有限公司,广东新兴 527400;3华南农业大学兽医学院,广东广州 510642)
目前,猪场疫病混合感染的现象普遍存在,给我国养猪业造成了巨大损失。2013年10月,广西省某集约化猪场约6周龄猪群发生以高热、皮肤发绀、呼吸困难、关节炎为主要特征的传染病。根据发病情况、临床症状、剖检变化并结合实验室诊断方法进行综合诊断,最终结果显示,导致该猪场大规模发病并死亡的主要病原包括高致病性猪蓝耳病病毒、猪圆环病毒2型和副猪嗜血杆菌,是典型的混合感染导致大规模发病及死亡的案例。
高致病性猪蓝耳病病毒;猪圆环病毒2型;副猪嗜血杆菌;混合感染
高致病性猪蓝耳病(hpPRRS)是由基因缺失变异的猪繁殖与呼吸综合征病毒(PRRSV)引起的猪的新型传染病,可造成母猪的繁殖障碍和仔猪的呼吸症状,具有发病快、死亡率高等特点[1,2]。猪圆环病毒病是由猪2型圆环病毒(PCV2)感染导致的猪的一种免疫抑制性疾病,主要引起断奶仔猪多系统衰竭综合征[3]、保育猪和育肥猪的呼吸道疾病[4]及肉芽肿性肠炎[5],并可使怀孕母猪发生繁殖障碍[6]。副猪嗜血杆菌(Hps)是猪上呼吸道的一种常在菌,在猪体免疫力降低时,可能转化为致病菌,引起以纤维素性多发性浆膜炎、关节炎、脑膜炎、高热和高死亡率为特征的全身性疾病[7]。由于病原种类的日趋复杂及饲养管理不当,猪场疫病混合感染的情况普遍存在。hpPRRS和PCV2均是危害我国养猪业的重大疾病,hpPRRS可引发猪体高热、母猪繁殖障碍和仔猪的严重呼吸症状,死亡率很高,并能使猪体免疫受到抑制;单独的PCV2感染虽不致病,但亦可引发猪体免疫抑制;而Hps多发于猪体免疫力降低时,但这种并发或继发感染却使猪群临床症状更加复杂,同时使死亡率大大提高。本研究以2013年10月广西某规模化猪场约6周龄的猪群出现高热、皮肤发绀、呼吸困难、关节炎等症状为案例,进行临床及实验室综合诊断。
1 临床症状及剖检病变
2013年10月,广西省某集约化猪场6周龄左右的保育仔猪突然发病,短时间内发病猪只迅速扩增至200头,发病率高达60%,并呈现继续传染态势。发病初期,以高热、咳嗽、皮红、耳朵发绀、腹股沟淋巴结肿胀为主,几天后仔猪出现呼吸困难,关节肿胀、跛行,皮下水肿。发病猪多数出现全身淋巴结肿大出血,胸腔纤维素性渗出,心包积液,个别剖检病死猪有胸膜粘连现象;肺脏表面有纤维素性渗出物,肺部出血,间质性肺炎,个别肺心叶肉变;个别腹部肠系膜表面有纤维素性渗出;肾、脾脏肿大,表面有纤维素性渗出物;关节液增多,且质地黏稠。
2 实验室诊断
2.1 材料及方法
细菌培养基购自广州环凯公司产品;病毒DNA/RNA抽提试剂盒、细菌基因组DNA抽提试剂盒、RT-PCR一步法试剂盒和ExTaq DNA聚合酶购自TAKARA公司;高致病性猪蓝耳病检测试剂盒购自北京世纪元亨公司,所用各种引物均为本实验室设计合成。
2.2 细菌检测
无菌采集病猪心包液,并将心包液、关节液、肺脏接种于鲜血培养基、麦康凯培养基(MAC)、胰蛋白大豆琼脂(TSA)培养基上,37℃温箱中培养24~48小时。挑取单菌落涂片,进行革兰氏染色和瑞氏染色镜检。挑取单菌落接种至液体培养基进行纯化培养,利用细菌DNA抽提试剂盒提取分离培养物的总DNA,应用PCR方法检测副猪嗜血杆菌。
2.3 病毒核酸检测
选取具有典型病变特征的肺脏、淋巴结、扁桃体、脾脏等脏器进行研磨处理后,利用TAKARA MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒进行病毒DNA和RNA的抽提,采用PCR和RT-PCR方法对PCV2、hpPRRSV、PRSV、CSFV进行检测。
3 结果
3.1 细菌检测结果
经接种培养,在TSA培养基上长出一些小而透明的菌落,其余培养基无菌落生长。染色镜检显示,生长菌为革兰氏阴性的小杆菌,瑞氏染色两极浓染。细菌分离纯化后,抽提DNA进行副猪嗜血杆菌PCR检测,结果显示,被检样品在相应位置出现620 bp的阳性扩增条带(图1a),与预期片段大小相符,说明分离细菌为副猪嗜血杆菌。
3.2 病毒核酸检测结果
分别以提取的病毒DNA或RNA及PCV2、PRV、hpPRRSV、CSFV特异性检测引物或试剂盒进行PCR或RT-PCR反应。结果显示:PCV2引物的PCR扩增出773 bp的阳性条带,hpPRRSV试剂盒的RT-PCR扩增出272 bp的阳性条带,均与预期片段大小相符;而PRV、CSFV检测无阳性条带出现,为阴性(图1)。
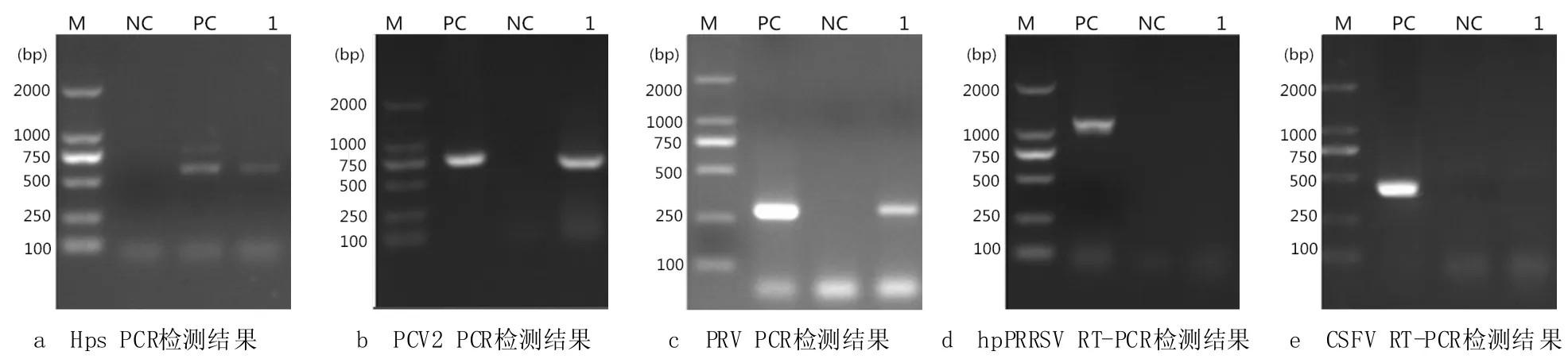
图1 PCR/RT-PCR的实验室检测结果
4 讨论
分子生物学诊断技术的应用为疫病的快速确诊提供了捷径,尤其是PCR方法的应用,已经成为现今最简单、最便捷的分子生物学诊断方法。本次疫情就是在结合发病情况、临床症状、剖检病变的基础上,根据实验室PCR诊断结果,确诊本次广西省某集约化猪场发生的疫情为高致病性猪繁殖与呼吸综合征病毒、圆环病毒2型和副猪嗜血杆菌的混合感染。
近年来,由于多种原因,集约化猪场各种混合感染的疫情屡见不鲜,且多以各种形式存在,以PRRSV、PCV2、PRV、CSFV混合感染为主,给临床病原学的确诊和防治增加了一定难度,并影响了我国现代养猪业的健康快速发展。尤其2006年高致病性猪蓝耳病暴发以来,该病给我国养猪业造成了重大损失,由此引起的猪群免疫力低下、免疫抑制,极易造成猪群的混合感染和继发感染。
目前,对混合感染疫病只能通过合理的免疫程序、采取一定的综合防治措施、强化卫生消毒、加强饲养管理、严格控制引种和“全进全出”来防控;同时定期进行免疫抗体水平监测,提高免疫效果和猪群对疫病的抵抗力。
[1]陈瑞爱,裴仉福,罗满林.高致病性猪繁殖与呼吸综合征活疫苗的免疫效果观察[J].中国动物保健,2009(7):83-86.
[2]刘永宏,赵丽,刘俊峰,等.高致病性猪繁殖与呼吸综合征病毒BJBLZ株序列剖析[J].生物技术通讯,2011(10):185-190.
[3]朗洪武,程君生,张广川.猪断奶后多系统衰竭综合征[J].中国兽医杂志,2000(1):39-42.
[4]Cheng CC,Lee YF,Lin NN,et al.Bronchiolitis obliterans organizing pneumonia in swine associated with porcine circovirus type2infection[J].JBiomedBiotechnol2011.doi: 10.1155/2011/245728.
[5]Kim J,Ha Y,Jung K,et al.Enteritis associated with porcine circovirus 2 in pigs[J].Can J Vet Res,2004(68):218-221.
[6]Chae C.A review of porcine circovirus 2-associated syndromes and diseases[J].Vet J.2005,169(3):326-336.
[7]赵德明,张仲秋,沈建忠,译.猪病学[M].第九版.北京:中国农业大学出版社,2009:769-782.
S858.28
B
1673-4645(2014)10-0051-03
2014-05-19
广东省农业科技重大技术研究项目(粤财农[2013]185号)
*通讯作者:贺东生,博士,研究方向为兽医传染病

