高尿酸通过miR-663下调转化生长因子β1抑制内皮细胞迁移
于善栋,洪 权,傅 博,陈香美,吴 镝
解放军总医院 肾脏病科暨肾脏疾病国家重点实验室,北京 100853
高尿酸通过miR-663下调转化生长因子β1抑制内皮细胞迁移
于善栋,洪 权,傅 博,陈香美,吴 镝
解放军总医院 肾脏病科暨肾脏疾病国家重点实验室,北京 100853
目的 探讨高尿酸通过miR-663影响内皮细胞迁移功能的机制。方法培养人脐静脉内皮细胞系(EA.hy926),用600μmol/L尿酸孵育48 h,实时定量PCR检测miR-663的水平,并检测高尿酸患者血清中miR-663水平;利用双荧光素酶试验预测并验证miR-663的靶基因;检测高尿酸条件下内皮细胞中转化生长因子β1(transforming growth fator beta 1,TGF-β1)的表达水平,利用miR-663抑制物、TGFB1 siRNA转染及划痕实验观察高尿酸如何通过miR-663及其靶基因影响内皮细胞的迁移功能。结果高尿酸培养条件下内皮细胞中miR-663表达水平明显升高,高尿酸血症患者血清中miR-663的水平也高于正常人;双荧光素酶试验结果表明TGFB1的翻译水平受miR-663直接调控;高尿酸能明显抑制细胞的迁移能力,而高尿酸条件下TGF-β1的表达水平也明显下降,转染miR-663抑制物后,TGF-β1表达水平升高,内皮细胞迁移能力也明显改善,但是利用siRNA抑制TGF-β1的表达后,miR-663抑制物不能再促进内皮细胞的迁移。结论高尿酸通过miRNA-663下调TGF-β1而抑制细胞迁移。
高尿酸;内皮细胞迁移;miRNA-663;转化生长因子β1
大量研究表明高尿酸血症是慢性肾病(chronic kidney disease,CKD)与心血管疾病(cadiovascular disease,CVD)的独立危险因素[1-4]。而目前关于高尿酸血症引起心血管和肾损伤的机制研究还处于初步阶段,内皮细胞功能受损可能是其中的重要环节。microRNA(miR)是一类小的非编码RNA,长度为18 ~ 22 nt,其参与了众多生理和病理生理活动的调控[5]。已有一些研究显示高尿酸能够引起内皮功能损伤[6-7]。有研究表明miRNAs在某些情况下参与了内皮细胞损伤的过程,但在高尿酸条件下是否有miRNAs参与内皮细胞损伤过程尚不清楚[8]。我们前期的miRNA芯片结果显示在高尿酸条件下,内皮细胞中有多个miRNA出现表达差异,其中miR-663表达差异最明显,在高尿酸条件下,miR-663表达水平明显高于正常水平。Neth等[9]报道miR-663的高表达可以引起内皮细胞一系列病理生理改变。我们利用Targetscan查找miR-663的靶基因,其中转化生长因子β1(transforming growth fator beta 1,TGF-β1)与细胞迁移功能有关,其表达产物TGF-β1能够促进内皮细胞迁移[10-11]。本研究对高尿酸通过miR-663调控TGFB1影响内皮细胞迁移的假说进行验证,并为未来预防和治疗高尿酸血症引起的内皮功能损伤提供依据。
材料和方法
1 主要材料 人脐静脉内皮细胞系(EA.hy926)(购自美国ATCC,No.CRL-2922);脂质体转染试剂Lipofectamine 2000、Trizol试剂盒、M-MLV逆转录试剂盒(购于美国Invitrogen公司);miR-663抑制物(miR-663 inhibitor)(购于美国Life Technologies公司)(Cat. # 4464084),TGFB1 siRNA(购于美国Santa Cruz公司)(sc-44146),miR-663模拟物(miR-663 mimics,序列AGGCGGGGCGCCGCGGGACCGC),U6和cel-mir-39的Real time PCR引物、siRNA(购自上海吉玛制药技术有限公司);定量PCR试剂盒(购自日本Toyobo公司);TGF-β1多克隆抗体(购自美国Abcam公司);细胞培养试剂(购自美国GIBCO公司);双荧光素酶报告质粒(购于美国Promega公司);QuickChange定点突变试剂盒(购自美国Agilent Technologies公司)。
2 细胞培养 人脐静脉内皮细胞系(EA.hy926)用含10% FBS的低糖DMEM培养基,在37℃、5% CO2、饱和湿度孵箱中培养。
3 实时定量PCR检测miR-663的表达 细胞接种到10 cm的培养皿中,分为对照组和高尿酸组(600 μmol/L)。培养48 h后,提取细胞及患者总RNA,用miR-663特异性的反转录引物(5’→3’引物序列AGGCGGGGCGCCGCGGGACCGC),U6作为细胞内RNA定量的参照物,cel-mir-39作为血清RNA定量的参照物,参照M-MLV逆转录试剂盒说明书进行反转录,条件为:16℃ 30 min,42℃ 30 min,95℃ 10 min。标本置于-20℃保存备用。采用Rotor Gene3000荧光定量PCR仪行Real time PCR检测miR-663表达情况。反应条件:50℃ 2 min,95℃ 10 min,95℃ 4 s,57℃ 30 s,共40个循环。每组设3个复孔。以△CT值作为MicroRNA-663的相对表达量,△CT=CT663-CTU6,以2-△△CT进行差异比较。
4 双荧光素酶报告质粒的构建与检测 利用PCR将TGFB1(NM_000660.5)3’-UTR区包含的miR-663的结合序列(CCCCGCC Position 13-19和18-24 of TGFB1 3’UTR)克隆到双荧光素酶报告质粒psiCHECKTM-2中,得到psiCHECK-WT-TGFB1质粒,然后利用QuikChange®定点突变试剂盒将TGFB1 3’-UTR区的与miR-663结合的核心序列突变为TTTTATT,克隆到psiCHECKTM-2质粒中,得到psiCHECK-MT-TGFB1质粒。psiCHECKWT-TGFB1、psiCHECK-MT-TGFB1分别与miR-663模拟物或miRNA control共转染内皮细胞。每组设3个复孔。转染48 h后,PBS液洗涤细胞2次。吸尽残液,加入100 μl 1×PLB裂解液室温裂解细胞15 min。取20 μl裂解上清加入96孔白板,然后加入30 μl LARⅡ,混匀后立即在荧光/化学发光仪上检测Firefly荧光素酶活性(F值);再加入30 μl 1×Stop&Glo溶液检测Renilla荧光素酶活性(R值),Renilla活性与Firefly活性的比值即为报告基因的相对表达水平。实验共重复3次。
5 患者选择和血清中RNA的提取 选择2010 -2013年本院30例高尿酸血症男性患者和30例健康男性,检测血清中的miR-663水平。所有患者及健康者均签署知情同意书。取静脉血分离血清后,用TRIzol试剂盒提取血清中的RNA。
6 Western blot 用RIPA裂解液提取EA.hy926细胞总蛋白,BCA法测定蛋白浓度。蛋白变性后取40 μg进行SDS-PAGE电泳。50 mA恒流半干转至纤维素膜,室温封闭1 h。按照抗体说明书分别加抗TGF-β1抗体、抗β-actin抗体4℃过夜孵育。用TBST洗膜,加二抗室温孵育1 h。洗膜后显影,用Image J软件分析并计算各组吸光度与β-actin吸光度的比值,获取蛋白表达水平。
7 划痕实验 EA.hy926细胞接种至6孔板中,待每孔中细胞铺满后用白枪头在沿着孔的直径划一直线。细胞分为2组,每组3个复孔,对照组用无血清的低糖DMEM培养基培养,实验组在无血清的低糖DMEM培养基中加入尿酸,终浓度为600 μmol/L,培养12 h后在显微镜下观察并用OLYMPUS DP2-BSW测量划痕两侧细胞的距离。
8 小RNA转染 细胞长至50% ~ 70%时进行转染,用无血清的低糖DMEM稀释待转染的RNA,将待转染的RNA与Lipofectamine 2000混匀,放置15 min后转染细胞,在细胞培养箱中培养5 h后,更换含血清的低糖DMEM培养基继续培养。
9 统计学处理 利用SPSS17.0.2进行统计学分析,数据以表示,用单因素方差分析比较多组间差异。P<0.05为差异有统计学意义。
结 果
1 miR-663表达情况 利用荧光定量PCR检测高尿酸刺激的内皮细胞和正常培养条件下的内皮细胞中miR-663的表达水平,结果显示高尿酸刺激的内皮细胞中miR-663表达水平明显高于正常培养条件下的内皮细胞(P<0.05)(图1A),与miRNA芯片结果一致。高尿酸血症病人血清中miR-663的水平明显高于正常人(P<0.05)(图1B)。

图 1 高尿酸刺激的内皮细胞(A)和高尿酸血症患者血清(B)中miR-663的表达水平 aP<0.05,与对照组比较;bP<0.05,与对照组比较(单因素方差分析)Fig. 1 Expression level of miRNA-663 in high UA concentrationstimulated endothelial cells (A) and hyperuricemia patients (B) aP<0.05,bP<0.05, vs control group(ANOVA)
2 miR-663靶基因验证 高表达miR-663能够引起内皮细胞一系列的病理生理变化,因此我们推测miR-663在高尿酸导致的内皮细胞功能紊乱中发挥了重要作用[9]。利用miRNA靶基因预测软件Targetscan(version 6.2)预测miR-663的靶基因,其中TGFB1与内皮细胞的迁移功能有关,其表达产物TGF-β1能够促进内皮细胞迁移[10-11]。为了验证TGFB1是否为miR-663的靶基因,我们进行了双荧光素酶试验。实验结果显示miR-663模拟物可以显著下调psiCHECK-WT-TGFB1的荧光素酶活性(P<0.05),而miR-663抑制物可以显著上调内皮细胞psiCHECK-WT-TGFB1的荧光素酶活性(P<0.05),但miR-663模拟物和miR-663抑制物对突变质粒psiCHECK-MT-TGFB1荧光素酶活性影响不明显(图2)。这表明miR-663能够特异性地与TGFB1 mRNA作用并在转录后水平抑制TGFB1的表达。
3 高尿酸通过miR-663调控内皮细胞迁移的机制在高尿酸条件下,内皮细胞的迁移能力明显低于正常培养条件下内皮细胞的迁移能力(P<0.05),而高尿酸条件下内皮细胞TGF-β1表达水平明显下降(P<0.05)。当我们用miR-663抑制物抑制miR-663的表达后,TGF-β1的表达水平明显升高,内皮细胞的迁移能力也明显增强(P<0.05)(图3A)。然而,利用siRNA抑制TGFB1的表达后,miR-663抑制物无法再明显促进内皮细胞的迁移(P>0.05) (图3B)。这些结果说明,高尿酸通过miR-663下调TGFB1而抑制内皮细胞迁移。

图 2 双荧光素酶试验(aP<0.05,bP<0.05,与miRNA对照组比较Fig. 2 Dual luciferase assay (aP<0.05,bP<0.05, vs miRNA control group)
讨 论
许多研究显示,血尿酸水平与多种疾病,如冠心病、高血压、糖尿病的预后呈负相关关系[12-15]。尽管已经有研究表明高尿酸能够引起内皮功能紊乱,但是miRNAs在这个过程中是否发挥作用仍不是很清楚[6]。miR-663是高尿酸条件下内皮细胞中表达差异最显著的miRNA,因此我们推测miR-663在高尿酸导致内皮功能紊乱过程中发挥了重要作用。本实验利用qRT-PCR证实了内皮细胞中的miR-663在高尿酸条件下表达水平明显高于正常培养条件下内皮细胞中miR-663的水平。通过双荧光素酶实验及划痕实验,我们证实了高尿酸通过上调miR-663调控TGFB1从而抑制内皮细胞迁移的猜测。高尿酸血症患者血清中的miR-663水平也明显高于正常人,这说明在高尿酸患者体内可能也存在这种现象。内皮细胞迁移在损伤修复和血管新生中发挥重要作用,根据我们的实验结果,我们认为高尿酸血症患者体内可能会出现血管新生受抑制和损伤修复的延迟,这种情况会导致心血管疾病及其他疾病的发生。在TGF-β1的下游,还有许多分子参与内皮细胞的迁移,PTEN是TGF-β1调控的磷酸化酶,其能够激活一系列下游分子影响内皮细胞迁移。Choorapoikayil等[16],Bhattacharya等[17]、Huang和Kontos[18]报道了抑制PTEN能够激活VEGF通路促进内皮细胞迁移,而Wang等[11]和Ma等[19]报道了PTEN通过抑制AKT通路抑制细胞迁移,在高尿酸条件下TGF-β1通过何种通路影响细胞迁移还需要进一步的研究。总之,我们的研究结果阐明了高尿酸影响内皮功能的新机制,为将来预防和治疗高尿酸血症引起的内皮功能紊乱提供了新的治疗思路和靶点。
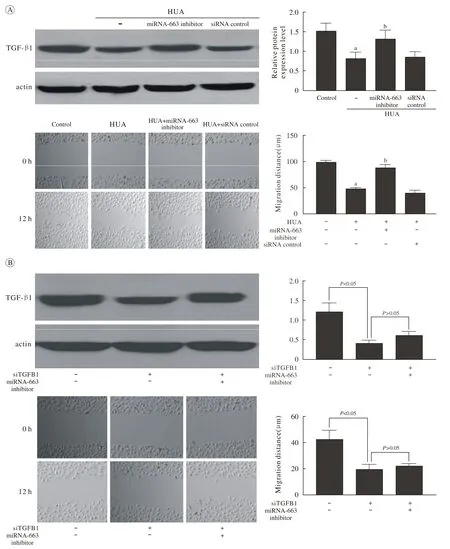
图 3 高尿酸影响内皮细胞迁移功能的机制(划痕实验与蛋白印迹法) A: 高尿酸通过miR-663影响TGF-β1的表达和内皮细胞迁移(aP<0.05,bP<0.05, 与对照组比较; B: 高尿酸条件下,miR-663通过TGF-β1调控内皮细胞迁移(单因素方差分析)Fig. 3 Scratch test and Western blot showing mechanism of high UA concentration underlying endothelial cell migration A: Effect of high UA concentration on TGF-β1expression and endothelial cell migration via miR-663 (aP<0.05,bP<0.05, vs control group); B: Effect of miR-663 on migration of endothelial cells cultured with high UA concentration via regulation of TGF-β1expression (ANOVA)
1 Weng SC, Shu KH, Wu MJ, et al. Hyperuricemia predicts kidney disease progression after acute allograft dysfunction[J]. Transplant Proc, 2014, 46(2): 499-504.
2 Viazzi F, Garneri D, Leoncini G, et al. Serum uric acid and its relationship with metabolic syndrome and cardiovascular risk profile in patients with hypertension: Insights from the I-DEMAND study[J/OL]. http://www.sciencedirect.com/science/article/pii/S0939475314000519.
3 Grassi D, Desideri G, Di Giacomantonio AV, et al. Hyperuricemia and cardiovascular risk[J/OL]. http://link.springer.com/article/10.1007%2Fs40292-014-0046-3.
4 Grassi D, Ferri L, Desideri G, et al. Chronic hyperuricemia, uric acid deposit and cardiovascular risk[J]. Curr Pharm Des, 2013,19(13): 2432-2438.
5 Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
6 Hong Q, Qi K, Feng Z, et al. Hyperuricemia induces endothelial dysfunction via mitochondrial Na+/Ca2+ exchanger-mediated mitochondrial Calcium overload[J]. Cell Calcium, 2012, 51(5):402-410.
7 Choi YJ, Yoon Y, Lee KY, et al. Uric acid induces endothelial dysfunction by vascular insulin resistance associated with the impairment of nitric oxide synthesis[J/OL]. http://www.fasebj.org/content/early/2014/03/20/fj.13-247148.1.long.
8 Palmieri D, Capponi S, Geroldi A, et al. TNFα induces the expression of genes associated with endothelial dysfunction through p38MAPK-mediated down-regulation of miR-149[J]. Biochem Biophys Res Commun, 2014, 443(1):246-251.
9 Neth P, Nazari-Jahantigh M, Schober A, et al. MicroRNAs in flowdependent vascular remodelling[J]. Cardiovasc Res, 2013, 99(2):294-303.
10 Petzelbauer E, Springhorn JP, Tucker AM, et al. Role of plasminogen activator inhibitor in the reciprocal regulation of bovine aortic endothelial and smooth muscle cell migration by TGF-beta 1[J]. Am J Pathol, 1996, 149(3): 923-931.
11 Wang J, Wang Y, Wang Y, et al. Transforming growth factor β-regulated microRNA-29a promotes angiogenesis through targeting the phosphatase and tensin homolog in endothelium[J]. J Biol Chem, 2013, 288(15): 10418-10426.
12 Ficociello LH, Rosolowsky ET, Niewczas MA, et al. High-normal serum uric acid increases risk of early progressive renal function loss in type 1 diabetes: results of a 6-year follow-up[J]. Diabetes Care, 2010, 33(6): 1337-1343.
13 Causevic A, Semiz S, Macic Dzankovic A, et al. Relevance of uric Acid in progression of type 2 diabetes mellitus[J]. Bosn J Basic Med Sci, 2010, 10(1): 54-59.
14 Puig JG, Torres RJ, Ruilope LM, et al. The pathophysiology of hyperuricemia in essential hypertension: a pilot study[J]. Nucleosides Nucleotides Nucleic Acids, 2004, 23(8/9): 1197-1199.
15 Wiik BP, Larstorp AC, Høieggen A, et al. Serum uric acid is associated with new-onset diabetes in hypertensive patients with left ventricular hypertrophy: The Life Study[J]. Am J Hypertens,2010, 23(8): 845-851.
16 Choorapoikayil S, Weijts B, Kers R, et al. Loss of Pten promotes angiogenesis and enhanced vegfaa expression in zebrafish[J]. Dis Model Mech, 2013, 6(5): 1159-1166.
17 Bhattacharya D, Singh MK, Chaudhuri S, et al. T11TS impedes glioma angiogenesis by inhibiting VEGF signaling and pro-survival PI3K/Akt/eNOS pathway with concomitant upregulation of PTEN in brain endothelial cells[J]. J Neurooncol, 2013, 113(1): 13-25.
18 Huang J, Kontos CD. PTEN modulates vascular endothelial growth factor-mediated signaling and angiogenic effects[J]. J Biol Chem,2002, 277(13): 10760-10766.
19 Ma J, Sawai H, Ochi N, et al. PTEN regulates angiogenesis through PI3K/Akt/VEGF signaling pathway in human pancreatic Cancer cells[J]. Mol Cell Biochem, 2009, 331(1/2): 161-171.
High uric acid concentration inhibits endothelial cell migration by down-regulating TGF-β1expression via miRNA-663
YU Shan-dong, HONG Quan, FU Bo, CHEN Xiang-mei, WU Di
Department of Nephrology, State Key Laboratory of Kidney Diseases, Chinese PLA General Hospital, Beijing 100853, China
WU Di. Email:wudi@301hospital.com.cn
ObjectiveTo study the mechanism of high uric acid (UA) concentration underlying endothelial cell migration via miRNA-663.MethodsEA.hy926 cells were incubated in 600 μmol/L uric acid for 48 h. Serum miRNA-663 level in patients with high UA concentration was measured by RT-PCR. The miRNA-663 target gene was identifed by dual luciferase assay. TGF-β1expression level in endothelial cells was measured. Effect of high UA concentration on endothelial cell migration via miRNA-663 was detected by miR-663 inhibitor and TGF-β1siRNA transfection and scratch test, respectively.ResultsThe expression level of miRNA-663 was signifcantly higher in endothelial cells after cultured with high UA concentration than before cultured with high UA concentration. The serum miRNA-663 level was signifcantly higher in hyperuricemia patients than in normal subjects. Dual luciferase assay showed that miRNA-663 directly regulated the TGFB1 translation level. Scratch test revealed that high UA concentration signifcantly inhibited the endothelial cell migration and down-regulated the TGF-β1expression level. The TGF-β1expression level elevated and the endothelial cell migration increased after the miRNA-663 inhibitors were transfected. However, the miRNA-663 inhibitors could not promote endothelial cell migration when the TGF-β1expression was inhibited by siRNA.ConclusionHigh UA concentration inhibits endothelial cell migration by down-regulating TGF-β1expression via miRNA-663
hyperuricemia; endothelial cell migration; miRNA-663; TGF-β1
R 543
A
2095-5227(2014)07-0733-05
10.3969/j.issn.2095-5227.2014.07.024
时间:2014-04-11 17:25
http://www.cnki.net/kcms/detail/11.3275.R.20140411.1725.007.html
2014-03-19
国家自然科学基金面上项目(31170810;81102673);北京科技新星计划(Z121107002512078)
Supported by the National Natural Science Foundation of China(31170810; 81102673)
于善栋,男,在读硕士。Email:alexyu_0507@163.com
吴镝,主任医师。Email:wudi@301hospital.com.cn

