西妥昔单抗转化性治疗大肠癌肝转移患者的临床观察
秦 锐,石 燕,陈 丽,吴志勇,韩雅琳,戴广海
解放军总医院 肿瘤内二科,北京 100853
西妥昔单抗转化性治疗大肠癌肝转移患者的临床观察
秦 锐,石 燕,陈 丽,吴志勇,韩雅琳,戴广海
解放军总医院 肿瘤内二科,北京 100853
目的 观察西妥昔单抗联合化疗转化性治疗初始不可切除KRAS基因野生型结直肠癌肝转移患者的疗效及安全性,探讨与预后可能相关的因素。方法收集2007年5月- 2012年5月我院仅有肝转移的KRAS野生型结直肠癌患者,外科评估无法行手术治疗,经西妥昔单抗联合化疗转化治疗后疗效评价为CR+PR+SD,并接受原发肿瘤病灶根治术,同时行或不行转移灶手术治疗的患者18例。总结评估其转化治疗疗效和安全性,回顾性分析各临床病理因素与预后关系。结果西妥昔单抗中位治疗时间12周,其中CR 0例,PR 11例。18例经过转化性治疗后,均接受了手术治疗,原发灶切缘无癌细胞(R0)切除18例;肝转移病灶R0切除11例,局部治疗7例。生存分析显示:18例中,12例出现复发转移,5例死亡。中位无进展生存期(progression free survival,PFS)为20.80个月,总生存时间(overall survival,OS)为9.59 ~ 37.13个月。单因素分析显示:肝转移病灶数目、大小、治疗前的CEA状态、治疗后早期肿瘤缓解与患者PFS相关,差异有统计学意义(P<0.05)。结论对于KRAS野生型大肠癌肝转移患者,西妥昔单抗联合多种化疗方案转化性治疗安全有效,提高了肝转移灶R0切除率,使其生存获益。
西妥昔单抗;大肠癌;肝转移;联合化疗;转化治疗
结直肠癌是最常见的恶性肿瘤之一。约25%的结直肠癌患者首次就诊时就已经出现肝转移,其中60%除肝外无其他远处部位转移,因此如何提高结直肠癌肝转移患者的生存状况是当前研究热点[1-2]。多学科团队(multidisciplinary team, MDT)治疗模式是目前肿瘤治疗的常见模式。2013年最新修订的结直肠癌肝转移诊断和综合治疗指南规定,通过MDT对结直肠癌肝转移患者进行全面评估,针对不同的治疗目标,将患者分为4组[3]。其中,组1病人是指初始肝转移病灶不可切除的大肠癌患者,病灶经过一定的治疗有望转为可以R0切除,且病人全身情况能够接受转移灶的切除手术和高强度的治疗。针对这类病人,治疗的目的主要是最大程度地缩小瘤体或增加残存肝体积,可采取最积极的综合治疗手段,以期达到转移病灶的转化性切除。常规转化性化疗中主要使用的化疗药物是5-FU、奥沙利铂、伊立替康等,但有效率较低,转化治疗时间较长,耐受性较差。随着靶向药物研究的不断进展,西妥昔单抗目前已被美国FDA及中国SFDA正式批准用于KRAS野生型晚期结直肠癌的治疗[4]。近年来多项研究证实其与传统的化疗方案联合可以提高一线治疗的有效率。本研究收集整理我院西妥昔单抗联合化疗转化性治疗初始转移病灶不可切除KRAS基因野生型结直肠癌肝转移患者的临床资料,回顾性分析其疗效、联合用药、手术转化率及其对预后的影响,以期总结积累对结直肠癌肝转移患者转化性治疗的临床经验。
资料和方法
1 一般资料 收集2007年5月- 2012年5月我院经病理组织学确诊为结直肠癌,未接受过任何形式的放化疗,且通过CT或MRI检查证实仅存在肝转移病灶的患者,其最大转移病灶≤10 cm,且无主要血管侵犯,但经外科评估后无法行手术切除。预计生存期>3个月,ECOG评分0 ~ 2分,心、肺、肝、肾、骨髓、凝血功能无明显异常,签署知情同意书。所有患者KRAS基因检测(12、13、61位点)均为野生型,接受西妥昔单抗联合化疗治疗至少3周期,且疗效评价为完全缓解(complete remission,CR)+部分缓解(partial remission,PR)+病情稳定(stable disease,SD)的患者,并在转化治疗后接受原发肿瘤病灶根治术,同时行或不行转移灶手术治疗。
2 治疗方法 西妥昔单抗(C225,默克雪兰诺有限公司)按首剂为400 mg/m2,输注时间为120 min,此后每周250 mg/m2或每2周500 mg/m2,输注时间为60 min。治疗前预防抗过敏处理。联合化疗方案包括:FOLFIRI(伊立替康180 mg/m2,d1;亚叶酸钙200 mg/m2,d1 ~ d2;氟尿嘧啶200 mg/m2,d1 ~ d2,600 mg/m248 h,2周为1个周期);FOLFOX (奥沙利铂85 mg/m2;亚叶酸钙200 mg/m2;氟尿嘧啶200 mg/m2,d1 ~ d2,600 mg/m248 h,2周为1周期),XELOX(奥沙利铂130 mg/m2,d1;卡培他滨片850 ~ 1 000 mg/m2,d1 ~ d14;3周为1周期)。评价转移灶是否可切除,如果可切除则行原发肿瘤病灶及转移病灶切除;如仍无法切除,则切除原发灶,择期治疗转移灶。手术时机一般选择治疗3周期或6周期后。
3 不良反应 每完成1周期化疗后进行不良反应评价。不良反应按照美国国立癌症研究所通用毒性反应标准(NCI-CTC 3.0)评价,分为1 ~ 4级。对于所出现的皮疹、肝损伤、骨髓抑制、腹泻等对症处理。
4 疗效及生存评估 患者每接受西妥昔治疗6周后评估疗效。近期疗效评价按实体肿瘤疗效评价标准(RECIST 1.1)分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、病情进展(progression disease,PD)和病情稳定(stable disease,SD)。有效率(ORR)以CR+PR计算,疾病控制率(DCR)以CR+PR+SD计算。无进展生存时间(progression free survival,PFS)是自开始治疗至肿瘤进展的时间;总生存时间(overall survival,OS)是自开始治疗至患者死亡或随访截止时间。早期肿瘤缓解为自接受西妥昔单抗联合化疗一线治疗6周后复查达到PR者。
5 统计方法 采用SPSS19.0统计学软件。Kaplan-Meier生存分析描绘生存曲线,单因素生存分析采用Log-rank检验。多因素生存分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
结 果
1 一般资料 纳入符合条件患者共18例,中位年龄为52.5(29 ~ 69)岁,其中男性12例,女性6例。ECOG评分0 ~ 1分者16例,2分者2例。低分化腺癌及黏液腺癌5例,中分化腺癌7例,高分化腺癌6例。治疗达到早期肿瘤缓解者9例,未达到者9例。见表1。
2 疗效分析 西妥昔单抗中位治疗时间为12周(6 ~24周),18例均可评价疗效,其中CR者0例,PR者11例,SD者7例,客观有效率61.1%(11/18)。各方案有效例数见表2。
3 手术情况 18例经过转化性治疗后,均接受了手术治疗。1例患者在行3周期西妥昔单抗联合FOLFOX方案(西妥昔单抗治疗6周)后行手术治疗,其余在西妥单抗治疗12周之后行手术治疗。结直肠癌原发灶和肝转移灶同步切除11例;先手术切除结直肠原发灶,再局部处理肝病灶(包括TACE、射频消融等)7例。原发灶R0切除18例;肝转移病灶R0切除11例,局部治疗者7例。
4 手术后治疗情况 术后18例无出血、感染、肝功能异常等并发症。1例因术后体质状况不佳,改为单药口服卡培他滨片,联合免疫及中药治疗。其余继续行西妥昔单抗联合与术前相同的化疗方案治疗至少12周。

表1 临床资料及PFSTab. 1 Clinical data and PFS (progression-free survival) (Md)
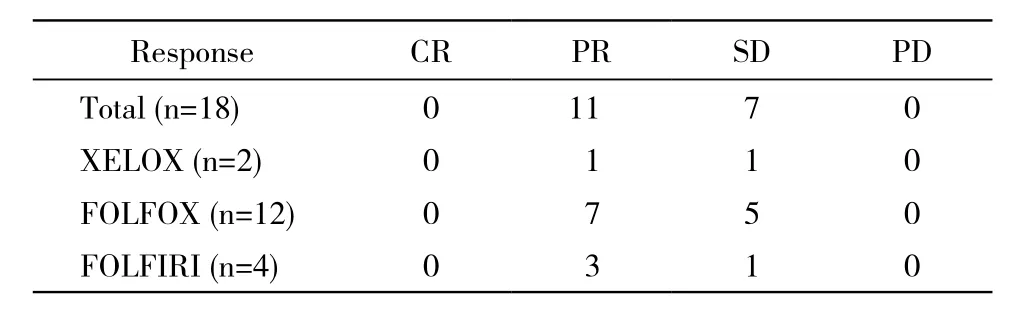
表2 不同联合化疗方案的疗效评价Tab. 2 Evaluation of different combined chemotherapy
5 生存分析 随访日期截止至2013年10月10日。18例中,12例复发转移,5例死亡。中位无进展生存期为20.80个月(95%CI:8.45 ~ 33.14)(图1)。总生存时间OS为9.59 ~ 37.13个月。见图2。
6 单因素生存分析 肝转移病灶数目、肝转移病灶大小、治疗前的CEA状态与PFS显著相关;达到早期肿瘤缓解者与未到达早期肿瘤缓解者相比,PFS显著延长(PFS:23.82个月vs 11.30个月,P=0.031,χ2=4.628),差异有统计学意义。其他如年龄、性别、肿瘤部位、病理分型、联合方案、西妥昔使用时间等与PFS无明显相关。见表1。
7 不良反应 治疗期间西妥昔单抗不良反应主要为:痤疮样皮疹12例,主要集中在面颈部及后背,少数出现在下肢及足部,多在靶向治疗后2周后出现。联合化疗相关的不良反应主要为:恶心呕吐7例,腹泻3例,血液毒性方面,白细胞下降1 ~2度9例,3 ~ 4度3例,血小板下降3例,术前化疗出现肝功能异常2例,术后出现肝功能异常5例,神经毒性、口腔黏膜炎和其他不良反应少见,上述不良反应经对症处理后,均可耐受。
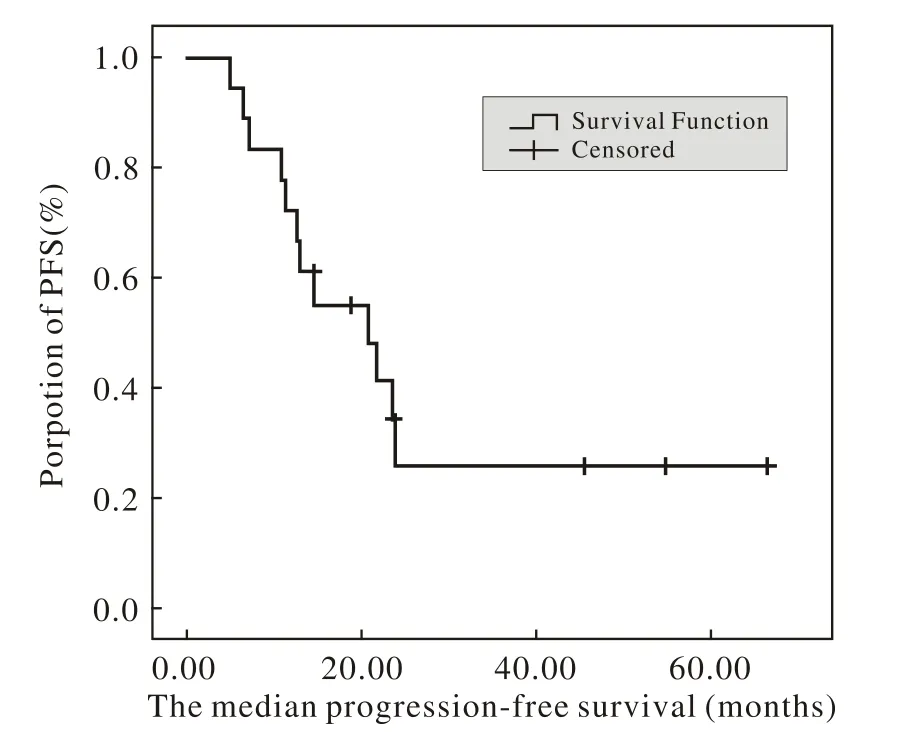
图 1 无进展生存曲线Fig. 1 Median progression-free survival (PFS)

图 2 总生存曲线Fig. 2 Median overall survival (OS)
讨 论
大肠癌肝转移是晚期大肠癌的特殊类型,传统的观点认为Ⅳ期不宜行手术切除,但多项临床研究证实,如能对原发灶及肝转移灶手术根治性切除,可将患者的5年生存率提高至40%左右[5]。但在初诊为大肠癌肝转移的患者中,仅有10% ~25%能手术根治性切除,多数患者因为各种原因初诊无法手术,但部分经成功转化治疗后仍能达到根治切除[6]。
临床研究证明,术前的转化性治疗能缩小原发肿瘤或转移灶,降低肿瘤分期,使原来不能切除的肝转移灶变为可切除,远期生存与最初能够切除的患者相近[7]。Adam等[8]研究发现,术前接受转化性治疗可以将大肠癌肝转移患者的不可切除病灶转为可切除病灶并接受手术治疗,5年和10年生存率分别为33%和23%,预后明显优于未行手术治疗组。

表3 西妥昔单抗治疗结直肠癌肝转移临床试验总结Tab. 3 Summary of the clinical trials by investigating the effcacy of cetuximab combined with chemtheray in patients with mCRC
Kopetz等[9]研究中指出,不可切除的大肠癌肝转移患者是否能在12个月内转化为可切除病灶并行相关根治手术显著影响患者预后。因此如何在短时间内提高转化性治疗的有效率是目前治疗的热点及难点。近来随着西妥昔单抗靶向药物的广泛应用,多个临床研究证实其联合化疗与单纯化疗相比可提高大肠癌肝转移患者的疗效,其RR率可提高至40% ~ 70%,而R0切除率由原来的11%提高至58%[10]。西妥昔单抗联合化疗转化性治疗转移性结直肠癌疗效及预后相关文献见表3。本研究选取了初始不可切除的KRAS野生型的大肠癌肝转移患者,且经西妥昔单抗联合化疗治疗有效者18例,其中原发灶R0切除18例;肝转移病灶R0切除11例,局部治疗7例。中位PFS为20.80个月,肝转移灶R0手术中位PFS为23.52个月,其结果与国内外报道大致相似,其总RR率较高,R0切除率及中位PFS与其他文献报道比较相对较高[11-16]。西妥昔单抗与多种化疗联合参与大肠癌肝转移患者的转化性治疗,都展现了较好的疗效,且不良反应可耐受。
对于初始不可切除的结肠癌肝转移患者预后生存的影响病理因素很多,Arru等[1]通过对结肠癌肝转移患者研究发现,患者年龄、手术切缘状况、初诊时结直肠癌分期、转移病灶的数量、最大转移病灶大小、术前CEA水平是否>200 μg/ml等因素与患者的临床预后明显相关,没有上述因素的患者术后5年生存率可达60%以上,而包含有全部上述临床病理因素的患者术后5年生存率仅有12%。多家研究机构也进一步证实上述结论[17]。从本研究结果可以看出,转移灶的数目、大小及初诊时CEA的状态是否>200 μg/ml与患者的PFS有可能相关。近来有研究指出CEA在结肠癌肝转移患者治疗前后下降程度与患者预后生存相关,这有待于进一步研究证实。
PIessevaux等[18]研究表明,以西妥昔单抗为基础的联合方案治疗转移性结直肠癌,早期肿瘤缩小(ETS)—即第一次CT扫描时(第8周)肿瘤缩小≥20%与是否可行R0切除、疾病进展时间和总生存期之间密切相关[19-20]。其通过对CRYSTAL研究进一步分析表明,西妥昔单抗联合FOLFIRI方案一线治疗KRAS野生型mCRC,达到ETS的患者OS和PFS明显延长,接受西妥昔单抗联合FOLFIRI方案治疗达ETS患者的mOS和mPFS分别为28.3个月和11.8个月,而未达到ETS患者的mOS和mPFS分别为19.6个月和7.3个月,两者有统计学差异(P<0.003和P<0.000 1)[21]。本研究根据我科工作实际情况,设定了与ETS相似的概念-早期肿瘤缓解,即自接受西妥昔单抗联合化疗一线治疗6周后复查达到PR,结果发现,达到早期肿瘤缓解者与未到达早期肿瘤缓解者相比,PFS显著延长(PFS:23.82个月vs 11.30个月,P=0.031,χ2=4.628),两者有统计学差异,提示早期肿瘤缓解与PFS明显相关,也从侧面证实了上述结论,ETS可以作为判断预后的预测因子。但因本研究为回顾性研究,病例选择范围局限,且相关病例数较少,上述结论有一定的局限性,仍需继续进行随访且扩大样本量、进行前瞻性研究证实。
综上所述,对于KRAS野生型的大肠癌肝转移患者,西妥昔单抗联合多种化疗方案均展现了较好的疗效,不良反应可耐受,使得原发灶及转移灶R0切除率明显提高,术后并发症低,让更多大肠癌肝转移患者获得手术切除的机会并生存获益。其术前转移灶的数目、大小及CEA的状态、转化治疗后是否达到早期肿瘤缓解与患者的PFS可能相关。
1 Arru M, Aldrighetti L, Castoldi R, et al. Analysis of prognostic factors influencing long-term survival after hepatic resection for metastatic colorectal cancer[J]. World J Surg, 2008, 32(1):93-103.
2 张斌,王兵济,成远,等. FOLFOX 4 方案联合西妥昔单抗新辅助治疗大肠癌肝转移的临床观察[J]. 临床肿瘤学杂志, 2013,18(9): 812-814.
3 许剑民,任黎.结直肠癌肝转移诊断和综合治疗指南(V2013)[J].中国实用外科杂志,2013,33(8):635-644.
4 李智宇,周志祥.结直肠癌靶向治疗的应用及前景[J].实用肿瘤杂志,2013,28(1):10-14.
5 Juez I, Rubio C, Figueras J. Multidisciplinary approach of colorectal liver metastases[J]. Clin Transl Oncol, 2011, 13(10):721-727.
6 Van Cutsem E, Nordlinger B, Adam R, et al. Towards a pan-European consensus on the treatment of patients with colorectal liver metastases[J]. Eur J Cancer, 2006, 42(14):2212-2221.
7 Fahy BN, D’angelica M, Dematteo RP, et al. Synchronous hepatic metastases from colon Cancer: changing treatment strategies and results of surgical intervention[J]. Ann Surg Oncol, 2009, 16(2):361-370.
8 Adam R, Delvart V, Pascal G, et al. Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long-term survival[J]. Ann Surg, 2004, 240(4): 644-657.
9 Kopetz S, Chang GJ, Overman MJ, et al. Improved survival in metastatic colorectal Cancer is associated with adoption of hepatic resection and improved chemotherapy[J]. J Clin Oncol, 2009, 27(22): 3677-3683.
10 Wagman LD. Importance of response to neoadjuvant therapy in patients with liver-limited mCRC when the intent is resection and/or ablation[J]. Clin Colorectal Cancer, 2013, 12(4):223-232.
11 Kohne C, Bokemeyer C, Folprecht G, et al. Chemotherapy plus cetuximab in patients with liver-limited or non-liver-limited KRAS wild-type colorectal metastases: a pooled analysis of the CRYSTAL and OPUS studies [J/OL]. http://meetinglibrary.asco.org/content/96609-114.
12 Folprecht G, Gruenberger T, Bechstein W, et al. Survival with cetuximab/ FOLFOX or cetuximab/FOLFIRI of patients with nonresectable colorectal liver metastases in the CELIM study[J/ OL]. http://meetinglibrary.asco.org/content/88824-115.
13 Garufi C, Torsello A, Tumolo S, et al. Cetuximab plus chronomodulated irinotecan, 5-fluorouracil, leucovorin and oxaliplatin as neoadjuvant chemotherapy in colorectal liver metastases: POCHER trial[J]. Br J Cancer, 2010, 103(10):1542-1547.
14 Sougklakos I, Vardakis NK, Kampouraki E, et al. Phase II trial of 5-fluorouracil (5FU)/leucovorin (LV), irinotecan, and oxaliplatin (FOLFOXIRI) plus cetuximab in patients with metastatic colorectal cancer (mCRC)[J/OL]. http://meetinglibrary.asco.org/content/78213-102.
15 Ye LC, Liu TS, Ren L, et al. Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS Wild-Type unresectable colorectal Liver-Limited metastases[J]. J Clin Oncol,2013, 31(16): 1931-1938.
16 Ji JH, Park SH, Lee J, et al. Prospective phase II study of neoadjuvant FOLFOX6 plus cetuximab in patients with colorectal Cancer and unresectable liver-only metastasis[J]. Cancer Chemother Pharmacol, 2013, 72(1): 223-230.
17 Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal Cancer (EORTC Intergroup trial 40983): a randomised controlled trial[J]. Lancet, 2008, 371(9617): 1007-1016.
18 Piessevaux H, Buyse M, De Roock W, et al. Radiological tumor size decrease at week 6 is a potent predictor of outcome in chemorefractory metastatic colorectal Cancer treated with cetuximab (BOND trial)[J]. Ann Oncol, 2009, 20(8): 1375-1382.
19 De Roock W, Piessevaux H, De Schutter J, et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal Cancer treated with cetuximab[J]. Ann Oncol, 2008, 19(3): 508-515.
20 Mansmann UR, Sartorius U, Laubender RP, et al. Deepness of response:A quantitative analysis of its impact on post-progres-sion survival time after first-line treatment in patients with mCRC[J]. J Clin Oncol, 2012, 30(suppl 34): 427.
21 Piessevaux H, Buyse M, Schlichting M, et al. Use of early tumor shrinkage to predict Long-Term outcome in metastatic colorectal Cancer treated with cetuximab[J]. J Clin Oncol, 2013, 31(30):3764-3775.
Clinical observation of cetuximab in conversion therapy of patients with unresectable colorectal liver-limited metastases
QIN Rui, SHI Yan, CHEN Li, WU Zhi-yong, HAN Ya-lin, DAI Guang-hai
No.2 Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China
DAI Guang-hai. Email:daigh60@sohu.com
ObjectiveTo investigate the effcacy and safety of cetuximab combined with chemotherapy for patients with KRAS Wild-Type unresectable colorectal liver-limited metastases and explore the factors that may affect the prognosis.MethodsClinical data of 18 patients with KRAS Wild-Type unresectable colorectal liver-limited metastases admitted to our hospital from May 2007 to May 2012 were collected and all patients were treated with cetuximab combined with chemotherapy with the effcacy evaluating as CR+PR+SD. Then they accepted lesion resection of the primary tumor, and simultaneously accepted lesion resection of the metastases partially. The effcacy and safety of conversion therapy were summarized and assessed, and the relationship between clinicopathology features and outcome were retrospectively analyzed.ResultsThe median duration treatment of cetuximab was 12 weeks, with CR in 0 case, PR in 11 cases. All patients received surgery after conversion therapy, 11 of them underwent synchronous radical colorectal surgery and liver metastases resection, 7 of them received local treatment of metastases. In the 18 patients, recurrent metastases occurred in 12 cases and death in 5 cases. Median PFS (progression-free survival) was 20.8 months, and the OS was 9.59 -37.13 months. Univariate analysis showed that the number, size and location of liver metastases, serum CEA concentration, early tumor response were related to the PFS with signifcant differences (P<0.05).ConclusionCetuximab combined chemotherapy can improve R0 resection rate of the primary tumor and metastases with effcacy and safeness for paients with KRAS Wild-Type unresectable colorectal liver-limited metastases.
cetuximab; colorectal cancer; liver metastases; combined chemotherapy; conversion therapy
R 735.3
A
2095-5227(2014)07-0696-05
10.3969/j.issn.2095-5227.2014.07.014
时间:2014-04-21 11:23
http://www.cnki.net/kcms/detail/11.3275.R.20140421.1123.001.html
2014-02-25
秦锐,男,在读硕士,主治医师。研究方向:消化道肿瘤。Email:tedlongy@hotmail.com
戴广海,男,主任医师,教授,博士生导师。Email:daigh60@sohu.com

