龙须菜果孢子的紫外诱变及优势突变体的筛选*
付 峰,隋正红,常连鹏,周 伟,魏惠惠
(1.中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛266032;2.烟台大学海洋学院,山东 烟台264005)
龙须菜(Gracilariopsislemaneiformis)是我国重要的产琼胶红藻,是主要的琼胶来源;其多糖成分还具有抗氧化和抗肿瘤等一些生理活性,具有开发医药产品与保健食品的价值;它还被用做养殖鲍鱼的主要鲜品饲料;龙须菜养殖可以修复浅海生态环境,有效防止海洋赤潮[1-2]。我国龙须菜的人工栽培始于1980年代,目前已成为我国继海带和紫菜之后的第三大栽培海藻。龙须菜栽培业不仅促进了琼胶制造业的发展,还产生了良好的生态效益,对促进我国的海水养殖事业的可持续发展具有重要的意义[3]。
野生型龙须菜主要分布在我国山东半岛的潮间带,其最适生长温度是12~23℃。随着龙须菜养殖业的不断发展,其耐高温性、生长速率及琼胶含量仍亟待提高,以扩大其栽培地域并延长栽培时间,进一步提高产品产量和质量。1998年张学成等[3]采用 N-甲基-N’-亚硝基胍(MNNG)诱变,经过10a的栽培选育出了耐高温品系981,其生长速率、琼胶含量和耐高温性均得到了显著地提高,在我国南方海域得到了广泛推广,它能够耐受的最高温度由原来的23℃提高到了26℃[4],然而981仍然不能够在南方成功渡夏,因此亟待选育出更加耐高温的品系,来满足龙须菜栽培业的需要。
高温胁迫可以破坏植物体活性氧(ROS)代谢的平衡,导致产生过量的活性氧,引起细胞伤害。过量的活性氧可以引起膜脂过氧化,产生丙二醛(MDA)。丙二醛的含量与高温对细胞的伤害程度有关[5-6]。植物通过体内抗氧化系统来抵御氧化压力,研究显示高温胁迫下植物体抗氧化酶的活性在植物耐高温中起着重要作用,在藻类中的研究显示也是如此[7-8]。超氧化物歧化酶(SOD)是抗氧化系统中主要的一种酶,研究显示它的活性变化与藻体的耐热性相关。热激蛋白基因(hsp)的表达也是藻类应对高温胁迫的一种响应机制,当藻体受到高温胁迫时,体内的热激蛋白基因会大量表达,参与体内新生肽链的折叠、组装以及变性蛋白的复性和降解,缓解高温胁迫带来的伤害,产生耐热性[9-10]。
本实验首次利用紫外线诱变方法处理龙须菜果孢子,通过对其进行紫外诱变,进一步探索选育龙须菜优良品系的适宜方法。本文以耐高温作为主要性状筛选龙须菜抗逆突变体,就高温胁迫对突变株藻体与981和野生型的MDA含量,SOD活性以及hsp70基因的表达情况等方面的影响进行了比较分析,旨在建立适于龙须菜耐高温品系的筛选方法和选育出龙须菜的高产抗逆品系,为进一步将其应用于生产打下基础。
1 材料与方法
1.1 果孢子体的培养和诱导放散
本实验用材料为2011年10月采自青岛湛山湾的野生果孢子体。用毛刷刷洗除去杂藻。采用f/2培养基,培养温度为(20±1)℃,光强30μmol/(m2·s),光暗周期12L∶12D。每周更换一次培养基。
将经过处理的雌配子体切成2cm长的藻段,置于9cm玻璃培养皿中,加入培养基30mL,每个培养皿中藻体切段数为4~6段,培养条件同上。定期观察,待果孢子大量放散。
1.2 果孢子紫外诱变
将刚放散附着在玻璃平皿中的果孢子用来进行紫外诱变,诱变剂量为20W紫外灯(254nm),距离为30 cm,照射时间设置为0、10、20、30、40、50、60s共7个时间梯度。每个时间梯度设置3个平行。紫外线照射后加入f/2培养基,避光黑暗培养24h,然后再恢复至光下培养,培养条件(20±1)℃,15μmol/(m2·s),12L∶12D。诱变后第7天对存活的果孢子进行统计。在倒置显微镜10倍物镜下(×200),随机挑选20个视野,颜色保持红褐色的记为存活的,统计存活的孢子数目,用来计算果孢子的紫外诱变致死率,致死率/%=(1-存活孢子数目/总孢子数)×100%。
1.3 耐高温藻株的筛选
选择刚附着未经诱变处理的野生果孢子,培养在(20±1)℃的培养箱中,光强30μmol/(m2·s),光暗周期12L∶12D,每周更换1次培养基。待其长至5cm左右长的幼苗期时(约8周后),将培养在玻璃培养皿中的幼苗置于高温水浴,温度分别设置为36~42℃共计6个温度梯度,每个温度设置3个平行,胁迫培养30min,然后再置于培养温度为(20±1)℃条件黑暗培养12h,恢复至光下培养;5d后观察藻株存活情况,计算存活率。导致野生型幼苗全部死亡的最低温度即确定为致死温度,作为幼苗期突变藻株耐高温筛选的温度。
将紫外诱变后生长至5cm长的四分孢子体幼苗置于上述温度预实验确定的筛选温度,水浴热胁迫30min,将存活的藻体经培养成熟后,每株称取约0.1g藻段,每株设3个平行,置于35℃高温胁迫培养72h,观察藻体状态,存活下来的即初步认定为耐高温藻株。
1.4 日平均生长速率的测定
1.4.1 实验室内高温培养 称取0.5g鲜重的突变体藻株、981和野生型藻体,置于含300mL灭菌海水(含f/2培养基)的500mL三角烧瓶中,培养在培养箱中,温度为(28±1)℃,光照强度30μmol/(m2·s)(12L∶12D),培养3个周,每周更换1次培养基。每株藻体设置3个平行。在培养结束后称量藻体鲜重。
1.4.2 胶州湾海上培养 2012年9月20日~10月20日,将初筛得到的耐高温藻株挂于青岛胶州湾海区进行栽培试验,海区水温18~25℃,平均水温21.5℃(数据来自国家海洋局官网,http://www.soa.gov.cn)。每个品系各夹苗10根。在胶州湾海区挂养30d后称重。
按照下列公式计算龙须菜的日平均生长速率(Specific Growth Rate,SGR):
SGR =100 (lnWt-lnW0)/t,
式中,SGR/%·d-1为日平均生长速率,Wt为第t天的藻体湿重/g;W0为初始夹苗量/g。
1.5 抗逆特征分析
称取0.2g鲜重的突变体、981和野生型藻体,置于含200mL灭菌海水(含f/2培养基)的500mL三角烧瓶中,在培养温度(32±1)℃,光照强度30μmol/m2·s(12L∶12D)培养1、2、3d。热胁迫后,称取0.1g藻体立即置于液氮中冻存,然后储存于-80℃用来进行后续的测定。每株藻体设置3个平行。在(20±1)℃培养的没有经过热胁迫的藻体作为对照组。
1.5.1 丙二醛(MDA)含量 MDA含量采用硫代巴比妥酸比色法测定[11]。将0.1g鲜重的样品,加入0.05mol/L的磷酸缓冲液(pH=7.8)5mL研磨成匀浆。加入5mL含有0.5%硫代巴比妥酸的5%的三氯醋酸,混合液沸水浴加热10min,冷却后,10 000×g离心15min,收集上清,分别测定在450、532和600nm处的吸光值。MDA(μmol/g FW)含量计算如下:
MDA=[6.45× (A652-A600)-0.56×A450]×Vt/(1 000×FW),
其中,Vt:上清的体积/mL;FW:样品鲜重/g。
1.5.2 过氧化物歧化酶(SOD)活性测定 SOD活性采用氮蓝四唑(NBT)法测定[11]。将0.1g鲜重的样品,加入含有1%吡咯烷酮的0.05mol/L磷酸缓冲液(pH=7.8)5mL研磨成匀浆。收集上清为粗酶液,10 000×g离心10min。将含有100μL粗酶液的试管中加入100mmol/L磷酸缓冲液(pH=7.8)2.55mL,130mmol/L的甲硫氨酸300μL,0.75mmol/L氮蓝四唑(NBT)300μL,0.1mmol/L的EDTA·Na2300μL和0.02mmol/L核黄素60mL。将试管置于35℃,光照强度为50μmol/(m2·s)处显色20min。用可见分光光度计在560nm处测定溶液的吸光值。总蛋白含量用考马斯亮蓝染色法测定[12]。总SOD活性(U/g),比活力(U/mg prot)计算如下:
总SOD活性=(A0-As)×Vt/(A0×0.5×FW×Vs)比活力= 总SOD活力/总蛋白含量,其中,A0:光下对照的吸光值;As:样品的吸光值;Vt:粗酶液的体积/mL;Vs:参加反应的粗酶液的体积/mL;FW:样品的鲜重/g。
1.6 热激蛋白基因hsp70的表达情况分析
称取0.2g鲜重的突变体、981和野生型藻体,置于含200mL灭菌海水(含f/2培养基)的500mL三角烧瓶中,在32℃培养箱中热胁迫4h,光照强度30 μmol/(m2·s)。在(20±1)℃培养的没有经过热胁迫的藻体作为对照组。实验设置3个重复。采用荧光定量PCR方法来确定热胁迫条件下热激蛋白基因hsp70的表达量。
总RNA的提取采用Plant RNA Kit试剂盒(购自OMEGA),cDNA 合成利用 RT reagent kit with gDNA Eraser试剂盒(购自TaKaRa)。根据hsp70-1[13]全长cDNA 序列设计特异性引物 Hsp70-s/Hsp70-a(见表1),根据龙须菜 18SrRNA 序列(GenBank:JN561078.1)设计内参基因引物 18SrRNA-s/18S rRNA-a(见表1)。QRT-PCR采用SYBR Select Master Mix(购自上海英维捷基)在 ABI 7500荧光定量PCR仪上进行,所有的反应设置3个平行。hsp70mRNA 的表达量用2-ΔΔCT方法进行计算[14]。

表1 荧光定量PCR中设计的引物序列Table 1 Sequence of primers used in Quantitative RT-PCR
1.7 数据分析
数据分析采用SPSS 20.0进行单因素方差分析(ANOVA),采用最小显著差数(LSD)法进行,以P0.05为差异显著性水平。
2 结果
2.1 紫外诱变条件的确定
紫外诱变预实验采用了从0~60s的不同辐射时间,来确定紫外诱变的半致死剂量。从图1可以看出,果孢子对紫外线辐射比较敏感。在紫外线辐射30s时,果孢子的致死率为60.46%,辐射60s时致死率为93.21%。根据实际的致死率,得出紫外诱变的线性致死率(见图1)。通过图1中的公式计算得,在致死率为50%时的紫外辐射时间约为27s,致死率为80%时的紫外辐射时间约为48s。
为了获得较高的正突变率,又不至于造成大部分细胞死亡[15],本实验选用了20W 紫外灯,照射距离30cm,辐射时间为48s的诱变条件。
2.2 筛选温度的确定
5cm长的龙须菜四分孢子体幼苗经高温胁迫30 min后,结果显示其对高温变化比较敏感,在41℃高温水浴处理30min的条件下,野生型四分孢子体幼苗的存活率为0(见图2)。以没有野生型幼苗存活的最低处理温度作为致死温度,用来进行突变藻株的耐高温筛选。因此,在后续的实验中采用41℃作为突变藻株幼苗耐高温的筛选温度。

图1 不同紫外诱变时间对果孢子的致死率Fig.1 The lethal rate of carpospores by UV irradiation at different doses

图2 不同温度胁迫下幼苗的存活率Fig.2 The survival of tetrasporophyte under different temperature
2.3 果孢子的紫外诱变和耐高温藻株的筛选
刚附着的果孢子(每个平皿中大约有105个孢子,共60个平皿)经紫外诱变后,存活的藻体幼苗培养在9cm玻璃培养皿中,经41℃热胁迫30min,3d后观察发现一些藻体尖端变白,有的甚至整个藻体变白死亡。随着培养时间的延长,有的尖端变白的藻体恢复为红棕色。5d后观察藻体存活情况,此时整个藻体均保持红棕色的藻体被认定为存活的藻株,初步认定其为耐高温幼苗。
耐高温幼苗长至成熟藻体后,经35℃胁迫培养72h后,仍有部分藻体在高温胁迫下出现藻体变绿、变白死亡的现象,另外一部分藻体经胁迫后仍然能保持活力,藻体颜色保持红棕色,经此2次筛选后存活的藻株初步认定其为耐高温藻株,用于后期性状分析。
2.4 日平均生长速率的测定
将初步筛选获得的耐高温藻体和981藻株以及野生型,分别经过在实验室和在海上的培养后,其中2株藻体具有较快的日平均生长速率,被命名为BZT-11和BZT-18。
2株突变株的日平均生长速率与981藻株和野生型进行了比较分析,结果发现在实验室内和海上培养的两株突变体的生长速率明显比981藻株和野生型快,而且差异极显著(P<0.01)(见图3)。
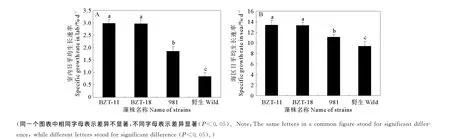
图3 藻株在实验室(A)和海上(B)条件下的日平均生长速率Fig.3 The specific growth rate of tetrasporophyte under different cultivation in lab(A)and sea(B)
2.5 丙二醛含量的测定
见图4,随着胁迫时间的延长,4株藻体的MDA含量呈现上升的趋势。而且野生型藻体MDA含量增加的比其它3株藻体要多。在胁迫之前的对照组中显示,4株藻体的 MDA含量差异不显著(P>0.05)。在胁迫3d后,四株藻体的MDA含量出现了明显的差异,野生型的MDA含量最高约为对照组的2.48倍,BZT-11藻株的MDA含量最低,为对照组的1.81倍。BZT-18和981藻株的MDA含量相近,分别为对照组的1.81和2.10倍,与前两者均差异显著(P<0.05)。

图4 藻株在热胁迫不同时间后的MDA含量变化Fig.4 The changes of MDA of four strains under different heat stress time
2.6 过氧化物歧化酶活性的测定
见图5在热激1天后,4株藻体的SOD活性均呈升高趋势,在胁迫后第1天显著升高。随着胁迫时间的延长,藻体的SOD活性逐渐降低,在胁迫后第3天,其活性显著低于对照组。在高温胁迫前后,BZT-11、BZT-18和981藻株的SOD酶活性差异不显著(P>0.05),但是均比野生型高,具有显著性差异。在胁迫的第1天,藻株的SOD含量的增加量有差异,BZT-11增加了183.71%,BZT-18增加了176.21%,981增加了195.33%,野生型增加了169.77%。BZT-11 和BZT-18的增加量均比野生型的多。
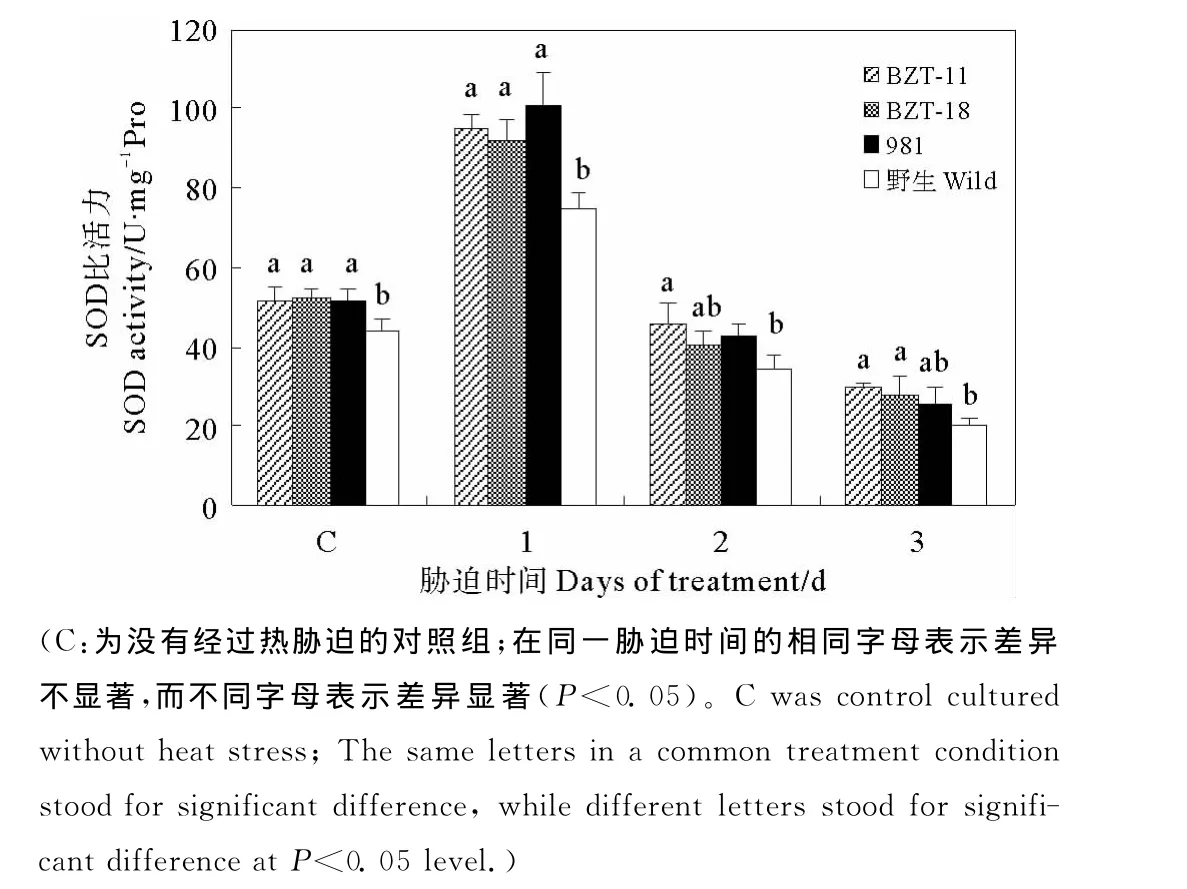
图5 藻株在热胁迫不同时间后的SOD活性变化Fig.5 The changes of SOD activity of four strains under different heat stress time
2.7 热激蛋白基因表达量的测定
热激4h后,热激蛋白基因hsp70的表达量迅速增加(见图6)。其中BZT-18和981藻株hsp70的表达量差异不显著(P>0.05),分别为对照组的15.94和16.42倍;BZT-11藻株hsp70的表达量为对照组的12.48倍,这3株藻体的热激蛋白基因的表达量都明显地高于野生型藻株(P<0.05)。

图6 藻株在热胁迫4h后hsp70表达量的变化Fig.6 The changes of MDA of four strains under different heat stress time
3 讨论
3.1 诱变方法
近年来,紫外诱变技术应用广泛,尤其在微生物和微藻方面。它的诱变频率高,而且不易回复突变,是使用最早、沿用最久、应用最广泛的一种物理诱变剂。紫外线可引起DNA与蛋白质的交联、胞嘧啶与尿嘧啶之间的水合作用、DNA链的断裂、形成嘧啶二聚体等,从而导致基因突变[15]。
紫外诱变被广泛应用于藻类诱变育种中。Sandesh等[16]利用紫外诱变的方法获得了高产类胡萝卜素和虾青素的雨生红球藻。李建宏等[17]利用紫外线对钝顶螺旋藻进行诱变,筛选获得的两株突变株的生长速度和光合放氧速率均有显著提高,而且其长碳链不饱和脂肪酸含量高于出发藻株。张学成等[18]通过对小球藻株进行紫外诱变,筛选出了3个株系,其生长速率和蛋白含量均有显著的提高。严兴洪等[19]利用紫外线辐射诱变条斑紫菜原生质体,获得了可再生的纯红色突变体。Shen等[20]通过紫外线辐射细基江蓠2mm厚的藻体切片,对其进行诱变,通过筛选获得了稳定的具有镉(Cd)抗性的突变藻体。
诱变育种是龙须菜品系选育的一个重要的手段。龙须菜诱变研究中经常使用的化学诱变剂有甲基磺酸乙酯(EMS)和N-甲基-N’-亚硝基胍(MNNG)。Zhang等[22]用甲基磺酸乙酯(EMS)诱变龙须菜诱导获得了多种色素突变体,为龙须菜的遗传研究提供了良好的材料。张学成等[21]用MNNG诱变龙须菜幼配子体,获得了各种色素突变体,为研究突变体的光合特性和色素组成提供了基础,而且研究发现江蓠属海藻的颜色是由多基因控制的性状。张学成等[3]采用 MNNG诱变龙须菜藻体,经过羟脯氨酸和高温条件的筛选,获得了981良种,并通过海上实践证实了其遗传稳定性。孟琳等[23]利用MNNG诱变981藻尖,通过高温筛选获得了07-2耐高温新品系,具有比981更耐高温、生长快、琼胶含量高等优良特性。
相对于一些化学诱变,紫外诱变方法简单方便,安全有效。在海藻方面大多是以微藻藻株或者大型海藻幼体作为诱变处理的材料。在本次实验中,采用刚释放附着的果孢子作为紫外诱变的对象,刚附着的果孢子还没有分裂,为单细胞,遗传物质的改变容易表现在完整植株体,不会形成嵌合体;且刚放散的果孢子也没有很厚的多糖外壁,利于紫外线的穿透和功效发挥,因此它是进行诱变的良好材料。本实验中利用紫外诱变果孢子的方法来获得生长快速的耐高温突变体,实验结果显示了紫外辐照方法对于果孢子诱变的可行性。
3.2 耐热突变体的筛选
研究显示龙须菜在幼体时期具有更高的抗高温性[24]。本实验中为了获得能够稳定表达耐热性的突变藻株,将不同生长阶段的突变体,包括幼苗期和成熟期,都经过高温胁迫的筛选。四分孢子体幼苗期的耐高温筛选温度设置为导致野生型幼苗的存活率为零的最低处理温度。因此幼苗期高温筛选条件为41℃热胁迫30min。成熟期藻体的耐高温筛选温度参照本实验室前期的实验结果[25]。
在热胁迫条件下,MDA含量的增加,说明细胞膜脂过氧化的程度增高,细胞受损害的程度增加。在本实验中MDA含量在整个热胁迫过程中逐渐升高,说明藻体细胞膜受损害的程度随着胁迫的时间的增加而增强。龙须菜在高温下MDA含量的变化,与他人的研究结果相似[26],表明高温胁迫条件下 MDA含量与藻类的耐热性具有重要相关性。在整个热胁迫过程中两株突变株的MDA含量明显低于野生型,而与981藻株没有显著性差异,初步说明了筛选获得的这2株突变藻株可能具有较高的抗逆性。
SOD能够清除活性氧,是抗氧化防御系统中的关键酶之一,研究显示藻类细胞SOD活力的升高与其高耐热性相关[27-28]。本研究结果显示在4株藻体中SOD活性在胁迫后的第1天内呈上升趋势,随着胁迫时间的延长活性逐渐降低,藻体受到高温的伤害可能与SOD含量的降低有关。在高温胁迫下,2株突变藻株的SOD活性与981藻株相当,并始终高于野生型,而且在胁迫第1天SOD活性的增加幅度高于野生型,这在一定程度上也反映了2株突变藻株具有较强的耐热性。
Hsp70是生物体内一种高度保守的热激蛋白,hsp70基因的表达是藻类应对热胁迫的一种重要的方式[27]。Gu等[13]也曾报道在高温胁迫条件下hsp70基因的表达与龙须菜的耐热性是直接相关的。在本实验中,4株藻体经热胁迫4h后,hsp70基因的表达水平均比对照组显著增高,而2株突变株hsp70基因的表达量又比野生型藻株分别高出3.64和4.66倍。这也更加证实了2株突变株比野生型藻体具有更高的耐热性。
实验表明,紫外辐射是龙须菜的一种有效的诱变育种方法。筛选出的2株耐高温突变株BZT-11和BZT-18显示了比981和野生型较快的日平均生长速率。与野生型相比,在热胁迫条件下突变株具有较低的MDA累积含量,较高的SOD活性和hsp70基因表达水平,初步显示了它们可能会具有较高的耐热性。BZT-11和BZT-18藻株有望作为优良品系应用于生产栽培,2株突变株的特性是否能够稳定遗传,这仍然需要进行大量的后续研究和实践工作。
本试验将紫外诱变与耐高温筛选相结合,建立了一套可行的龙须菜耐高温品系的筛选方法,为深入了解龙须菜的耐高温机制,选育生长快而且耐高温的龙须菜优良品系提供研究基础。
[1]Zhou Y,Yang H S,Hu H Y,et al.Bioremediation potential of the macroalgaGracilarialemaneiformis(Rhodophyta)integrated into fed fish culture in coastal waters of north China[J].Aquaculture,2006,252:264-276.
[2]Fei X G.Solving the coastal eutrophication problem by large scale seaweed cultivation[J].Hydrobiologia,2004,512:145-151.
[3]张学成,费修绠,王广策,等.江蓠属海藻龙须菜的基础研究与大规模栽培[J].中国海洋大学学报:自然科学版,2009,39(5):947-954.
[4]张学成,费修绠.全国水产原良种审定委员会审定品种——981龙须菜及其栽培技术介绍[J].科学养鱼,2008(6):21-22.
[5]Xu S,Li J L,Zhang X Q,et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J].Environment and Experimental Botany,2006,56:274-285.
[6]Jiang Y W,Huang B R.Drought and heat stress injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation[J].Crop Science,2001,41(2):436-442.
[7]王悠,唐学玺.不同海带品系抗氧化系统活性与耐热性的相关性研究[J].应用生态学报,2005,16(8):1507-1510.
[8]杨锐,张晓龙,徐丽宁,等.坛紫菜耐高温胁迫机理之初步研究[C].中国海洋湖沼学会藻类学分会第七届会员大会暨第十四次学术讨论会论文摘要集,2007.
[9]Vierling E.The roles of heat shock proteins in plants[J].Annual Review of Plant Physiol and Plant Mol Biol,1991,42:579-620.
[10]Wahid A,Gelani S,Ashraf M,et al.Heat tolerance in plants:An overview [J].Environment and Experimental Botany,2007,61:199-223.
[11]高俊凤.植物生理实验指导[M].北京:高等教育出版社.2006.
[12]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].Analytical Biochemistry,1976,72:248-254.
[13]Gu Y H,Zhang X,Lu N,et al.Cloning and transcription analysis ofhsp70-1andhsp70-2ofGracilarialemaneiformisunder heat shock[J].Aquaculture,2012:284-291.
[14]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25:402-408.
[15]施巧琴,吴松刚,等.工业微生物育种学[M].北京:科学出版社,2009.
[16]Sandesh K B,Vidhyavathi R,Sarada R,et al.Enhancement of carotenoids by mutation and stress induced carotenogenic genes inHaematococcuspluvialismutants[J].Bioresource Technology,2008,99:8667-8673.
[17]李建宏,郑卫,倪霞,等.两株钝顶螺旋藻紫外诱变株的特征[J].水生生物学报,200l,25(5):486-490.
[18]张学成,时艳侠,孟振.小球藻紫外线诱变及高产藻株筛选[J].中国海洋大学学报:自然科学版,2007,37(5):749-753.
[19]严兴洪.紫外线辐射与条斑紫菜原生质体后代发育和变异[J].上海水产大学学报,1992,1(1-2):71-78.
[20]Shen D,Wu M.Chromosomal and mutagenic study of the marine macroalga,Gracilariatenuistipitata[J].Journal of Applied Phycology,1995,7:25-31.
[21]张学成,张锦东,隋正红,等.江蓠属藻蓝蛋白的研究I诱变、突变体筛选及藻蓝蛋白的光谱特性[J].青岛海洋大学学报,1996,26(3):318-326.
[22]Zhang X C,van der Meer J P.A genetic study onGracilaria sjoestedtii[J].Canadian Journal of Botany,1988,66:2022-2026.
[23]孟琳,徐涤,陈伟洲,等.龙须菜新品系07-2的筛选及性状分析[J].中国海洋大学学报:自然科学版,2009,39:94-98.
[24]樊恭炬,李伟新,王永川,等.琼胶海藻的研究Ⅰ.龙须菜的果孢子萌发体的生长适温及其幼苗的季节生长[J].植物学报:英文版,1974,16(1):24-30.
[25]付峰.龙须菜紫外诱变育种及抗逆速生优良品系的选育[D].青岛:中国海洋大学,2013.
[26]鹿宁,臧晓南,张学成,等.高温胁迫下不同龙须菜品系抗氧化能力的比较[J].武汉大学学报:理学版,2010,56(5):570-577.
[27]Mallick N,Mohn F H.Reactive oxygen species:response of algal cells[J].Journal of Plant Physiology,2000,157:183-193.
[28]臧晓南,张学成,张璐,等.藻类高温胁迫分子响应的研究进展[J].武汉大学学报:理学版,2008,54(6):732-738.

