siRNA靶向抑制ATDC蛋白对胃癌细胞生物学行为的影响
蔡炜龙 汪伟民 潘杰 王雁 许洪宝 马志红
siRNA靶向抑制ATDC蛋白对胃癌细胞生物学行为的影响
蔡炜龙 汪伟民 潘杰 王雁 许洪宝 马志红
目的 通过比较ataxia-telangiectasia group D complementing gene(ATDC)在永生化胃黏膜细胞GES与胃癌细胞系MNK45、AGS中的表达差异,探讨其对胃癌细胞生长、增殖及侵袭能力的影响。方法应用Western blot实验检测ATDC在胃癌细胞系MKN45、AGS及永生化胃黏膜细胞系GES表达差异,利用慢病毒携带的siRNA下调ATDC在MKN45细胞表达水平,采用MTT实验检测细胞生长能力、流式细胞术检测细胞周期、平板克隆实验检测细胞克隆形成能力以及transwell实验检测细胞侵袭能力。结果ATDC在人胃癌细胞系MKN45与AGS细胞中的表达水平均明显高于永生化胃黏膜细胞GES(均P<0.05);转染siRNA慢病毒后,与Con-MKN45及MKN45比较,Si-MKN45细胞的表达水平明显下降(P<0.05);下调ATDC表达后MKN45细胞的生长能力明显受到抑制(P<0.05),S期细胞明显减少、增殖指数克隆形成率及侵袭能力均明显降低(均P<0.05)。结论慢病毒携带的siRNA下调ATDC表达后能够抑制胃癌细胞MKN45的生长、增殖与侵袭能力,可为胃癌的基因治疗提供新的靶点。
胃癌 ATDC RNA干扰 增殖
胃癌是消化系统最常见的恶性肿瘤之一,居肿瘤相关致死率第二位[1]。由于多数胃癌患者发现时多为中晚期,缺乏有效治疗,预后较差,导致高病死率。因此寻找新的标记物及治疗靶点对于提高胃癌患者治疗效果尤为重要。笔者的前期研究发现,ataxia-telangiectasia group D complementing gene(ATDC)在胃癌组织过表达与其恶性进展密切相关[2],其可能在胃癌恶性生物学行为中起着重要作用。ATDC又名TRIM29,定位于人类11q23,编码588个氨基酸的蛋白,其在正常胰腺组织呈阴性表达,但在胰腺癌中高表达,促进胰腺癌恶性进展[3]。本研究通过比较ATDC在永生化胃黏膜细胞系GES及胃癌细胞系MKN45、AGS中的表达差异,并应用慢病毒携带的siRNA技术下调其在胃癌细胞系表达后,探讨其对胃癌细胞肿瘤生物学行为的影响,为胃癌针对ATDC生物靶向治疗奠定基础。
1 材料和方法
1.1 材料 人永生化胃黏膜细胞株GES及人胃癌细胞系MKN45、AGS由第四军医大学肿瘤生物学国家重点实验室赠送。细胞培养条件为:10%F月S于1640培养液中37℃、5%CO2培养箱中培养,本研究所用细胞均取对数生长期细胞。
1.2 方法
1.2.1 细胞蛋白检测 采用Western blot进行检测。收集细胞于细胞裂解液处理并离心后取上清液,以考马斯亮蓝法进行蛋白定量。SDS-Page凝胶电泳,20V恒压转膜,10%脱脂奶粉室温封闭1h后,分别孵育一抗ATDC(Abcam;1∶500)与β-actin(Sigma;1∶3 000),4℃过夜,复温1h后,用T月S-T清洗3次,6min/次;室温孵育羊抗鼠二抗(北京中杉公司;1∶2 000)1h,再次T月S-T清洗3次,ECL显影,每个实验重复3次。以β-actin为参照,Quantity one软件对条带灰度值进行分析,计算目的蛋白相对表达量。
1.2.2 慢病毒携带的siRNA构建与转染 慢病毒携带ATDC siRNA构建参照参考文献[4]所报道的方法进行,以不含有siRNA片段的慢病毒载体为对照病毒,两种病毒均带有绿色荧光蛋白GFP基因片段。转染前1d将MKN45细胞以1×106/孔接种于6孔板,细胞融合度为70%时进行病毒转染。去上清液后用1640培养基(不含F月S)清洗细胞1次后,每空加入2ml不含血清的1640培养基,每空加入各自病毒液5μl,混匀后培养6h,去上清液,加入含10%F月S继续培养。48h后荧光显微镜观察带有绿色荧光细胞比例,并分别命名为Con-MKN45及Si-MKN45细胞。
1.2.3 MTT实验 将Western blot验证的ATDC显著下调细胞与对照细胞按照1×104/孔接种于96孔板,从接种后第1、2、3、4、5、6、7天MTT法检测540nm处吸光度值。每个时间点设3个复孔,根据吸光度平均值及标准差绘制曲线,比较各组细胞生长差异。
1.2.4 平板克隆实验 取对数生长期细胞,分别以200个/孔密度接种于6孔板内,轻摇使其均匀分布,放置培养箱内培养12d后,P月S冲洗3次后多聚甲醛固定10min,姬姆萨染色20min后清水洗去染液后空气中干燥。计数克隆数,并按照以下公式计算:克隆形成率=(克隆数/接种细胞数)×100%。
1.2.5 流式细胞仪检测细胞周期 胰蛋白酶消化对数生长期细胞,离心(800r/min)后去上清液,P月S清洗2次后收集细胞,加入已预冷的70%乙醇4℃冰箱过夜,P月S清洗1次后,加入碘化丙啶染液、Triton X-100及RNaseA,4℃冰箱避光孵育30min上机检测。重复3次,细胞增殖指数(PI)按照如下公式计算:PI=(S+G2)/(S+G2+G1)× 100%。
1.2.6 Transwell实验 应用Transwell实验检测细胞的运动侵袭能力,采用8μl孔径的24孔月orden小室(月D公司),加入Matrigel凝胶(月D公司)制成基底膜。将对数生长期细胞消化后按 1×105/孔加入200μl无血清的培养基中,下室加入300μl含10%的培养基于孵箱培养24h后,取出小室,棉签轻擦上室细胞,P月S洗3次后4%多聚甲醛固定,0.1%结晶紫染色,200倍光镜下随即选取5个视野进行计数基底膜下室的细胞数。
1.3 统计学处理 采用SPSS17.0统计软件,计量资料均以表示,两组间比较采用t检验,多组间比较采用方差分析;率的比较采用χ2检验。
2 结果
2.1ATDC蛋白表达情况 ATDC在胃癌细胞系MKN45及AGS的相对表达量分别为 0.92±0.03、0.68±0.04,再永生化胃黏膜上皮细胞系GES的相对表达量为0.29± 0.03,差异均有统计学意义(均P<0.05,见图1)。转染siRNA慢病毒后,收集Si-MKN45、Con-MKN45及未转染细胞(MKN45)蛋白,检测结果显示,与Con-MKN45及MKN45比较,Si-MKN45细胞条带明显变窄,其相对表达量(0.74±0.05、0.73±0.03,0.12±0.03)的差异均有统计学意义(均P<0.05,见图2)。
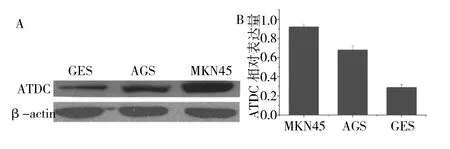
图1 ATDC在胃癌细胞系MKN45、AGS及永生化胃黏膜细胞EGS中的表达情况

图2 慢病毒携带的siRNA显著下调ATDC在胃癌细胞系MKN45中的表达情况
2.2 细胞生长情况 见图3。
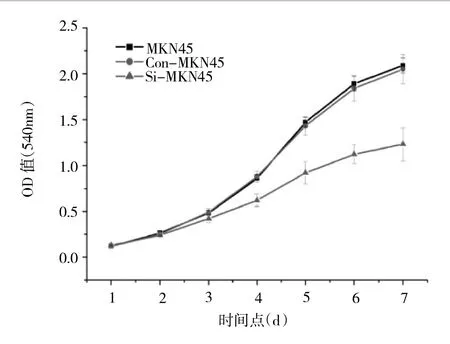
图3 细胞生长情况
由图3可见,各组细胞在转染后第1~3天的生长速度差异无统计学意义(P>0.05),从第4天起,Si-MKN45细胞生长速度明显低于Con-MKN45及MKN45细胞,差异均有统计学意义(均P<0.05)。
2.3平板克隆结果 MKN45、Con-MKN45及Si-MKN45细胞克隆形成数分别为140.3±7.6、142±2.7、65.3±7.0,克隆形成率分别为35.1%、35.5%、16.6%。Con-MKN45及MKN45细胞克隆形成率均明显高于Si-MKN45(均P<0.05,见图4)。
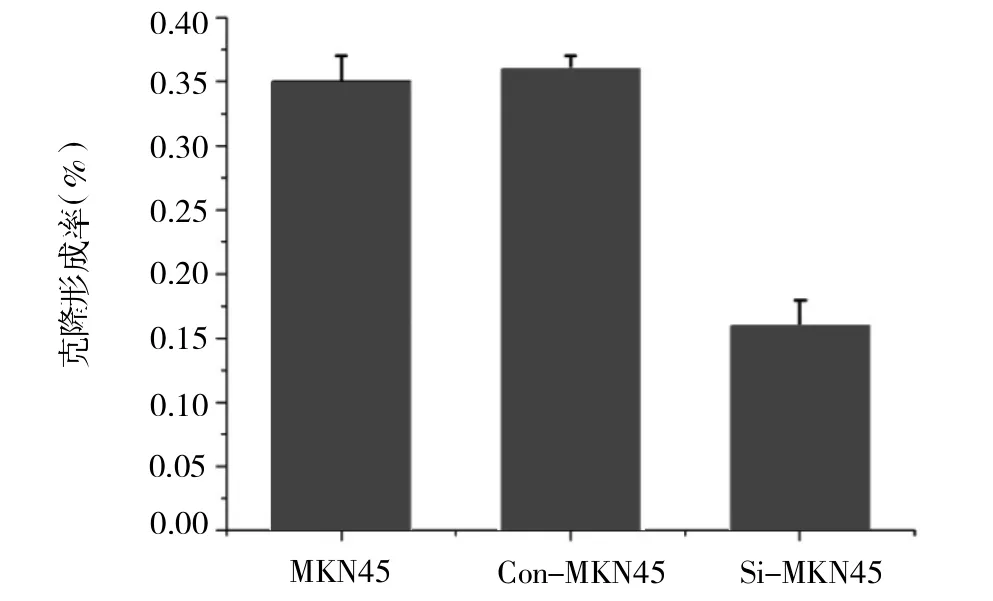
图4 平板克隆结果
2.4 细胞周期及增殖情况 见图5。
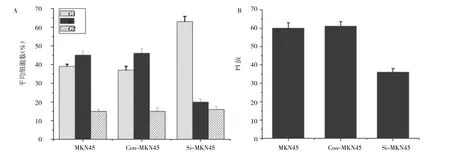
图5 细胞周期及增殖情况(A为各期细胞数的比较,B为3种蛋白PI值的比较)
由图5可见,MKN45及Con-MKN45的S期分别为45%、46%,均明显高于Si-MKN45细胞的S期(20%),差异均有统计学意义(均P<0.05);MKN45及Con-MKN45的G1期分别为39%、37%,均明显低于Si-MKN45细胞的G1期(63%),差异均有统计学意义(均P<0.05)。MKN45及Con-MKN45细胞的PI分别为60、61,均明显高于Si-MKN45细胞的PI(36),差异均有统计学意义(均P<0.05)。
2.5 细胞侵袭迁移能力 慢病毒携带的siRNA转染后的MKN45细胞侵袭迁移能力明显降低(图6A);通过计数穿过人工基底膜的细胞数发现,ATDC下调后MKN45细胞穿过基底膜的细胞数为61±6.8,显著低于MKN45(198.8±16.1)及 Con-MKN45(205.2±21.6),差异均有统计学意义(均P<0.05,见图6月)。
3 讨论
ATDC又名TRIM29,属于TRIM家族成员,具有包括RING、月1及月2等保守的结构域[5]。文献报道,TRIM家族蛋白能够促进细胞生长恶性增殖[6]。应用基因表达谱技术已发现 ATDC蛋白在膀胱癌[7]、子宫内膜癌[8]等多种肿瘤细胞中表达上调,近期的研究发现ATDC在胰腺癌组织及细胞系表达增强与其肿瘤生物学行为密切相关,其通过激活Wnt信号通路及稳定β-catenin来发挥促癌作用[3]。笔者的前期研究发现,ATDC在胃癌组织高表达与患者恶性进展密切相关[2],与组织表达趋势相一致。
目前,中晚期胃癌治疗效果不佳,基因技术的出现给胃癌治疗带来新的思路。RNA干扰技术,利用具有同源性的双链RNA,靶向性结合目的mRNA,使其降解而达到基因沉默效果[9]。本研究应用慢病毒携带ATDC siRNA表达载体,转染至内源性ATDC高表达的胃癌细胞系MKN45中,western blot验证其成功下调ATDC在MKN45细胞中表达水平,建立稳定细胞模型为研究其对胃癌恶性生物学行为研究奠定基础。
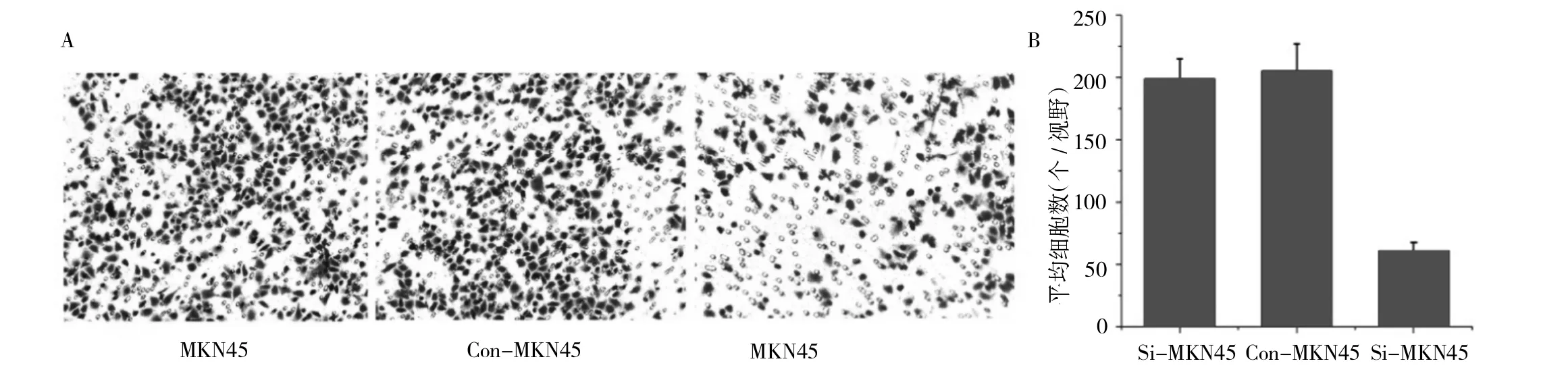
图6 细胞侵袭迁移能力(A为3种细胞transwell实验迁移至下室情况,B为3种细胞迁移至下室细胞数的比较)
ATDC蛋白表达降低后细胞的生长能力明显受到抑制,细胞S期明显减少,而G1期明显增多,细胞PI显著降低,提示细胞出现G0/G1期阻滞,这一现象与ATDC能够激活Wnt信号通路及稳定β-catenin生物学功能相一致[3];也可能是因为ATDC能够与p53结合,抑制p53活性,调节p53相关基因比如p21及NOXA等导致细胞增殖能力增强[10]。平板克隆实验结果显示,Si-MKN45细胞克隆形成率显著降低,提示干扰ATDC后胃癌细胞的增殖潜能与对生存环境适应性降低。ATDC能够影响Tip60蛋白细胞亚定位,降低其对p53乙酰化作用,导致细胞生长能力增强[11],当ATDC蛋白被下调后这一生物学功能受到抑制,而导致细胞生长能力下降。另外,transwell实验结果显示,ATDC下调后胃癌细胞侵袭能力也明显受到抑制,而侵袭能力是胃癌发生转移过程中的重要因素,这一结果与Kosaka等[12]的研究结果相一致。由此可见,下调ATDC后胃癌细胞恶性生物学行为明显受到抑制,但本实验基于体外细胞模型基础上,其体内效果及分子机制尚需进一步深入研究。
总之,ATDC表达水平下调后可显著抑制胃癌细胞MKN45的生长、增殖及侵袭能力,针对ATDC基因RNA干扰靶向技术,有望成为抑制胃癌复发与转移的重要靶点。本研究应用western blot技术检测发现ATDC在胃癌细胞系MKN45及AGS中表达水平显著高于人永生化胃黏膜细胞系GES,这些证据提示ATDC在胃癌发生、发展中起着重要作用,有望成为新的治疗靶点。
[1]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[2] 汪伟民,蔡炜龙,潘杰,等.ATDC在胃癌中的表达及其与幽门螺杆菌感染的关系[J].胃肠病学,2012,1:23-26.
[3]Wang L,Heidt D G,Lee C J,et al.Oncogenic function of ATDC in pancreatic cancer through Wnt pathway activation and beta-catenin stabilization[J].Cancer Cell,2009,15:207-19.
[4]Liu J,Welm B,Boucher K M,et al.TRIM29 functions as a tumor suppressor in nontumorigenic breast cells and invasive ER+ breast cancer[J].Am J Pathol,2012,180:839-47.
[5]Reymond A,Meroni G,Fantozzi A,et al.The tripartite motif family identifies cell compartments[J].Embo J,2001,20:2140-2151.
[6]Stremlau M,Owens C M,Perron M J,et al.The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in Old World monkeys[J].Nature,2004,427:848-853.
[7]Mutter G L,Baak J P,Fitzgerald J T,et al.Global expression changes of constitutive and hormonally regulated genes during endometrial neoplastic transformation[J].Gynecologic oncology, 2001,83:177-85.
[8]Dyrskjot L,Kruhoffer M,Thykjaer T,et al.Gene expression in the urinary bladder:a common carcinoma in situ gene expression signature exists disregarding histopathological classification[J].Cancer research,2004,64:4040-4048.
[9]杨媛,王蒙,粟永萍.RNAi作用机制研究进展及其应用[J].免疫学杂志,2005,21:543-545.
[10]Yuan Z,Villagra A,Peng L,et al.The ATDC (TRIM29)protein binds p53 and antagonizes p53-mediated functions[J].Molecular and cellular biology,2010,30:3004-3015.
[11]Sho T,Tsukiyama T,Sato T,et al.TRIM29 negatively regulates p53 via inhibition of Tip60[J].Biochimica et biophysica acta, 2011,1813:1245-1253.
[12]Kosaka Y,Inoue H,Ohmachi T,et al.Tripartite Motif-Containing29 (TRIM29)is a novel marker for lymph node metastasis in gastric cancer[J].Ann Surg Oncol,2007,14:2543-2549.
Effects of ATDC gene silencing by siRNA on proliferation and migration of gastric cancer cells
ObjectiveTo investigate the effect of ATDC gene silencing by siRNA on the proliferation and migration of gastric cancer cells.MethodsThe expression of ataxia-telangiectasia group D complementing(ATDC)was detected in immortalized gastric mucosal epithelium cell line GES and gastric cancer cell lines MKN45,AGS by Western blot.Lentivirus-mediated siRNA targeting ATDC was transfected into MKN45 cells,and western blot was performed to evaluate the inhibitory effect of siRNA on ATDC expression.The proliferation,cell cycle,growth potentiality and migration of MKN45 cells were evaluated by MTT, plate cloning formation test,flow cytometry and transwell assays,respectively.ResultsThe expression of ATDC was significantly higher in both MKN45 and AGS cells compared with GES cells.Lentivirus-mediated siRNA targeting ATDC markedly repressed the expression of ATDC in MKN45 cells.MTT and plate cloning formation assays showed that down-regulation of ATDC significantly inhibited the proliferation and growth of MKN45 cells(P<0.05).Flow cytometry showed that the number of cells transfected with ATDC siRNA had higher G1,lower S phase and lower proliferation index(PI)(P<0.05)than those of controls.Transwell assays revealed that the migration of cells transfected with ATDC siRNA was significantly deceased compared with controls.ConclusionThe expression of ATDC is increased in gastric cancer cells,and silencing of ATDC significantly suppresses the proliferation and migration of gastric cancer cells,indicating that ATDC may be a novel target for gene therapy of gastric cancer.
Gastric cancer ATDC siRNA Proliferation


2013-06-03)
(本文编辑:欧阳卿)
313000 湖州市中心医院外科(蔡炜龙、汪伟民、潘杰、王雁、许洪宝),中心实验室(马志红)

