卵巢甲状腺肿的超声诊断价值
宣婧婧 杨守和 楼飞
●检测诊断
卵巢甲状腺肿的超声诊断价值
宣婧婧 杨守和 楼飞
卵巢甲状腺肿属于卵巢畸胎瘤,是一种单胚层高度特异性畸胎瘤,较为罕见,约占卵巢肿瘤的0.3%,易误诊[1]。本院2007-01—2013-12经手术病理证实11例卵巢甲状腺肿,现将其超声检查所见报道如下,并结合临床表现对超声诊断的价值作一探讨。
1 临床资料
1.1 一般资料 本组11例患者均经本院手术和病理检查诊断为卵巢甲状腺肿,年龄16~59岁,平均40岁;7例无明显不适,在健康体检时发现,2例表现为腹痛伴盆腔肿块,2例因月经失调就诊。患者血CA125值均在正常范围。
1.2 检查仪器与方法 使用Phillips IU-22、GE LOGOQ7等彩色多普勒超声诊断仪,经腹部探头频率3.5MHz,经阴道探头频率7.5MHz。常规经腹或经阴道超声检查,或两者联合,发现病灶后对其进行测量并记录大小、位置、形态、边界、内部回声、肿块及其周边血流状态。
1.3 超声检查所见 11例病灶均为单发,7例病变位于左侧卵巢,4例病变位于右侧卵巢,其中2例直径<5cm(最小1例大小为2.9cm×2.7cm×2.6cm),6例直径为5~10cm,3例直径>10cm(最大1例大小为13.3cm× 11.4cm×9.4cm)。二维超声表现:4例表现为单纯囊性肿块,壁薄,内部透声好;1例表现为充满稠厚光点的囊性肿块;2例表现为囊性肿块内伴纤细光带;2例表现为分隔状囊性肿块伴强光斑;2例表现为囊实性肿块(图1)。彩色多普勒表现:2例囊实性肿块内实质部分均见条点状血流信号。
1.4 病理诊断 9例为卵巢甲状腺肿,1例为卵巢甲状腺肿类癌(图2),1例为卵巢囊性成熟性畸胎瘤伴甲状腺肿类癌。
2 讨论
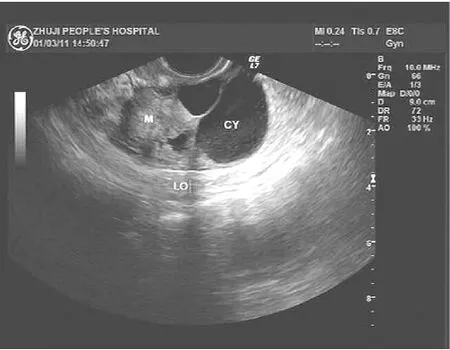
图1 左侧卵巢囊实性肿块超声声像图(M为实质部分,CY为囊性部分)
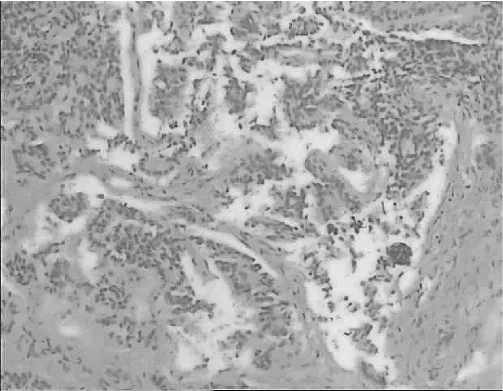
图2 卵巢甲状腺肿类癌病理检查所见(肿瘤细胞呈岛状、梁状分布,细胞大小一致,核大部分呈卵圆形、短核形,有异型;HE染色,×100)
畸胎瘤起源于原始生殖细胞,是卵巢生殖细胞肿瘤中最常见的良性肿瘤,占全部生殖细胞肿瘤的95%,肿瘤多由内、中、外3个胚层或2个胚层组织构成,其组织学特征使声像图具有较典型表现,超声检查有较高诊断价值。单胚层高度特异性畸胎瘤由一种成分构成或以这种成分占绝对优势,当卵巢肿瘤内的甲状腺组织所占比例达50%以上或瘤体内甲状腺组织不多,但有甲状腺功能亢进症状时,称为卵巢甲状腺肿,是一种罕见的卵巢肿瘤,临床表现无特异性,多为下腹部肿块或无明显自觉症状,大多数在健康体检时或无意中发现盆腔肿块而就诊,且术前不易诊断。分析本组患者的资料可以看到,卵巢甲状腺肿超声表现多样化,可表现为囊性或囊实性肿块,无明显特征性表现。有学者认为,此多样性可能由肿瘤内的胶质、脂质或其它组织成分比例不同所致[2],故超声检查不能作为确诊该病的手段,如高度怀疑卵巢甲状腺肿时,可行131I检查,如显示盆腔高强度摄取碘即可确诊。但因131I为放射性元素,不能作为此罕见肿瘤的常规检查手段。
Matsuda等[3]和Volpi等[4]认为患者甲状腺功能亢进症状对本瘤有诊断意义,尤其在发现有盆腔包块而颈部甲状腺结构功能正常的女性患者,要高度警惕是否患有卵巢恶性甲状腺肿,术前测定患者血清及(或)胸、腹水甲状腺球蛋白(TG)值增高,有助于诊断。当然由于该瘤临床罕见,对无甲状腺功能亢进症状者医生容易忽略,故一般术前诊断非常困难,本组2例也仅拟诊“卵巢肿块”剖腹探查才得以确诊,术前未测定血清TG值是诊断的一个遗憾。传统观点认为,恶性甲状腺肿是指卵巢甲状腺肿伴甲状腺癌,主要是乳头状癌和(或)滤泡癌。卵巢恶性甲状腺肿的病理诊断尚有一定争议,但目前大多数人认为其诊断标准应包括以下几点[5-6]:(1)肿瘤必须是卵巢甲状腺肿恶变,有明确侵犯及(或)转移,不能单纯以细胞异型为依据,因其具有功能性;(2)肿瘤类型必须类似乳头状癌及(或)滤泡癌,偶为嗜酸性细胞癌或间变癌;(3)免疫组化测定显示癌细胞胞质内TG呈阳性表达;(4)必须排除甲状腺原发癌的转移;(5)必须与卵巢甲状腺肿类癌和浆液性乳头状囊腺癌鉴别。但同时Szyfelbein等[7-8]指出,在一组比较复杂的畸胎瘤中,甲状腺组织形成肉眼可识别的成分也属卵巢甲状腺肿,有甲状腺肿和类癌组成的肿瘤称甲状腺肿类癌。甲状腺肿中有甲状腺癌也可为恶性甲状腺肿,本组中有2例分别为卵巢甲状腺肿类癌和卵巢囊性成熟性畸胎瘤伴甲状腺肿类癌,病理切片可见肿瘤组织中含有甲状腺滤泡及类癌两种成分,且两者有移行,类癌细胞以梁状型多见,行免疫组化染色突出素(SYN)、嗜铬素(CgA)及TG均阳性。
鉴于卵巢甲状腺肿的良、恶性病理诊断分类标准尚有争议,因此超声发现卵巢甲状腺肿的恶变共性特征显得尤为重要。有学者提出的超声卵巢肿瘤风险预测标准也很有帮助,分为高风险:内有血流信号的任何卵巢肿块;中等风险:无血供的厚壁、厚隔或含实质区域卵巢肿块;低风险:无血供的薄壁、薄隔的卵巢囊性肿块[9]。本组患者中有2例囊实性包块的实性区域内伴有血流信号,可归类为高风险,后经手术及病理诊断证实为卵巢甲状腺类癌及卵巢囊性成熟性畸胎瘤伴甲状腺类癌。
卵巢恶性甲状腺肿的生物学行为各家报道不一,目前多认为该瘤虽为恶性,但临床进展缓慢,预后较其他卵巢恶性肿瘤好[10-12]。治疗上一般行患侧附件切除或全子宫双附件切除术,对已有转移或扩散者,可加行全甲状腺切除术,辅以131I放疗后长期甲状腺素替代治疗。Checrallah等[10]在使用放射性碘前,采用了重组人促甲状腺激素治疗1例有肺和骨转移的晚期卵巢恶性甲状腺肿患者,有效解决了甲状腺切除后患者内源性促甲状腺激素不足的难题,疗效显著,患者已稳定存活2年,这一方案给该肿瘤的治疗提供了新的途径。
综上所述,超声对于卵巢肿块定性检查、确定盆腔受累范围,以及临床选择治疗模式有较大的参考价值。
[1]王芳,冯文,陈鹏.卵巢甲状腺肿5例临床分析并文献复习[J].中国卫生产业,2012,9(14):142.
[2]黄未钦,黄加兴,任永富.卵巢甲状腺肿的超声表现探讨[J].福建医药杂志,2009,31(1):106-108.
[3]Matsuda K,Maehama T,Kanazawa K,et al.Malignant struma ovarii with thyrotoxicosis[J].Gynecol Oncol,2001,82(3):575-577.
[4]Volpi E,Ferrero A,Nasi P G,et al.Malignant struma ovari:a case report of laparoscopic management[J].Gynecol Oncol,2003,90 (1):191-194.
[5]Willemes P H,Oosterhuis J W,Aalders J G,et al.Malignant struma ovarii treated by ovariectomy,thyroidectomy and 131I administration[J].Cancer,1987,60(2):178-182.
[6]武忠弼,杨光华.中华外科病理学[M].北京:人民卫生出版社,2002: 1395-1397.
[7]Szyfelbein W M,Young R H,Scully R E.Struma ovarii simulating ovarian tumors of other types.A report of 30 cases[J].Am J Surg Pathol,1995,19(1):21-29.
[8]Szyfelbein W M,Young R H,Scully R E.Cystic struma ovarii:a frequently unrecognized tumor.A report of 20 cases[J].Am J Surg Pathol.1994,18(8):785-788.
[9]Barroilhet L,Vitonis A,Shipp T,et ai.Sonographic predictors of ovarian malignancy[J].J Clin Ultras,2013,5(41):269-274.
[10]Checrallah A,Medlej R,Saade C,et al.Malignant struma ovarii: an unusual presentatio[J].Thyroid,2001,11(9):889-892.
[11]Christopher P,Desimone M D,Subodh M,et al.Malignant struma ovari:a case report and analysis of cases reportcd in the literature with focus on survival and131I therapy[J].Gynecol Oncol, 2003,89(3):543-548.
[12]Chechia A,Koubaa A,Makhlouf T,et al.Struma ovarii.report of a malignant and a benign case[J].Tunis Med,2002,80(1):53-56.
2014-02-25)
(本文编辑:沈叔洪)
311800 诸暨市人民医院超声科通信作者:宣婧婧,E-mail:25393086@qq.com

