痛风患者血清P2X7R水平的检测及其与炎症因子的相关性研究
彭勇 陈勇 邬秀娣 张振 于静雅 龚琼瑶
痛风患者血清P2X7R水平的检测及其与炎症因子的相关性研究
彭勇 陈勇 邬秀娣 张振 于静雅 龚琼瑶
目的 通过检测痛风性关节炎患者血清中嘌呤能受体(P2X7R)及痛风相关炎症因子的水平,并分析P2X7R与痛风相关炎症因子的相关性,探讨P2X7R在痛风发病中的作用。 方法 采用ELISA法检测20例痛风初次发作患者(痛风组,包括急性发作期和完全缓解期)、20例高尿酸血症患者(高尿酸血症组)及20例健康志愿者(健康对照组)血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平,比较痛风组患者急性发作期和完全缓解期各指标间的差异,以及痛风组患者急性发作期和完全缓解期与其他两组间的差异;分析各组P2X7R水平与血沉、C反应蛋白、IL-1β、TNF-α、IL-6、IL-8及IL-18水平的相关性。 结果 痛风组患者急性发作期的P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平均显著高于完全缓解期、高尿酸血症组及健康对照组,差异均有统计学意义(均P<0.05);而痛风组患者完全缓解期、高尿酸血症组及健康对照组的P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平组间比较均无明显统计学差异(均P>0.05)。P2X7R表达与血沉、C反应蛋白、IL-1β及IL-18均呈正相关(均P<0.05),而与TNF-α、IL-6及IL-8无明显相关(P>0.05)。 结论 痛风患者急性发作期血清中的P2X7R表达水平升高且与血沉、C反应蛋白、IL-1β及IL-18炎症指标密切相关,推测P2X7R可能是痛风急性发作的一个关键因素,并可能成为预防痛风的急性发作的新靶点。
痛风 嘌呤能受体 高尿酸血症 白细胞介素
痛风性关节炎是一种由高尿酸血症引起单钠尿酸盐(MSU)沉积所致的晶体相关性关节病,属自身炎症性疾病[1]。痛风的发病机制尽管目前尚未十分明确,但近年来多数研究均认为MSU晶体可以与胞膜Toll样(TLRs)受体以及胞内的NALP3炎症体结合,然后通过一系列信号传导途径诱导白细胞介素(IL)-1β前体及IL-18等炎症因子的转录、成熟及释放从而引起痛风的急性发作[2-4]。这虽然可以解释MSU晶体诱发痛风发作的机制,但并非所有高尿酸血症的患者或者有MSU晶体沉积的患者就一定会发展为痛风,说明单一因素的MSU晶体沉积并不一定能诱发痛风急性炎症的发生。因此,近年来有学者提出嘌呤能受体(P2X7R)可能是痛风急性发作的一个潜在调节器[5]。Eleftheriadis等[6]发现P2X7R抑制剂可以抑制MSU晶体诱导的淋巴细胞IL-1β的分泌和增殖。笔者通过检测痛风患者血清中P2X7R及痛风相关炎症因子的水平,分析P2X7R与各炎症指标的相关性,探讨P2X7R与痛风相关炎症因子的关系及其在痛风发病过程中的作用,现报道如下。
1 对象和方法
1.1 对象 收集2013-06—2014-01我院风湿免疫科门诊和住院20例初次发病的痛风患者及20例高尿酸血症患者,痛风组患者均符合1977年美国风湿病学会痛风的诊断标准[7],并分为急性发作期和完全缓解期两个阶段,急性发作期符合以下条件:(1)痛风初次发作0~48h内,临床表现为寡关节肿胀疼痛,患者主诉疼痛程度评分(VRS-4法)>5分;(2)炎症指标(血沉和C反应蛋白)升高。完全缓解期为初次急性发作经正规抗炎治疗7~14 d后且符合以下条件:患者主诉疼痛程度评分<1分,炎症指标(血沉和C反应蛋白)降至正常范围。所有患者血清尿酸水平均高于正常范围,其中男性>420μmol/L,女性>360μmol/L。选取同期在我院健康体检中心常规体检的健康志愿者20例作为健康对照组。所有受试者均排除合并有心血管系统疾病、恶性肿瘤、肝病、肾功能障碍、高血压、糖尿病、其他急慢性炎症、感染及自身免疫性疾病等其他疾病病史者。本研究得到宁波市伦理委员会批准,所有受试者均知情同意。
1.2 标本采集 所有受试者均空腹8h以上,晨起抽取外周静脉血5ml。室温下待血液凝固后,3 000 r/min离心10min,收集上清液,于-80℃冰箱保存待测。痛风组急性发作期患者采血前未进行任何治疗;痛风组完全缓解期患者为急性发作期患者经非甾体抗炎药和秋水仙碱或激素正规治疗7~14d后,痛风完全缓解后取血。同时记录3组留血当日在我院进行实验室化验的血沉、C反应蛋白及血尿酸水平等一般资料。
1.3 监测方法和指标 采用ELISA法检测痛风组(急性发作期和完全缓解期)、高尿酸血症组和健康对照组血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平,并记录实验结果。所有ELISA检测试剂盒均购自北京索莱宝生物公司,操作严格按照说明书进行。
1.4 统计学处理 采用SAS 9.2统计软件。计量资料采用表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用SNK法。P2X7R与各项检测指标的关系采用Pearson相关分析。
2 结果
2.1 3组间一般资料的比较 3组间年龄、性别构成的差异无统计学意义(P>0.05)。痛风急性发作期患者的血沉、C反应蛋白及血尿酸水平均高于完全缓解期(P<0.05),高尿酸血症组患者血尿酸水平高于健康对照组(P<0.05),详见表1。
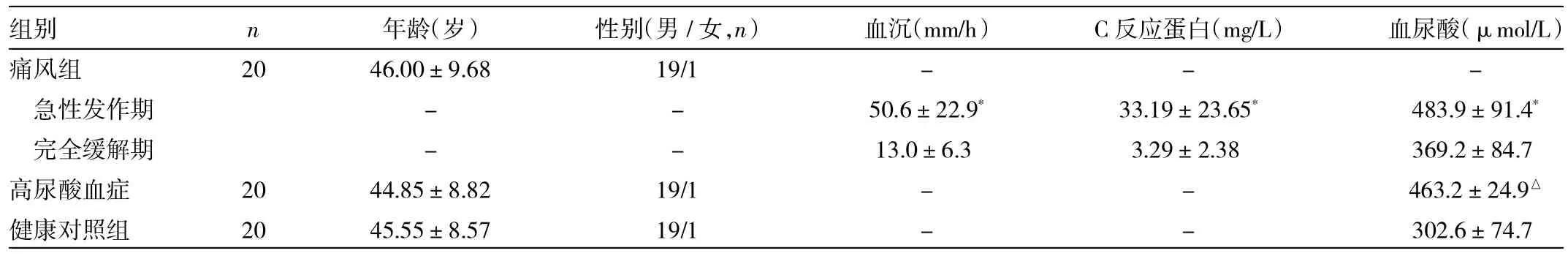
表1 3组间一般资料的比较
2.2 痛风组患者各项检测指标结果的比较 痛风组患者急性发作期血清中P2X7R水平显著高于完全缓解期,差异有统计学意义(P<0.01);痛风组患者急性发作期血清中IL-1β、TNF-α、IL-6、IL-8及IL-18等炎症因子水平也均显著高于完全缓解期,差异有统计学意义(P<0.05),详见图1。
2.3 3组各项检测指标结果的比较 痛风组患者急性发作期血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平均显著高于高尿酸血症组和健康对照组,差异均有统计学意义(均P<0.05);而痛风组患者完全缓解期血清中P2X7R、IL-1β、TNF-α、IL-6、IL-8及IL-18水平与高尿酸血症组及健康对照组比较,差异均无统计学意义(均P>0.05),详见表2。
2.4 P2X7R与其他炎症指标的相关性 相关性分析发现,各组P2X7R水平与血沉、C反应蛋白、IL-1β及IL-18水平呈正相关(r=0.58、0.671、0.451、0.796,均P<0.05),而与TNF-α、IL-6及IL-8水平均无明显相关性(r= 0.305、0.373、0.420,均P>0.05)。
3 讨论
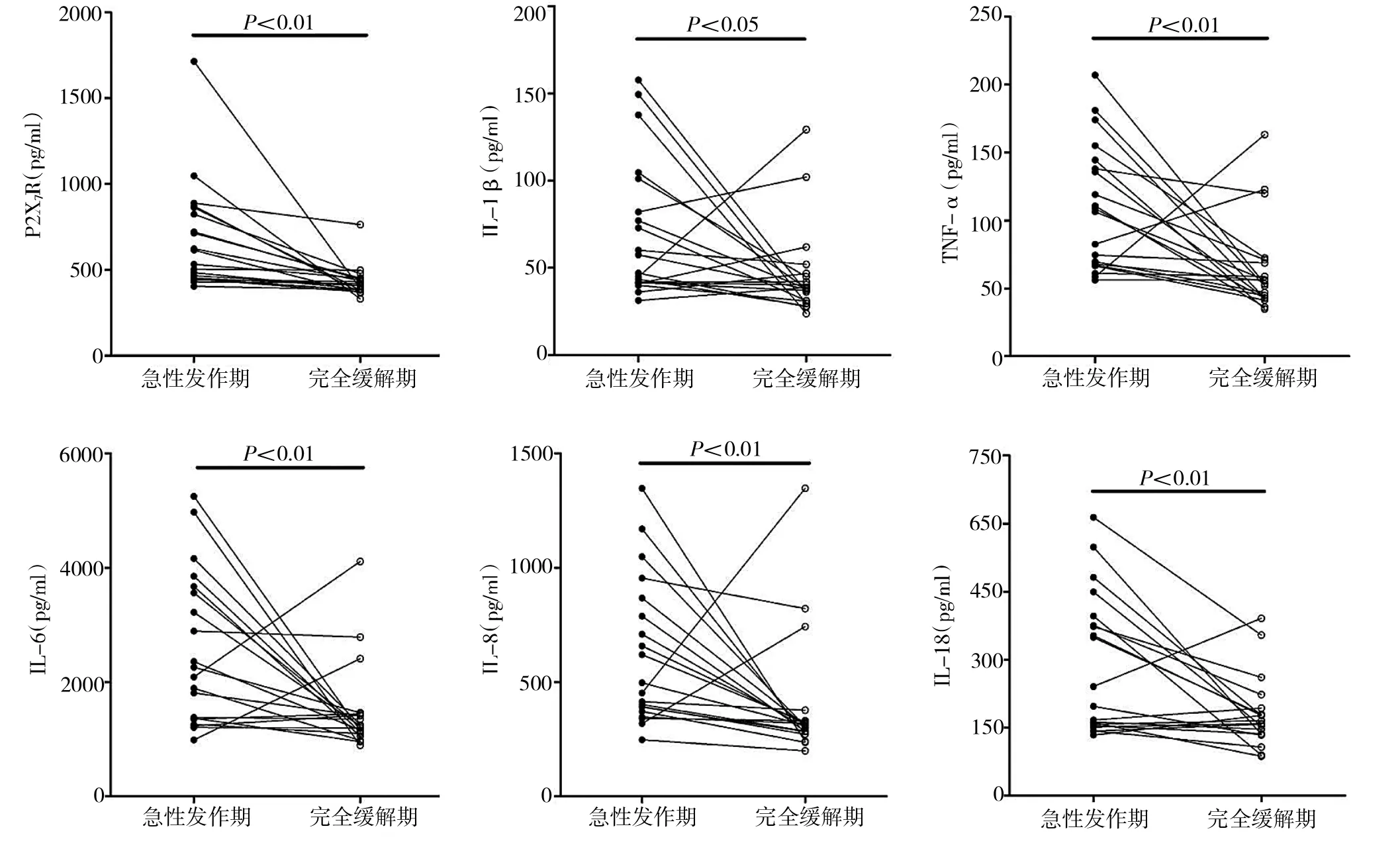
图1 痛风组急性发作期与完全缓解期各项检测指标结果的比较
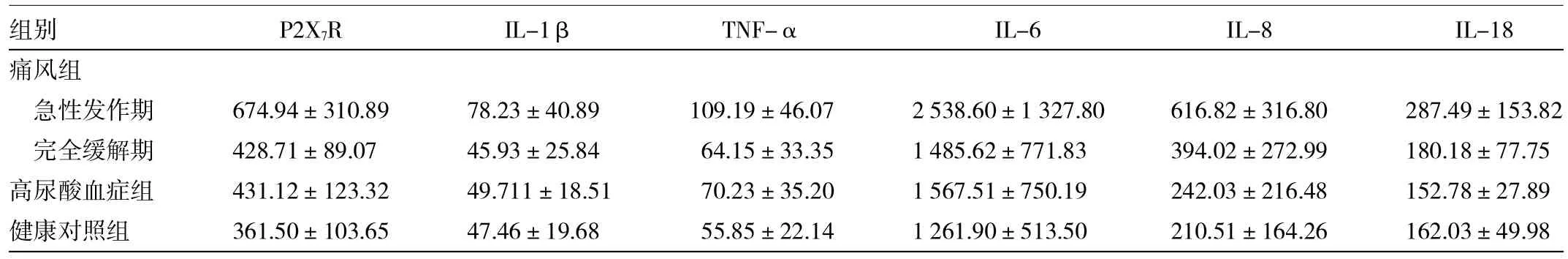
表2 3组间各项检测指标结果的比较(pg/ml)
早在20世纪60年代有学者发现在人和狗的关节内注射MSU晶体后,注射关节会出现类似于痛风急性发作的临床表现,MSU晶体沉积也因此被认为是痛风的关键致病因素。目前的研究已证实长期血尿酸增高而引起的MSU晶体沉积可以被NALP3炎症体识别,然后诱导体内IL-1β的转录、成熟及释放从而诱发痛风;而IL-1β则被认为是痛风炎症发生的核心因子[8]。但一项来自欧洲的流行病学调查显示血尿酸水平>590μmol/L的高尿酸血症患者痛风5年累积患病风险也仅为30.5%[9]。临床上发现相当一部分高尿酸血症患者甚至有MSU沉积的患者也并没有发展为痛风,说明单一因素的MSU沉积还不足以诱导足够数量的IL-1β释放来诱发痛风的急性发作。因此,痛风急性发作可能还需要其他因素的共同参与。
目前普遍观点认为剧烈运动、寒冷刺激、酗酒及暴饮暴食等诱因是通过引起血液中血尿酸水平升高而诱发痛风急性发作,但目前有学者提出这些诱因可能是通过引起体内ATP水平剧烈变化而参与痛风急性发作,而并非通过提高血尿酸水平[5]。ATP可以与其天然受体P2X7R结合促使通道开放引起K+外流,与NALP3炎症体共同作用刺激IL-1β的大量成熟及释放[10-11]。P2X7R作为一个配体门控离子通道受体,且大量表达于巨噬细胞及单核细胞等炎症细胞。目前已经在多种疾病研究中发现P2X7R参与了包括IL-1β、TNF-α、IL-6及IL-18等炎症因子的产生和释放[12-14],而这些炎症因子也参与痛风炎症过程。
本次研究通过检测痛风组(急性发作期和完全缓解期)、高尿酸血症组和健康对照组血清中P2X7R水平发现,痛风患者初次急性发作期P2X7R水平显著高于完全缓解期,同时也显著高于高尿酸血症组和健康对照组,推测P2X7R可能参与了痛风的急性发作。此外,对P2X7R与各个炎症指标进行相关分析,分析结果表明P2X7R与血沉及C反应蛋白呈正相关,这进一步表明P2X7R可能参与痛风炎症过程。同时,笔者还发现P2X7R水平与IL-1β及IL-18水平呈正相关,而与TNF-α、IL-6及IL-8则无明显相关,推测P2X7R可能与IL-1β及IL-18的产生及释放有关。
综上所述,P2X7R在痛风急性发作期的表达升高且与痛风炎症密切相关,还可能参与了IL-1β及IL-18等痛风相关炎症因子的产生和释放;因此,推测P2X7R可能在痛风发病过程起着关键的调节作用。本研究为进一步研究P2X7R在痛风发病过程中的意义提供了实验和理论依据,也为急性痛风发作的临床防治提供了一条可行的新策略。本文对P2X7R在痛风发病过程中的作用仅进行初步研究,且样本量较小,故仍需进一步进行大样本及机制方面的深入研究。
[1]Masters S L,Simon A,Aksentijevich I,et al.Horror autoinflammaticus:the molecular pathophysiology of autoinflammatory disease [J].Annu Rev Immunol,2009,27:621-668.
[2]Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome[J].Nature,2006,440 (7081):237-241.
[3]Kingsbury S R,Conaghan P G,Mc Dermott M F.The role of the NLRP3 inflammasome in gout[J].J Inflamm Res,2011,4:39-49.
[4]Mitroulis I,Kambas K,Ritis K.Neutrophils,IL-1beta,and gout:is there a link[J]?Semin Immunopathol,2013,35(4):501-512.
[5]Tao J H,Zhang Y,Li X P.P2X7R:a potential key regulator of acute gouty arthritis[J].Semin Arthritis Rheum,2013,43(3):376-380.
[6]Eleftheriadis T,Pissas G,Karioti A,et al.Uric acid induces caspase-1 activation,IL-1beta secretion and P2X7receptor dependent proliferation in primary human lymphocytes[J].Hippokratia, 2013,17(2):141-145.
[7]Wallace S L,Robinson H,Masi A T,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[8]Mitroulis I,Kambas K,Chrysanthopoulou A,et al.Neutrophil extracellular trap formation is associated with IL-1beta and autophagy-relatedsignalingingout[J].PLoSOne,2011,6(12):e29318.[9]Annemans L,Spaepen E,Gaskin M,et al.Gout in the UK and Germany:prevalence,comorbidities and management in general practice 2000-2005[J].Ann Rheum Dis,2008,67(7):960-966.
[10]Kahlenberg J M,Dubyak G R.Mechanisms of caspase-1 activation by P2X7receptor-mediated K+release[J].Am J Physiol Cell Physiol,2004,286(5):C1100-1108.
[11]Petrilli V,Papin S,Dostert C,et al.Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration[J].Cell Death Differ,2007,14(9):1583-1589.
[12]Friedle S A,Brautigam V M,Nikodemova M,et al.The P2X7-Egr pathway regulates nucleotide-dependent inflammatory gene expression in microglia[J].Glia,2011,59(1):1-13.
[13]Gourine A V,Poputnikov D M,Zhernosek N,et al.P2 receptor blockade attenuates fever and cytokine responses induced by lipopolysaccharide in rats[J].Br J Pharmacol,2005,146(1):139-145.
[14]Kucher B M,Neary J T.Bi-functional effects of ATP/P2 receptor activationon tumornecrosisfactor-alpha release inlipopolysaccharide-stimulated astrocytes[J].J Neurochem,2005,92(3): 525-535.
Serum P2X7receptor levels and its correlation with inflammatory factors in gout patients
Objective To determine serum levels of P2X7receptor and inflammatory factors and to analyze their correlation in gout patients.Methods Serum levels of P2X7receptor,IL-1β,TNF-α,IL-6,IL-8 and IL-18 were detected by ELISA method in 20 patents with gout,20 patents with hyperuricemia and 20 healthy subjects,the correlations of serum P2X7receptor with inflammatory factors were analyzed.Results P2X7receptor,IL-1β,TNF-α,IL-6,IL-8 and IL-18 levels in gout patients of acute attack stage were significantly higher than those in complete remission period(P<0.05),and also higher than those in hyperuricemia group and healthy control group(P<0.05).There were no significant differences in P2X7receptor,IL-1β,TNF-α, IL-6,IL-8 and IL-18 among patients with complete remission period,hyperuricemia and healthy controls(P>0.05).The level of serum P2X7receptor was positively correlated with ESR,CRP,IL-1β and IL-18(P<0.05),but not correlated with TNF-α,IL-6 and IL-8(P>0.05). Conclusion The levels of P2X7receptor in gout patients of acute attack stage are elevated,and closely correlated with inflammatory factors,indicating that P2X7receptor may be a key factor in acute attack stage of gout,and may become a new target for prevention of acute attack in gout patients.
Gout P2X7receptor Hyperuricemia Interleukin
2014-08-26)
(本文编辑:严玮雯)
(本文由浙江省医学会风湿病学分会推荐)
315010 宁波市第二医院风湿免疫科通信作者:陈勇,E-mail:nbdeyycy@163.com

