大骨瓣减压手术治疗恶性脑梗死的临床评价
王卫余 雷兵 张卫华 杨开创
大骨瓣减压手术治疗恶性脑梗死的临床评价
王卫余 雷兵 张卫华 杨开创
目的 探讨大骨瓣减压手术治疗恶性脑梗死患者的疗效和影响因素。方法选取42例因恶性脑梗死行减压手术的患者,回顾分析患者年龄、入院时及术前格拉斯哥昏迷评分(GCS)、术前瞳孔变化、中线移位程度、起病至手术时间、手术方式与术后格拉斯哥预后评分(GOS)的关系,根据GOS将患者分为预后良好组(GOS 4~5分)与不良组(GOS 1~3分)进行比较。结果GOS预后良好组18例(42.9%);预后不良组24例(57.1%),其中死亡7例。两组患者年龄、术前是否出现两侧瞳孔不等大、术前GCS的差异均有统计学意义(均P<0.05)。结论恶性脑梗死发生后,患者一旦出现意识障碍并进行性加重,应及时手术,尤其是相对年轻的患者;当患者出现深度昏迷(GCS<8分)、瞳孔不等大时再进行手术,患者预后较差。手术的关键是制作足够大的骨瓣进行充分减压。
脑梗死 去骨瓣减压术 脑水肿
急性大面积脑梗死常波及2个以上脑叶甚至整个大脑半球,以大脑中动脉分布区最常见,这主要由于大脑中动脉为颈内动脉的直接延续,心脏、颈内动脉等脱落的栓子顺血流可直接进入大脑中动脉而引起该动脉供血区栓塞。急性大面积脑梗死常导致严重的脑水肿,引起颅内压增高,患者出现意识障碍,并可诱发脑疝,故又称为恶性脑梗死。目前常规的内科保守治疗对控制颅内压作用有限,病死率高达80%。外科减压手术可明显降低经内科保守治疗无效的恶性脑梗死患者的病死率[1]。但目前文献对手术病例的选择、手术时机的把握以及术后患者的生存质量等热点问题仍存在诸多争议。本研究通过回顾分析42例手术患者的临床资料,结合文献对大骨瓣减压手术治疗恶性脑梗死的疗效和影响因素作一探讨。
1 对象和方法
1.1 对象 收集我科2007-05—2013-03因恶性脑梗死进行大骨瓣减压手术患者的资料。病例入选标准:(1)CT或MRI检查证实大脑中动脉供血区2/3以上急性缺血;(2)患者发病后逐步出现意识障碍;(3)术前格拉斯哥昏迷评分(GCS)≤12分。排除标准:(1)既往发生过脑血管意外并且有中、重度神经功能障碍后遗症;(2)同时存在对侧半球脑梗死或出血。入选患者42例,其中男24例,女18例,年龄34~81岁,平均(62.74±11.24)岁。所有患者均先由神经内科收治,进行扩张血管、改善脑微循环等保守治疗,并动态复查头颅CT或头颅MRI,根据病情及影像学变化,请神经外科医师会诊后确定有手术指证,并征得患者家属同意,实施大骨瓣减压手术。收集患者的性别、年龄、入院时GCS、术前GCS、术前有无两侧瞳孔不等大、中线移位程度(CT测量以透明隔显示层面作为标准)、起病至手术的时间、是否内减压、术后3个月时格拉斯哥预后评分(GOS)等资料。
1.2 手术方法 气管插管全麻下行患侧额颞顶大骨瓣减压术。采用大问号形皮肤切口,起自耳屏前0.5~1 cm处(保留颞浅动脉前支或后支),在耳廓后缘弧形向上至顶结节,然后向前至发际前缘正中线处止。骨窗缘前界至额极,下界平颧弓,后界达乳突前方,骨窗前后径至少>10cm,向深部咬除蝶骨嵴,并咬除颞骨鳞部直至与中颅底齐平以解除或减轻颞叶钩回疝;将四周硬脑膜悬吊后放射状或十字形切开,取颞肌筋膜或人工脑膜减张缝合硬脑膜。其中9例同时行颞叶或额叶部分脑组织切除以内减压,3例行硬膜下颅内压探头植入用于术后颅内压监测。术后予以扩容、扩张血管、降低颅内压、激素等治疗,不使用止血药物。
1.3 预后评估 患者术后3个月时GOS,5分为恢复良好,4分为轻度残疾,3分为重度残疾,2分为植物生存,1分为死亡。GOS 4~5分为预后良好,共18例;1~3分为预后不良,共24例(术后因脑疝及其他严重并发症死亡的7例归入此组)。对两组患者年龄、头颅CT所示中线移位程度、入院时GCS、术前GCS、是否出现两侧瞳孔不等大、发病至手术的间隔时间、术中内减压等7个可能影响预后的相关因素与GOS的关系进行统计分析。
1.4 统计学处理 使用SPSS 18.0统计软件,计数资料的比较采用χ2检验或校正的χ2检验,再作logistic多因素回归分析。
2 结果
GOS1~3分组与GOS4~5分组恶性脑梗死患者预后相关因素的比较见表1。
由表1可见,两组患者入院时GCS、中线移位程度、发病至手术的时间、有无内减压的差异均无统计学意义(均P>0.05),而年龄、术前瞳孔有无不等大、术前GCS的差异均有统计学意义(均P<0.05)。logistic多因素回归分析结果显示,术前GCS是影响预后的独立相关因素。
3 讨论
脑缺血早期引起脑细胞毒性水肿,缺血持续存在引起脑细胞坏死,导致脑组织肿胀、颅内压升高;增高的颅内压进一步影响局部脑血流和组织灌注,从而形成恶性循环。此时脱水药物难以从根本上缓解脑水肿所致的中线移位、颅内压增高,而去大骨瓣减压术可使颅内高压得到明显缓解,使缺血的部分脑组织恢复血供,降低患者的病死率和致残率,可使恶性脑梗死患者的病死率从保守治疗的60%~100%降低至0~29%[1-2]。本文患者的病死率为16.7%(7/42)。此外,除了关注恶性脑梗死患者的生存率以外,更应重视患者的生存质量,术后患者无意义的植物生存和重度残疾对家庭和社会造成沉重负担。因此,探讨患者手术预后的相关因素,选择合适的病例进行手术,有着确切的临床实用意义。
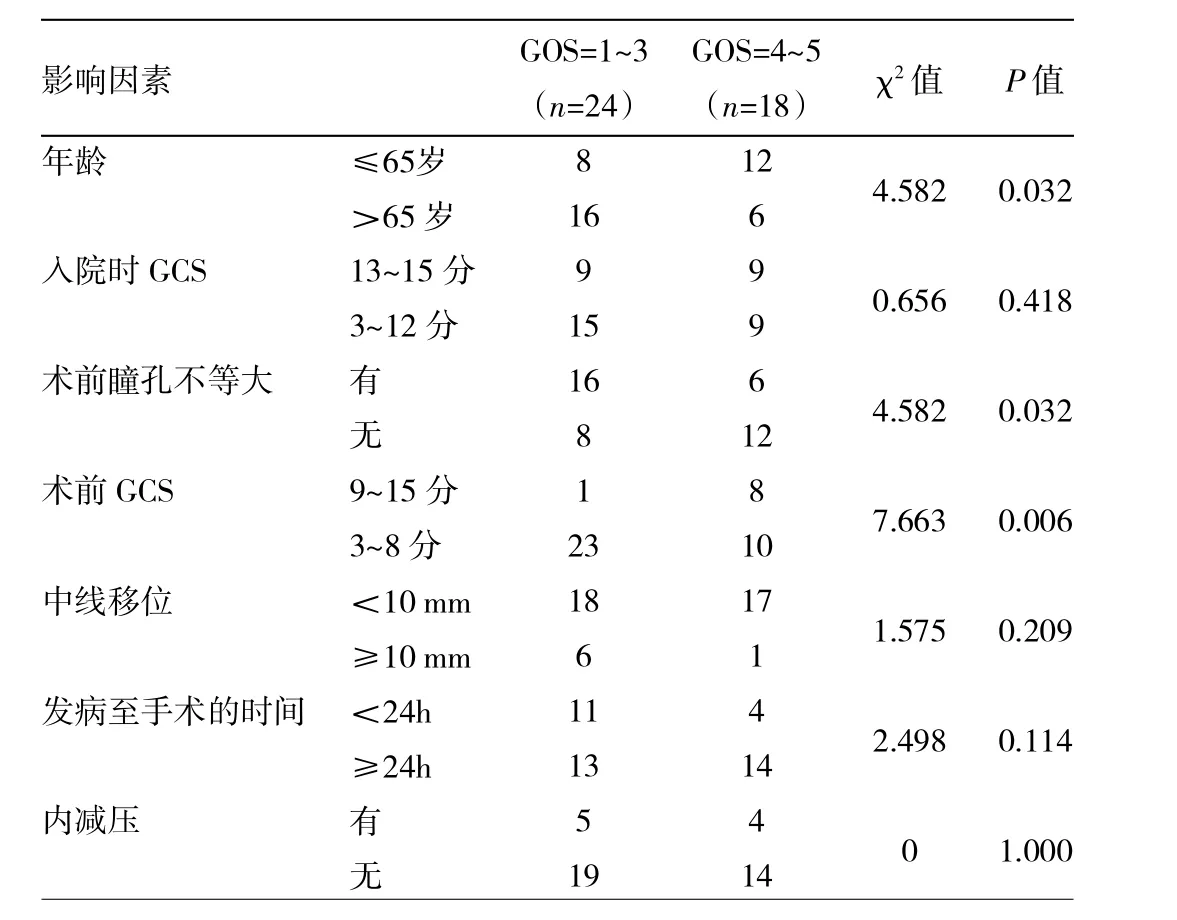
表1 两组恶性脑梗死患者预后相关因素的比较
有多项临床研究认为,减压手术虽能降低老年患者的病死率,但术后患者生存质量较差,因而对70岁以上的恶性脑梗死患者进行减压手术持谨慎态度[3-4]。本文结果显示65岁以上患者手术治疗预后较差。然而最近国内赵劲伟等[5]的研究则认为60~80岁的恶性脑梗死老年患者接受减压手术不仅能挽救生命,也同样能改善生存质量。笔者认为高龄并非是手术的绝对禁忌证,重点在于术前正确评估高龄患者的基础疾病状况,如患者的心肺功能能否耐受全麻手术,以及术后可能出现并发症的风险。本组7例死亡患者中,2例术后早期死于脑疝,5例在术后4周至2个月死于其他脏器严重并发症。
术前患者意识障碍程度直接反映神经功能受损的严重程度,是恶性脑梗死患者病情变化最客观的指标,与手术预后密切相关,也是文献中较为肯定、争议最少的一个预测指标。本文多因素回归分析结果也显示术前GCS是影响预后的独立相关因素。GCS作为昏迷评分标准,使用简便、客观,可作为恶性脑梗死患者的重要手术指征。瞳孔不等大则是意识障碍进一步恶化、脑疝发生的可靠体征。与CT中线结构移位程度相比,瞳孔变化的出现能更明确提示颅内压增高的严重程度,更具有临床预后意义。术前昏迷程度越深,存在瞳孔不等大,提示术后患者预后越差。多数文献认为术前GCS 8~10分的患者预后较好,术前已发生脑疝的患者术后死亡或植物生存的可能性较大[6]。Park等[7]回顾分析26例患者,术前GCS平均5.84分,术后16例患者预后不良。本文患者总体预后低于预期,术后预后不良患者占57.1%,这与早期病例多在出现脑疝前期表现或脑疝时才手术有关,患者术前GCS总体较低,平均仅6.79分。根据本文结果并结合文献分析,笔者认为患者发生恶性脑梗死后,一旦出现意识障碍并进行性加重,就应及时手术;当患者出现深度昏迷(GCS<8分)、瞳孔不等大时再进行手术则预后不良。
发生恶性脑梗死后是否行预防性减压术或早期减压术,目前存在较大分歧。大面积脑梗死患者发生严重脑水肿、脑肿胀的高峰期在起病后24~72h。有学者认为应在起病后24h内进行减压手术;早期手术不仅能降低病死率,而且有助于患者神经功能的恢复。Cho等[8]报道一组52例患者,其中超早期(发病后6h内)手术者病死率为8.7%,24h内手术者为36.7%,24h后手术者为80.0%。Schwab等[9]对早期与延期手术的患者进行比较后认为,两者的差别仅在于术后需要重症监护的时间长短。Fandino等[10]的回顾性研究认为早期手术虽能降低患者的病死率,但患者并不能因此获得更好的生存质量。一项荟萃分析研究也认为早期手术(起病后24h内)并不能获得更好的预后[2]。本文结果也不支持早期手术。文献统计仅10%的大面积恶性脑梗死患者最终需要手术[11]。问题的关键在于早期预测发生恶性脑梗死的可能性,因此,确定一个较为可靠的、可量化的预测指标仍是目前研究的重点。已有研究发现,脑梗死体积大于240cm3和血管造影显示闭塞血管再通是预测发生恶性脑梗死的两个重要指标[12]。Wartenberg[13]则认为发病14h内CT显示脑梗死范围超过大脑中动脉区域的50%及磁共振弥散加权成像计算梗死体积大于145ml是唯一有价值的指标。笔者认为应区别对待老年患者和相对年轻的患者,即由于老年患者存在的脑萎缩可使颅内高压部分缓解,发生恶性脑梗死的可能性要大大低于年轻患者。
本文患者中仅9例术中行内减压术。理论上颞叶切除可减少发生颞叶钩回疝的风险,然而其疗效并未被临床证实[14]。术中仅凭肉眼很难辨别真正的失活组织与缺血半暗带组织,而且内减压增加了手术操作的难度和时间,术后并发脑内血肿的可能性也变大。本组有4例术中未行内减压的患者术后CT复查显示低密度的梗死灶范围较术前缩小,说明术后部分脑组织再灌注已恢复。CT灌注研究也证实减压术后再灌注的发生[15]。本组3例术后颅内压监护患者术中均未行内减压,术后颅内压均未超过20mmHg。笔者认为内减压作用有限,并非必需;尤其当梗死发生在优势半球时,内减压更应慎重。手术的关键在于制作足够大的骨瓣进行充分外减压。而且,术后脑实质出血与骨窗直径存在显著相关性,骨瓣直径越小(<10cm)越有可能出血,出血后病死率则明显增加[2]。
综上所述,恶性脑梗死一旦发生,患者出现意识障碍并进行性加重,应在其GCS>8分、未出现瞳孔不等大前进行减压手术,年轻患者更应及时手术;手术的关键是制作足够大的骨瓣进行充分减压。
[1]韩松,周晓平.急性大面积脑梗塞的外科治疗[J].临床神经外科杂志, 2008,5(2):108-110.
[2] Vahedi K,Hofmeijer J,Juettler E,et al.Early decompressive surgery in malignant infarction of the middle cerebral artery:a pooled analysis of three randomised controlled trials[J].Lancet Neurol,2007,6(3):215-222.
[3]Yao Y,Liu W,Yang X,et al.Is decompressive craniectomy for malignant middle cerebral artery territory infarction of any benefit for elderly patients[J]?Surg Neurol,2005,64(2):165-169.
[4]Rabinstein A A,Mueller-Kronast N,Maramattom B V,et al.Factors predicting prognosis after decompressive hemicraniectomy for hemispheric infarction[J].Neurology,2006,67(6):891-893.
[5]Jingwei Zhao,Yingying Su,Yan Zhang,et al.Decompressive hemicraniectomy in malignant middle cerebral artery infarct:a randomized controlled trial enrolling patients up to 80 years old[J].Neurocrit Care,2012,17(2):161-171.
[6]Ashok P,Sajesh K M,Satyendra K,et al.Decompressive hemicraniectomy in malignant middle cerebral artery infarction:an analysis of long-term outcome and factors in patient selection[J].Neurosurg,2007,10(1):59-65.
[7] Je-On Park,Dong-Hyuk Park,Sang-Dae Kim,et al.Surgical treatment for acute,severe brain Infarction[J].Korean Neurosurg Soc,2007,42(3):326-330.
[8]Cho D Y,Chen T C,Lee H C.Ultra-early decompressive craniectomy for malignant middle cerebral artery infarction[J].Surg Neurol,2003,60(1):227-232.
[9] Schwab S,Steiner T,Aschoff A,et al.Early hemicraniectomy in patients with complete middle cerebral artery infarction[J].Stroke, 1998,29(9):1888-1893.
[10] Fandino J,Keller E,Barth A,et al.Decompressive craniotomy after middle cerebral artery infarction.Retrospective analysis ofpatients treated in three centres in Switzerland[J].Swiss Medical Weekly,2004,134(3):423-429.
[11]Ralph Rahme,Richard Curry,Dawn Kleindorfer,et al.How often are ischemic stroke patients eligible for decompressive hemicraniectomy[J]?Stroke,2012,43(2):550-552.
[12]Gupta R,Connolly E S,Mayer S,et al.Hemicraniectomy for massive middle cerebral artery territory infarction:a systematic review[J].Stroke,2004,35(2):539-543.
[13] Wartenberg K E.Malignant middle cerebral artery infarction[J].Curr Opin Crit Care,2012,18(1):152-163.
[14]Mori K,Nakao Y,Yamamoto T,et al.Early external decompressive craniectomy with duroplasty improves functional recovery in patients with massive hemispheric embolic infarction:timing and indication of decompressive surgery for malignant cerebral infarction[J].Surg Neurol,2004,62(3):420-429.
[15] Bendszus M,Müllges W,Goldbrunner R,et al.Hemodynamic effects of decompressive craniotomy in MCA infarction:evaluation with perfusion CT[J].Eur Radiol,2003,13(8):1895-1898.
Efficacy of decompressive hemicraniectomy for patients with malignant cerebral infarction
ObjectiveTo evaluate the clinical efficacy of decompressive hemicraniectomy in patients.MethodsForty two patients with malignant cerebral infarction were treated with decompressive hemicraniectomy.The clinical data including:age,Glasgow Coma Scale(GCS)score on admission and before surgery,anisocoria,degree of midline shift,the time from diagnosis to surgery,surgical modalities were retrospectively reviewed.Clinical outcomes were assessed by the Glasgow Outcome Scale(GOS).ResultsAmong 42 patients,18(42.9%)achieved a good outcome(GOS4-5)and 24(57.1%)had a poor outcome (GOS1-3).Older age,presence of anisocoria before surgery and lower preoperative GCS score were associated with poor outcomes(P<0.05).ConclusionPatients with preoperative GCS score less than 8 and anisocoria has poor outcome of malignant cerebral infarction,so decompressive hemicraniectomy should be performed prior to the presence of anisocoria and increased disturbance of consciousness,especially for younger patients.
Cerebral infarction Decompressive hemicraniectomy Brain edema

2013-08-14)
(本文编辑:沈叔洪)
310014 杭州,浙江省人民医院神经外科

