槲皮素亚微乳的制备及特性表征研究
刘 芸, 赵 鹏, 张丽华, 宋 逍, 段 玺
(1.陕西中医学院附属医院, 陕西 咸阳 712000; 2.陕西中医学院药学院, 陕西 咸阳 712046)
槲皮素亚微乳的制备及特性表征研究
刘 芸1, 赵 鹏2, 张丽华2, 宋 逍2, 段 玺1
(1.陕西中医学院附属医院, 陕西 咸阳 712000; 2.陕西中医学院药学院, 陕西 咸阳 712046)
目的 制备槲皮素亚微乳,并对其理化性质进行表征。方法 采用高压均质法结合单因素试验,以外观性状、槲皮素量、 微乳粒径等为评价指标, 制备槲皮素亚微乳, 并对其粒径、 Zeta电位、 黏度等性质进行表征。 结果 槲皮素亚微乳为白色不透明乳状液体, 载药量 0.8 mg/mL, 平均粒径 (353.35 ±21.73) nm, Zeta电位 (38.46 ±4.13)mV, pH (5.56 ±0.13), 黏度 (2.84 ±0.16) MPa·s。结论 本实验所制得的槲皮素亚微乳理化性质较稳定, 工艺简单,可为槲皮素亚微乳制剂的制备提供研究依据。
槲皮素;亚微乳剂;理化性质
槲皮素 ( quercetin) 是 天然黄酮 类 物 质之一, 广泛存在于许多植物的花、叶、果实中,多以苷的形式存在,如芦丁 (芸香苷)、 槲皮苷、 金丝桃苷等, 经酸水解可得到槲皮素。研究表明,槲皮素具有抗病毒、抗炎、抗氧化、抗癌等药理作用,特别是对肿瘤具有预防和治疗作用。由于槲皮素不溶于水,脂溶性也差,制备理想药用制剂较困难,目前没有市售的商品。文献研究报道槲皮素口服给药剂型有纳米粒[1]、 固体脂质纳米粒[2], 但是槲皮素会被肠道中菌群代谢分解[3], 且油水分配系数小, 难以通过胃肠道黏膜吸收, 在小鼠体内口服生物利用度小于 17%[4], 在人体内甚至低于 1%[5], 有文献报道槲皮素自微乳系统[6],微乳制剂作为口服给药,改善了药物的吸收,但肝脏有较高的首过效应[3]。
本研究结合静脉给药载体-注射亚微乳诸多优点:如不仅能减少用药的不良反应,还能增大药物的溶解度、增强药物的靶向性及缓释效应等,采用高压均质法制备槲皮素亚微乳,并对其进行相关理化性质的研究,成功制得了静脉注射槲皮素亚微乳,既可改善和弥补槲皮素现有研发制剂的不足,又可为槲皮素静脉注射亚微乳新剂型的开发提供科研依据,具有重要的现实意义。
1 仪器与材料
槲皮素 (西安旭煌植物科技发展有限公司,批号XHQ070315); 槲皮素对照品 (中国药品生物制品检定所,批号 100081-200907 ) ; Solutol HS15, ELP ( 德 国 BASF公司) ; 注射用大豆油 ( 德国 lipoid 公司) ; 甘油 ( 紫光古汉氨基酸有限公司) ; 中 链 甘 油 三 酸 酯 MCT ( 德 国 lipoid 公司) ; 油酸 ( 德国 lipoid 公司) 、 二氯甲烷 ( 山东禹王试剂厂); 磷酸 (沈阳经济开发区试剂厂); 甲醇 (色谱纯,Fisher公司); 注射用水; 其他试剂均为分析纯。
AH100D 高 压 均 质 机 ( ATS Engineering Inc.); DF-101S 集热式恒温磁力搅拌器 (巩义市英峪予华仪器厂);5417R台 式 低 温 高 速 离 心 机 ( 艾 本 德 有 限 公 司 ) ; Aligent1200 高 效 液 相 仪 ( 安 捷 伦 公 司 ); Zetasizer Nano ZS(英国马尔文公司); YB-1A真空恒温干燥箱 ( 天津市金洲科学仪器有限公司); X-0.36 旋转式湿热灭菌柜 (张家港市神农药机有限公司)。
2 方法与结果
2.1 槲皮素定量测定
2.1.1 色 谱 条 件[6]Diamonsil ODS C18柱 ( 200 mm × 4.6mm, 5 μm) 流动相为甲醇-磷酸溶液 (60 ∶40, V/V)(磷酸溶液由 4 mL磷酸 +2 mL三乙胺 +1 L去离子水组成); 体积 流 量 1.0 m L/m in; 柱温 30 ℃; 检测波长 374 nm; 进样量 20 μL, 外标法定量测定。
2.1.2 标准曲线 精密称取槲皮素 5.56 mg, 置 50 mL量瓶中,用甲醇定容至刻度,制得槲皮素贮备液。分别精密量取槲 皮素的贮备液 0.25、 0.5、 0.75、 1、 1.5、 2、 4、8 mL于 10mL量瓶中, 用甲醇定容至刻度, 进样 20 μL测定对照品溶液峰面积。 以峰面积 (A) 和质量浓度 (C) 进行线性回归, 得到 y=35.124x+33.740, r=0.999 8, 表明槲皮素在 2.78 ~88.96 μg/mL范围内质量浓度与峰面积线性关系良好。
2.1.3 槲皮素的测定 精密量取槲皮素亚微乳剂 0.1 mL到10 mL量瓶中, 加入无水乙醇破乳并稀释至刻度, 混匀,0.45 μm微孔滤膜过滤。 取滤液 20 μL进样, 以外标法计算。 测得 3 批 样 品 含 有 量 分 别 为 标 示 量 的 97.86%,99.27%, 95.22%。
2.2 槲皮素亚微乳的制备
2.2.1 亚微乳的基本工艺 将乳化剂及其他添加剂分散于油相中 (大豆油、 MCT/LCT组成), 置磁力搅拌器加热至略高于60℃, 搅拌至全部溶解, 加槲皮素到油相中继续搅拌至药物完全溶解, 构成油相 (油相溶解过程保持 60 ℃恒温)。将处方量注射用甘油分散于适量注射用水中,置磁力搅拌器中, 加热至 60 ℃, 并搅拌至全部溶解, 构成水相。 在恒温 (60 ℃) 水浴高速搅拌下, 将油相滴加入水相中, 搅拌 6min, 制得初乳; 将初乳用注射用水稀释至处方量, 转移至高压均质机中, 以 700 bar压力均质循环 6 次,制得亚微乳调节 pH, 灌装充氮、 灭菌。 如图1 制得槲皮素亚微乳粒径分布图 (取乳剂 10 μL置 10 mL量瓶中, 用经0.22 μm滤膜滤过的蒸馏水稀释至刻度, 用动态光散射法,测定其平均粒径)。
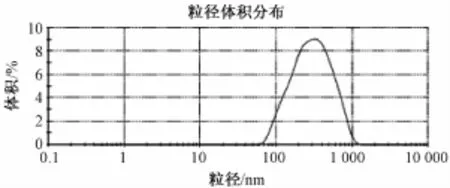
图1 槲皮素亚微乳粒径分布图
2.2.2 处方单因素考察 本实验以 0.08%槲皮素作为药物, 以 0.5%油酸 和 0.2%Vitamin E分别做为 稳定剂及抗氧化剂; 以 2.5%甘油做为等渗调节剂, 以 2%大豆油做为部分油相, 其余为注射用水, 制得规格为 0.8 mg/mL槲皮素亚微乳。 分别考察在一定的 pH下 (5 ~8); 一定比例MCT和 LCT做为油相; 一定比例 solutol HS 15 和 cremophor做为乳化剂,结合单因素试验优选该亚微乳的最佳制备条件。
2.2.2.1 油酸、 Vitam in E对亚微乳稳定性的 影 响 油 酸和Ve分别在乳剂中做为稳定剂及抗氧化剂对乳剂的稳定性均有一定影响, 因此, 本实验考察了油酸和 Vitamin E加和不加对本实验结果的相关影响, 以 2.5%甘油做为等渗调节剂, 在 pH 7 的环境中, 以 2%大豆油和一定比例 MCT/ LCT(2 ∶1) 做为油相; 一 定 比 例 solutol HS 15 和 cremophor(2 ∶1) 做为乳化剂, 依照参考文献经验值油酸选用0.5%、 Vitam in E 0.2%, 并按照 “ 2.2.1 ” 项 下操 作 制 备质量浓度为 0.8 mg/mL槲皮素亚微乳。 分别制备含 0.5%油酸、 Vitamin E与不含油酸、 Vitamin E的样品进行 40 ℃加速试验, 加速 2 个月后含有油酸、 Vitamin E的处方最稳定,所制的微乳没有分层﹑槲皮素量﹑微乳粒径和颜色几乎无变化; 而不含油酸和 Vitamin E的亚微 乳有分层现 象,并且颜色变黄。说明油酸对于亚微乳的稳定性起着重要作用。由于油酸属于油溶性成分,其加入有利于药物在油相中的溶解,并且处方在偏酸性条件下稳定,所以使用油酸作为稳定剂。 而 Vitamin E在本乳剂中可以防止空气对亚微乳的氧化作用, 结果见表1。
表1 油酸和 Ve对亚微乳稳定性的影响 (n=3,)

表1 油酸和 Ve对亚微乳稳定性的影响 (n=3,)
油 酸和Vitamin E 制 备样品 观察 放 置两个 月样 品观 察 (40 ℃ )外观性状 粒径 /nm 标示量 /% 外观性状 粒径/nm 标示量 /%未加 入油 酸和 Vitamin E 白色 不透明 乳状 液体 422.9 ±67.5 97.6 ±1.65 分 层, 颜色变 黄ND ND仅加油酸 白色不透明乳状液体 355.8 ±53.8 98.3 ±1.79 黄色不透明乳状液体 388.6 ±36.9 96.1 ±1.96加入 油酸 、 Vitamin E 白色 不透明 乳状 液体 345.9 ±46.3 98.9 ±1.33 白 色不 透明乳 状液 体350.4 ±32.6 98.5 ±1.69
2.2.2.2 pH对亚微乳的稳定性影响 将制备的亚微乳 [以0.08%槲皮素作为药 物, 以 0.5%油酸 和 0.2%Vitamin E分别做为稳定剂及抗氧化剂; 以 2.5%甘油做为等渗调节剂,以2%大豆油和一定比例 MCT/LCT(2 ∶1) 做为油相; 一定比例 solutol HS 15 和 cremophor(2 ∶1) 做 为 乳 化 剂] , 分别调 pH至 5.0、 6.0、 7.0、 8.0 进行终端灭菌, 考察其粒径和槲皮素量变化。 实验结果 (见表2) 表明, pH越低灭菌后药物含有量下降很少, 粒径几乎无变化; pH越高灭菌后药物含有量下降较大,亚微乳粒径变化较大。亚微乳中药物含有量和粒径的变化分别代表亚微乳的化学稳定性和物理稳定性指标, 由于药物在偏酸性条件下稳定, 所以将处方的 pH调至 5.0, 并在此 pH条件下改善处方的物理稳定性。
表 2 不同 pH对乳剂稳定性的影响 (n=3,)
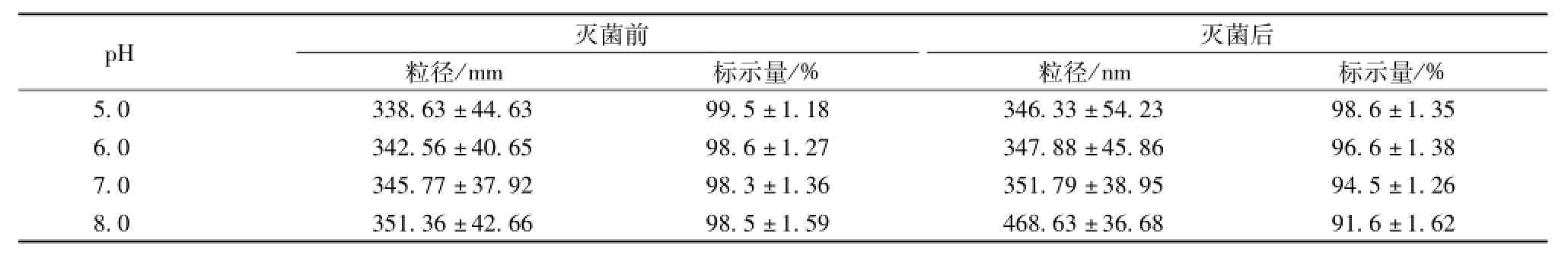
表 2 不同 pH对乳剂稳定性的影响 (n=3,)
pH灭菌后粒径/mm 标示量/% 粒径/nm 标示量/灭菌前% 5.0 338.63 ±44.63 99.5 ±1.18 346.33 ±54.23 98.6 ±1.35 6.0 342.56 ±40.65 98.6 ±1.27 347.88 ±45.86 96.6 ±1.38 7.0 345.77 ±37.92 98.3 ±1.36 351.79 ±38.95 94.5 ±1.26 8.0 351.36 ±42.66 98.5 ±1.59 468.63 ±36.68 91.6 ±1.62
2.2.2.3 MCT/LCT对大豆油性能的优化及对亚微乳稳定性的影响 大豆油在脂肪乳剂的制备中已使用了近四十年,长期使用大豆油所造成的免疫机能障碍、网状内皮系统(RES) 的蓄积和脂肪色素在肝和肺中的沉积等毒副作用必需引 起 重 视。 中 /长 链 脂 肪 乳 注 射 液 ( Lipofundin MCT/ LCT) 是一种常用的制备脂肪乳剂的油溶剂, 其优点主要有:提供一种更加稳定的,均一的制剂;和大豆油混合作为油相制得乳剂较单纯以大豆油为油相制得的乳剂毒性小,且能够减小大量亚油酸的存在而维持体内脂肪酸的平衡;降低混合油相的黏度,有利于提高亚微乳的稳定性,因此本实验设计 MCT与 LCT比例分别为 1 ∶2、 1 ∶1、 2 ∶1、3 ∶1、 4 ∶1, 以乳剂外观性状、 粒径大小、 槲皮素量为评价指标考察所制得的乳剂 (该微乳, 在 pH 5 的条件下, 除改变 MCT/LCT的比例外, 其余同 pH值考察条件下的组成) 优劣。 结果见表 3, 乳滴粒径随着 MCT量的增加而减小, 这可能是因为MCT量增加, 油相体系黏度降低, 减小了乳滴形成过程的阻力,有利于乳滴的减小,体系的稳定。因此选定 MCT∶LCT为 4 ∶1, 结果见表 3。
2.2.2.4 乳化剂对亚微乳稳定性的影响 制备静脉乳剂常用的乳化剂为磷脂, 按照 “2.2.1” 项下操作制备槲皮素亚微乳 (该微乳, 在 MCT/LCT的比例为 4 ∶1 的条件下, 除改变 solutol HS 15 和 cremophor的比例外, 其余同 MCT/LCT考察条件下的组成), 结果以磷脂为主要乳化剂均未能制得符合要求的产品。 因此本实验中选择 solutol HS15 为主要乳化剂, 并配以助乳化剂 cremophor ELP, 分别加入二者的质量分数比例为 (1 ∶1、 2 ∶1、 3 ∶1), 以乳剂外观性状、 粒径大小、 槲皮素量为评价指标, 然后观察 10 d, 实验结果表明,当二者比例为 3∶1时,亚微乳粒径比较稳定(330 nm)。 结果见表 4。
表 3 不同比例的 MCT与 LCT对槲皮 素亚微 乳稳定性的影响 (n=3,)
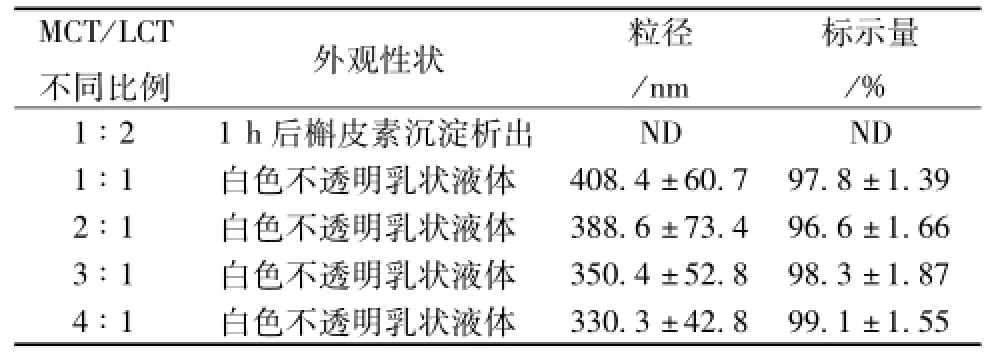
表 3 不同比例的 MCT与 LCT对槲皮 素亚微 乳稳定性的影响 (n=3,)
MCT/LCT不同比例 外观性状 粒径/nm标示量/% 1∶2 1 h后槲皮素沉淀析出330.3 ±42.8 99.1 ±1.55 ND ND 1 ∶1 白色不透明乳状液体 408.4 ±60.7 97.8 ±1.39 2 ∶1 白色不透明乳状液体 388.6 ±73.4 96.6 ±1.66 3 ∶1 白色不透明乳状液体 350.4 ±52.8 98.3 ±1.87 4∶1 白色不透明乳状液体
表 4 不同比例乳化剂对槲皮素亚微乳稳定性的影响 (n=3,)
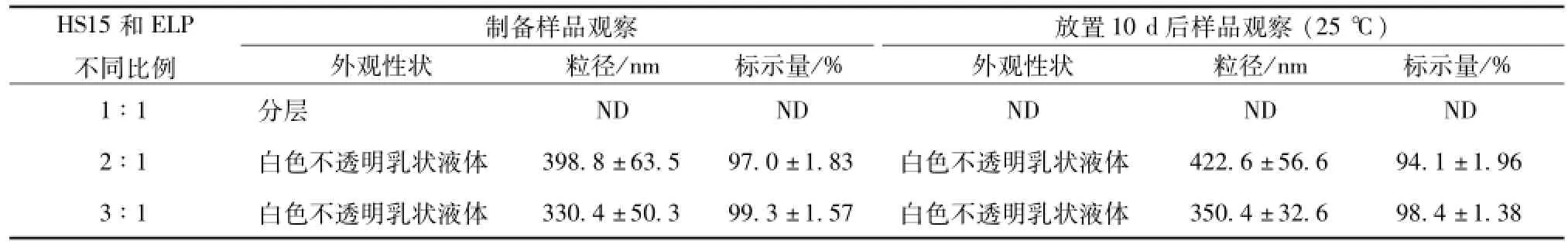
表 4 不同比例乳化剂对槲皮素亚微乳稳定性的影响 (n=3,)
HS15 和 ELP不同比例制 备样 品观察 放置 10 d 后样品 观察 (25 ℃)外观性状 粒径/nm 标示量/% 外观性状 粒径 /nm 标示量/% 1∶1 分层ND ND ND ND ND 2 ∶1 白色不透明乳状液体 398.8 ±63.5 97.0 ±1.83 白色不透明乳状液体 422.6 ±56.6 94.1 ±1.96 3 ∶1 白色不透明乳状液体 330.4 ±50.3 99.3 ±1.57 白色不透明乳状液体350.4 ±32.6 98.4 ±1.38
2.2.2.5 其他附加剂对亚微乳的稳定性影响 由于本制剂为静脉注射用乳剂,故需要有调节等渗的溶剂,本实验依照参考文献经验值, 选用 2.5%的甘油为等渗调节剂, 按照“2.2.1” 项下操作制备质量浓度为 0.8 mg/mL槲皮素亚微乳 (以 0.08%槲皮素作为药物, 在 pH 5 的条件下, 以0.5%油酸 和 0.2%Vitamin E分别做为稳定剂及抗氧化剂;以 2%大豆油和一定比例 MCT/LCT(4 ∶1) 做为油相; 一定比例 solutol HS15 和 cremophor(3 ∶1) 做为乳化剂)。 并对该样品进行40℃加速试验, 2个月后, 该亚微乳粒径变化几乎没有影响,而且成分含有量也比较稳定,并依据《中国药典》 2010 年版附录项下渗透压的测定方法, 采用实际测定值表示,氯化钠注射液的实际测得值为286 mOsmol/kg。 槲皮素静脉注射亚微 乳的渗 透压平均为286.3 mOsmol/kg, 接近等渗溶液, 符合静脉注射渗透压相关要求,因此,本实验最终所用的等渗调节剂甘油用量为 2.5%。
2.2.2.6 最终确定亚微乳规格与处方 根据实验结果, 确定本制剂的规格为 10 mL/8 mg。 基本处方质量分数为槲皮素 0.08%, 大豆油 2%, MCT 8%, LCT 2%, solutol HS 15 2.4%, cremophor ELP 0.8%, 油 酸 0.5%, 甘 油 2.5%,Vitamin E 0.2%, 其余为注射用水。
2.3 槲皮素的理化性质研究
2.3.1 槲皮素亚微乳的外观 颜色、 粒径、 Zeta电位、 黏度、 pH 分别取3 批自制槲皮素亚微乳稀释适当倍数, 用马尔文粒径测定仪测定其粒径以及电位,黏度测定仪测定其黏度, pH计测定 pH, 结果见表 5。
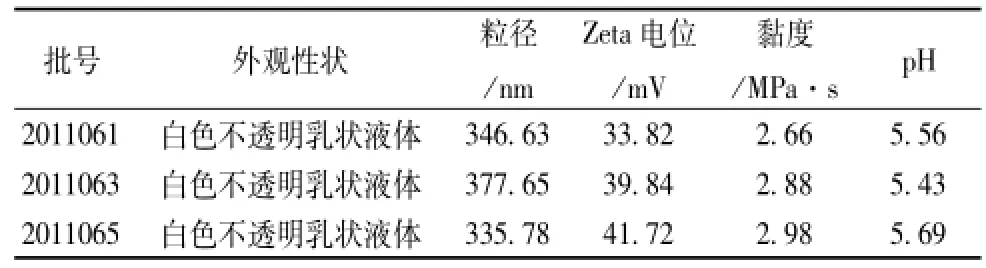
表5 3 批样品外观颜色、 粒径、 电位、 黏度、 pH测定(n=3)
结果表明所制备的槲皮素亚微乳粒径较小,分布狭窄,平均 粒 径 为 (353.35 ±21.73) nm。 电 位 绝 对 值 大 于30mV, 处于乳剂稳定范围内。
2.3.2 灭菌稳定性试验 槲皮素亚微乳剂给药途径为静脉注射,所以必须保障无菌,在大生产过程中一般采用终端灭菌工艺,所以亚微乳应当进行终端灭菌条件的稳定性考察。本实验采用能够保证灭菌完全的流通蒸汽灭菌法115 ℃、 45 min, 灭菌后迅速冷却, 测定灭菌前后制剂粒径与药物含有量,比较灭菌前后制剂的变化,并密切观察灭菌组制剂室温放置6个月的变化情况, 结果见表6。
3 讨论
本实验研究的槲皮素目前没有市售制剂。参考已经审批专利: 槲皮素长效脂质体粉针剂及其制备方法 (ZL 200510022235.1) 和槲皮素固体脂质纳米粒制剂及其制备方法 (ZL 200610044416.9) 中药物含有量, 并结合槲皮素在油相和水相中的溶解性能,以及本课题组在初期预实验的基础上,初步将槲皮素亚微乳注射液的规格定为0.8 mg/mL。
另外,质量合格的注射乳剂不仅应该粒度均匀、稳定,符合注射剂的各项规定,还必须能耐受高压灭菌,因此,灭菌稳定性是亚微乳制剂稳定性和机体应用安全性的基础。据报道,灭菌过程是重新乳化的过程,水相和油相被有序排列的乳化剂进行不可逆转的分隔,制剂更加稳定。本实验采用能够保证灭菌完全的流通蒸汽灭菌法 115 ℃、 45 min对3批样品进行了灭菌前后及室温放置6个月的稳定性考察,其实验结果良好。
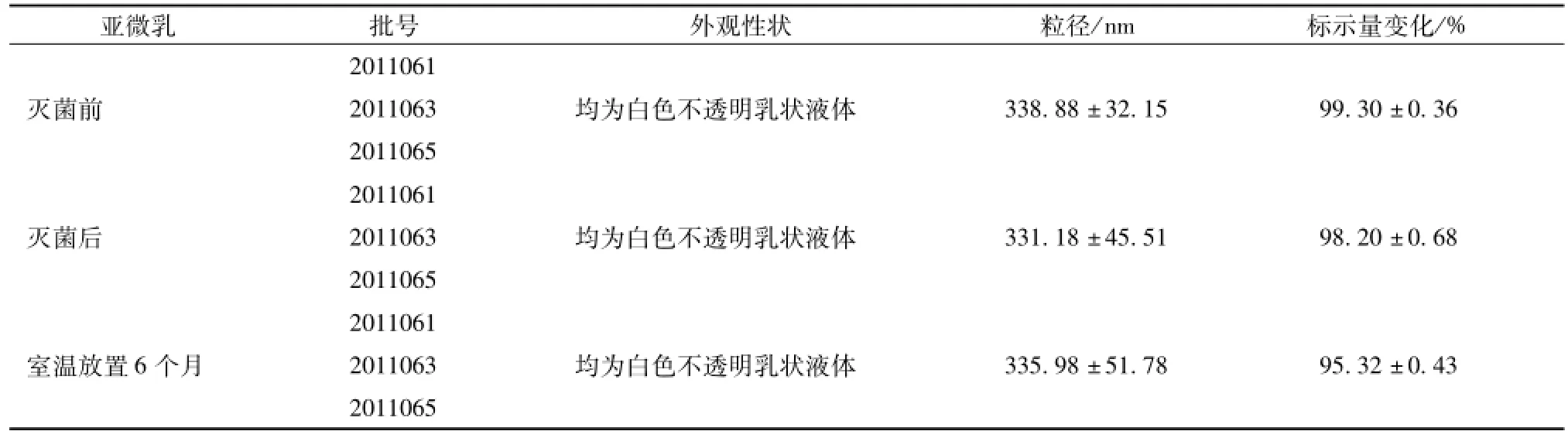
表 6 3 批样品在灭菌前后及室温外放置 6 个月颜色、 粒径、 成分含有量变化 (n=3)
最后,本实验主要以微乳的外观性状﹑槲皮素量﹑微乳粒径等为评价指标,优选槲皮素注射亚微乳的最佳制备条件, 在本实验中药物及粒径在偏酸性条件下稳定, pH低则灭菌后药物含有量变化小, 粒径变化小; 而 pH高灭菌后药物含有量变化大,粒径变化也比较大。分析原因可能是由于槲皮素为黄酮类化合物在酸性条件下比较稳定,而在碱性条件下不稳定所致。考虑到药物含有量的问题,故本实验最终在酸性条件下制得亚微乳。工业生产中乳剂产品研发的关键在于它的长期稳定性,部分处方短期性质稳定,放置一段时间后出现含有量下降,粒径增大等现象。所以处方工艺的筛选还应结合稳定性实验进行。总之,本实验所采用的方法制得槲皮素亚微乳其质量可控,稳定性良好,为槲皮素亚微乳注射液下一步的研究,提供了良好的科研基础。
[ 1 ] Wu TH, Yen F L, Lin L T, etal.Preparation, physicochemical characterization, and antioxidant effects of quercetin nanoparticles[J] .Int JPharm, 2008, 346(1/2) : 160-168.
[ 2 ] Li Houli, Zhao Xiaobin, Ma Yukun, et al.Enhancement of gastrointestinal absorption of quercetin by solid lipid nanoparticles[ J] .JControl Release, 2009, 133(3) : 238-244.
[ 3 ] 王玉强.槲皮素微乳的研究 [D].济南: 山东大学, 2006.
[ 4 ] Khaled K A, El-Sayed Y M., Al-Hadiya B M.Disposition of the flavonoid quercetin in rats after single intravenous and oral doses[ J] .Drug Dev Ind.Pharm, 2003, 29(4): 397-403.
[ 5 ] Gugler R, Leschik M., Dengler H.J.Disposition of quercetin in man after single oral and intravenous doses[ J].Eu J Clin Pharmacol, 1975, 9(2/3) : 229-234.
[6] 胡 英,陈海靓,梁文权.槲皮素自乳化释药系统的制备和质量评价[J].中国中药杂志, 2007, 32(9): 805-807.
[ 7 ] 李剑惠, 胡 英.HPLC测定槲皮素自微乳中槲皮素的含量[J].华西药学杂志, 2006, 21(5): 489-491.
R944
: B
: 1001-1528(2014)05-1077-04
10.3969/j.issn.1001-1528.2014.05.046
2013-06-14
刘 芸 (1966—) 女, 主 管 药 师, 研 究 方 向: 天 然 药 物 分 离 纯 化 及 制 剂 工 艺。 Tel: 13809142465 , E-mail: haopeng65@ sina.com

