饥饿和冬眠期牛蛙胃肠胰系统内分泌细胞的变化
陈 慧 郭 慧 方 翔 彭 莉 韩敏捷 张盛周
(安徽师范大学生命科学学院, 芜湖 241000)
饥饿和冬眠期牛蛙胃肠胰系统内分泌细胞的变化
陈 慧 郭 慧 方 翔 彭 莉 韩敏捷 张盛周
(安徽师范大学生命科学学院, 芜湖 241000)
所有散在分布于消化道黏膜和胰腺分泌肽类或胺类激素的内分泌细胞统称为胃肠胰(Gastro-Entero-Pancreatic, GEP)系统内分泌细胞, 其与神经系统和外分泌腺互相配合, 共同调控和调节消化、吸收及体内一些其他生理过程[1—6]。目前, 对脊椎动物GEP内分泌系统已进行广泛而深入的研究, 发现了30多种类型的内分泌细胞[1]。应用免疫组织化学方法对两栖动物GEP内分泌细胞进行研究, 也有不少报道, 共检测到10多种内分泌细胞[7—9]。研究表明[9—11], 动物 GEP内分泌细胞的种类和分布型可能是长期进化过程中对特殊食性适应的结果, 同时受食物成分、环境条件和病理变化等多种因素的影响。
大多数两栖动物间歇性捕食, 饱食后具长期耐饥饿的习性, 冬季气温下降后进入冬眠。饥饿和冬眠期动物停止摄食, 胃肠道生理活动明显减弱[12—16]。动物摄食和胃肠道功能受 GEP内分泌细胞的精细调节, 然而有关饥饿和冬眠期GEP内分泌细胞变化方面的研究报道尚少[9,17—19]。饥饿与冬眠期GEP内分泌细胞变化的比较尚未见报道。
牛蛙(Rana catesbeiana)隶属两栖纲无尾目, 是一种大型蛙, 营养价值较高, 具有重要经济价值。我们曾在牛蛙 GEP系统检测出 5-羟色胺(5-HT)、生长抑素(SS)、胃泌素(GAS)、胰高血糖素(GLU)和胰多肽(PP)等 5种免疫阳性细胞[8], 本文对饥饿和冬眠期该5种内分泌细胞的分布密度和形态变化进行了比较研究, 旨在增进对两栖动物饥饿和冬眠期消化生理调节机制的认识, 为全面认识其消化机能积累资料, 同时丰富胃肠胰系统内分泌学知识。
1 材料与方法
1.1 实验材料
成体牛蛙取自芜湖市南陵县仙坊镇牛蛙养殖场。6月份取活动期饱食牛蛙12只, 实验室适应性饲养15d, 随机选取6只穿刺毁髓, 迅速解剖, 确认胃中有食物后, 按下列部位取材: 食管、胃贲门部、胃体、胃幽门部、十二指肠、空肠、回肠、直肠和胰腺。另6只放入长宽高分别为100、50和50 cm玻璃饲养箱中, 用纱布覆盖容器上口, 饥饿 15d, 穿刺毁髓, 解剖, 确认胃中无食物后按上述部位取材。12月份取冬眠期牛蛙 6只, 实验室继续冬眠 15d,穿刺毁髓, 解剖, 按上述部位取材。实验材料用无冰醋酸的Bouin’s液固定24—48h, 常规脱水透明, 石蜡包埋, 切片6—7 μm, 贴片, 烘干用于免疫组织化学染色。
1.2 主要试剂
5种胃肠激素的兔抗血清详见表1, 卵白素–生物素–过氧化物酶复合物(Avidin-biotin-peroxidase complex, ABC)购自武汉博士德生物工程有限公司。
1.3 免疫组织化学方法
常规石蜡切片脱蜡至水, 3% H2O2甲醇溶液孵育10min, 消除内源性过氧化物酶活性。蒸馏水浸洗, PBS浸泡5min, 滴加正常山羊血清(1∶10)室温孵育10min, 封闭非特异性反应部位。倾去血清, 滴加一抗, 4℃过夜。PBS浸洗 3次×5min, 滴加即用型生物素标记的二抗(羊抗兔IgG抗血清), 室温孵育2h。PBS浸洗3次×5min, 滴加即用型卵白素–生物素–过氧化物酶, 室温孵育 2h。PBS浸洗 3次×5min。DAB-H2O2显色, 苏木精复染, 自来水洗净。脱水、透明、封片。阴性对照分别用正常羊血清和PBS代替一抗, 其余步骤同上。
1.4 拍照, 计数和统计分析
在莱卡DM2500型显微镜下观察, 拍照, 并对每个部位的切片随机取10个400倍视野计数, 取平均值(X±SD),表示内分泌细胞的分布密度, 并用单因素方差分析(One-way ANOVA)对内分泌细胞的密度变化情况进行统计学处理。当P<0.05时差异显著, 具有统计学意义。
2 结果
在光镜下, 经染色的切片背景呈淡蓝色, 免疫反应阳性细胞呈深棕色, 核淡蓝色或被遮住。阴性对照切片呈淡蓝色, 未见免疫反应阳性细胞。5-HT、SS、GAS、GLU和PP等5种胃肠激素免疫阳性(IR)细胞在牛蛙胃肠胰系统各部位的分布密度及其在饥饿和冬眠期的变化见表2。
2.1 饥饿和冬眠期消化道内分泌细胞的变化
5-HT-IR 细胞 5-HT-IR细胞在牛蛙消化道各段均有分布, 以空肠密度最高。在饥饿后, 食管未检出, 胃体、幽门、空肠、回肠和直肠细胞密度显著下降(P<0.05), 其余各段亦均下降, 但不显著(P>0.05)。在冬眠期, 食管亦未检出, 胃体、幽门和十二指肠细胞密度显著下降(P<0.05), 与饥饿期无显著差异(P>0.05), 空肠变化不显著(P>0.05), 而回肠和直肠细胞密度则显著增加(P<0.05)。食管 5-HT-IR细胞主要分布在上皮细胞中层, 多为圆形,少数为梭形; 胃5-HT-IR细胞主要分布于胃腺部, 胃上皮中偶见, 呈圆形、椭圆形或楔形。肠道5-HT-IR细胞主要位于上皮细胞之间, 有圆形、楔形和长颈瓶形。其中十二指肠和空肠 5-HT-IR细胞有较长胞突伸向肠腔或邻近细胞(图版Ⅰ-1)。在饥饿期, 贲门、胃体、幽门、十二指肠和空肠的长梭形或锥形细胞明显减少, 细胞的胞突明显缩短或消失(图版Ⅰ-2), 冬眠期肠道仍有部分细胞具有较长胞突(图版Ⅰ-3)。
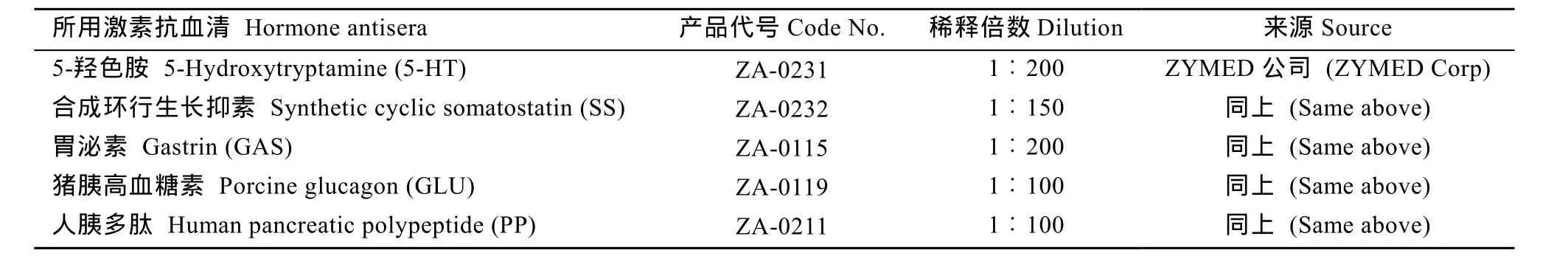
表1 胃肠激素抗血清一览表Tab. 1 Details of the gut hormone antisera
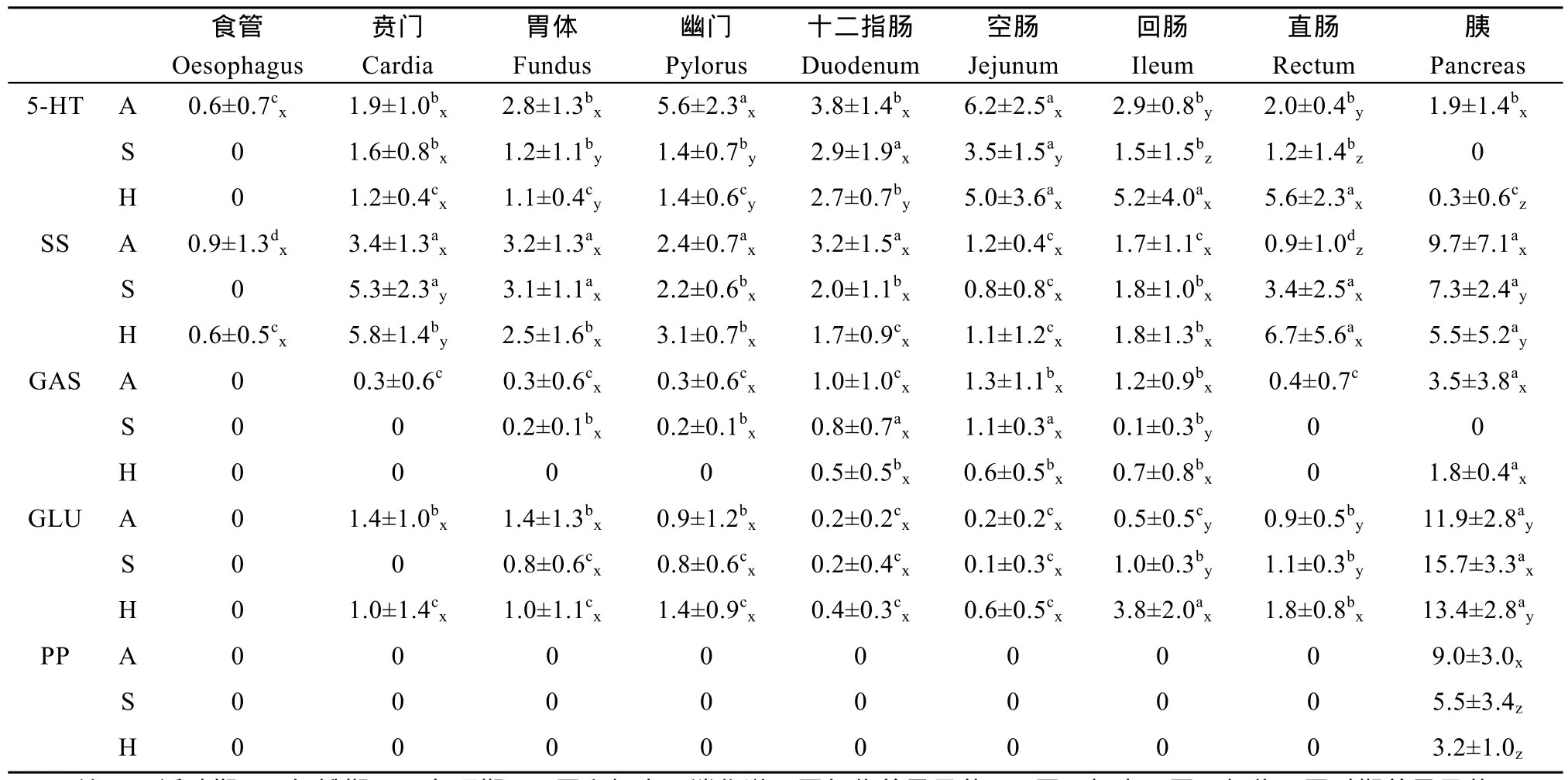
表2 饥饿和冬眠期牛蛙胃肠胰系统内分泌细胞的密度变化Tab. 2 Density changes of endocrine cells in the GEP system of Rana catesbeiana during starvation and hibernation (cells/400×field, mean±SD)
SS-IR 细胞 SS-IR细胞在牛蛙消化道各段均有分布, 以胃和十二指肠细胞密度较高。在饥饿后, 食管未检出, 贲门和直肠细胞密度显著增加(P<0.05), 其余部位均无显著变化(P>0.05)。在冬眠期, 贲门和直肠细胞密度亦显著增加(P<0.05), 其余部位均无显著变化(P>0.05)。饥饿与冬眠期消化道各部位细胞密度均无显著差异(P>0.05)。胃 S S-IR细胞主要位于胃腺部, 呈圆形或椭圆形, 饥饿和冬眠期细胞形态无明显变化。肠道SS-IR细胞主要位于肠上皮细胞之间, 多呈椭圆形和梭形(图版Ⅰ-4、5)。在饥饿和冬眠期, 细胞的局部分布无明显变化, 但冬眠期十二指肠处SS-IR细胞有明显的胞突(图版Ⅰ-6)。
GAS-IR 细胞 GAS-IR 细胞在牛蛙除食管外的消化道各段均有分布, 以空肠密度最高。在饥饿后, 食管、贲门和直肠未检出, 十二指肠和空肠GAS-IR细胞密度无显著变化(P>0.05), 回肠显著下降(P<0.05)。在冬眠期,食管、胃和直肠未检出, 其余各部GAS-IR 细胞密度均无显著变化(P>0.05)。冬眠期回肠细胞密度显著高于饥饿期(P<0.05)。胃GAS-IR 细胞主要位于黏膜上皮基部和胃腺部, 呈圆形或椭圆形。十二指肠GAS-IR细胞主要位于黏膜上皮中, 呈椭圆形和锥形(图版Ⅰ-7)。饥饿和冬眠期GAS-IR细胞的局部分布均无明显变化, 但细胞明显变小,阳性反应明显减弱(图版Ⅰ-8、9)。
GLU-IR 细胞 GLU-IR细胞在除食管外的消化道各段均有分布, 以贲门和胃体密度较高。在饥饿后, 贲门未检出, 消化道其余各段细胞密度均无显著变化(P>0.05)。在冬眠期, 回肠和直肠细胞密度显著增加(P<0.05), 其余部位无显著变化(P>0.05)。冬眠期回肠和直肠细胞密度显著高于饥饿期(P<0.05)。胃GLU-IR细胞位于腺上皮, 呈圆形和椭圆形。肠道GLU-IR细胞主要位于肠黏膜上皮, 多呈圆形和椭圆形。在饥饿和冬眠期, GLU-IR细胞的局部分布和形态无明显变化。
PP-IR 细胞 PP-IR细胞在活动期、饥饿和冬眠期牛蛙消化道各段均未检出。
2.2 饥饿和冬眠期胰腺内分泌细胞的变化
5-HT、SS、GAS、GLU和PP-IR等5种内分泌细胞在牛蛙胰腺中均有分布。5-HT和GAS-IR细胞密度较低,散在分布于腺泡外围, 多数细胞呈圆形、椭圆形或形态不规则。在饥饿后, 两者均未被检出, 在冬眠期, 5-HT-IR细胞密度显著下降(P<0.01), GAS-IR细胞密度亦下降, 但差异不显著(P>0.05)。SS、GLU和PP-IR细胞在胰腺密度较高, 多数成簇状分布于胰岛中, 少数细胞散在分布, 细胞多呈圆形、椭圆形或形态不规则(图版Ⅰ-10—18)。在饥饿后, SS和PP-IR细胞密度显著下降(P<0.05), GLU-IR细胞密度显著增加(P<0.05), 在冬眠期, SS和PP-IR细胞密度亦显著下降(P<0.05), 与饥饿期差异不显著(P>0.05), GLU-IR细胞亦增加, 但差异不显著(P>0.05)。在饥饿和冬眠期, 胰腺内分泌细胞的形态变化不明显。
3 讨论
5-HT、SS、GAS、GLU和PP-IR细胞等属脊椎动物GEP系统 5种重要内分泌细胞, 我们曾对其在牛蛙 GEP系统中的存在与分布作了鉴定和定位[8], 本研究发现在饥饿和冬眠期这些内分泌细胞的分布密度和形态发生了明显变化。
3.1 饥饿和冬眠期消化道内分泌细胞的变化
5-HT-IR细胞广泛分布于各类脊椎动物消化道。杨贵波等[10]研究表明改变食物成分可影响胃肠道 5-HT-IR细胞的分布型, Lambrecht, et al.[20]通过生化检测显示禁食后大鼠胃黏膜中组胺含量显著降低, Pan, et al.[9]研究显示禁食后黑斑蛙(Rana nigromaculata)消化道多个部位5-HT-IR细胞密度显著下降。本研究显示, 饥饿后牛蛙消化道各段5-HT-IR细胞密度均下降, 细胞胞突缩短或消失,细胞分泌活动减弱, 与已有的生物化学与细胞学研究报道结果相一致。5-HT能刺激胃肠黏液的分泌, 平滑肌收缩和血管扩张, 促进胃肠道的运动[21]。饥饿后动物停止摄食, 胃肠道运动减慢, 黏液分泌减少[12—14]。可见, 饥饿后消化道 5-HT-IR细胞密度降低和分泌活动减弱与消化生理状态的改变是相适应的。冬眠期动物亦停止进食, 体温降低, 代谢受抑制, 胃肠道活动亦明显减缓[15,16]。本研究显示冬眠期消化道前段包括胃体、幽门和十二指肠5-HT-IR细胞密度显著下降, 但消化道后段的回肠和直肠5-HT-IR细胞密度显著增加, 与饥饿期的变化不完全一致。苏泽红等[17]报道冬眠期中华鳖(Trionyx sinensis)胃肠道各段5-HT细胞密度均下降, Rossol'ko, et al.[18]研究发现冬眠期林蛙(Rana temporaria)胃黏膜内分泌细胞数量显著减少, 但分泌 5-HT的嗜铬细胞数量无明显变化, 李淑兰等[19]研究显示冬眠期黑龙江林蛙(Rana amurensis)食道、贲门和幽门5-HT-IR细胞显著减少, 空肠和直肠显著增多。我们认为冬眠期消化道后段5-HT-IR细胞密度增加可能与冬眠期的生理状态与饥饿不同有关, 消化道后段5-HT-IR细胞可调节水分的吸收和排遗[11], 冬眠期动物产生的代谢产物会聚集在肠道后段, 我们解剖时也发现冬眠期牛蛙肠道后段尚存少量粪便类物质, 5-HT-IR细胞密度增加利于冬眠期保水和排遗。
SS和 GAS-IR细胞普遍存在于各类两栖动物消化道中[7—9]。Wu, et al.[22]检测到饥饿后大鼠胃窦中SS mRNA表达显著增加, Kido, et al.[23]研究显示禁食后结肠SS表达明显增强, 回肠则变化不显著。本研究显示, 饥饿和冬眠期牛蛙贲门和直肠SS-IR细胞均显著增多, 胃肠道其余部位无显著变化。Wu, et al.[22]检测到饥饿后大鼠胃窦中GAS mRNA表达显著减少, Ichikawa, et al.[24]研究发现饥饿导致血清和胃窦GAS含量显著减少, 苏泽红等[17]报道冬眠期中华鳖胃肠道GAS细胞的分布范围和细胞数量较活动期变化不显著。本研究显示, 饥饿和冬眠期牛蛙胃中GAS-IR细胞减少或无, 直肠中亦无分布, 空肠和回肠细胞密度无显著变化, 但细胞明显变小, 阳性反应明显减弱。SS具有普遍的抑制作用, 可抑制胃肠激素分泌及胃肠蠕动[2,3], GAS的主要生理作用是刺激胃酸、胃蛋白酶原分泌, 胃窦收缩, 增加胃黏膜血流量[3]。饥饿和冬眠期动物停止摄食, 胃肠道运动减慢和黏液分泌减少, 我们在实验中测得饥饿和冬眠期牛蛙胃液pH明显升高, 活动期、饥饿和冬眠期胃pH范围分别为2.0—4.0、5.0—6.0、5.5—6.5。可见, 牛蛙饥饿和冬眠期胃肠道SS和GAS-IR细胞的变化与消化生理变化相适应。
GLU和 PP-IR细胞在两栖类的消化道中的存在与分布型存在较大种间差异[7—9]。我们前期在牛蛙胃肠道各段均检测到少量GLU-IR细胞, 未检出PP-IR细胞[8]。GLU对胃肠道的生理作用尚不明确。本研究显示饥饿后胃肠道各段 GLU-IR 细胞均无显著变化, 冬眠期除回肠和直肠细胞密度显著增加外, 其余各段亦均无显著变化。本研究在饥饿和冬眠期牛蛙消化道各段均未检出PP-IR细胞。
3.2 胰腺内分泌细胞的变化
5-HT和 GAS-IR细胞在两栖类胰腺中的研究报道较少。我们前期在牛蛙胰腺中检测出5-HT和GAS-IR细胞[8]。本研究显示饥饿和冬眠期该两种细胞密度显著下降。5-HT和GAS 在胰腺中的生理作用有待进一步研究。
SS、GLU和PP-IR细胞是胰腺3种重要内分泌细胞,牛蛙胰腺SS、GLU和PP-IR细胞分布密度显著高于消化道。饥饿和冬眠期SS和PP-IR细胞密度均显著下降, 饥饿期GLU-IR细胞密度显著增加, 冬眠期GLU-IR细胞密度亦增加但不显著。Bauman, et al.[25]生化检测显示冬眠期金背地松鼠(Citellus lateralis)胰腺SS和PP含量明显下降, 而GLU含量无显著变化。本研究结果与其基本一致。SS可抑制GLU的分泌, 对GLU的分泌起平衡调节作用[4], PP可抑制胰酶的分泌和胆囊的收缩[5], 而GLU在营养物质供应不足或机体代谢需要增加时释放, 以动员肝脏释放葡萄糖以及供应自由脂肪酸和酮体等替代性能源物质[6]。可见, 饥饿和冬眠期SS、GLU和PP-IR细胞的密度变化利于机体维持正常的生理活动。
总之, 饥饿和冬眠期 GEP内分泌细胞的密度和形态变化与消化生理及个体生命活动变化是相适应的。冬眠期GEP内分泌细胞的变化与饥饿期相似, 亦存在差异,反映出冬眠期与饥饿后的生理变化既有相似性又存在差异。
[1] Nelson L E, Sheridan M A. Gastroenteropancreatic hormones and metabolism in fish [J]. General and Comparative Endocrinology, 2006, 148(2): 116—124
[2] Piqueras L, Martínez V. Role of somatostatin receptors on gastric acid secretion in wild-type and somatostatin receptor type 2 knockout mice [J]. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2004, 370(6): 510—520
[3] Friis-Hansen L. Lessons from the gastrin knockout mice [J]. Regulatory Peptides, 2007, 139(123): 5—22
[4] Strowski M Z, Parmar R M, Blake A D, et al. Somatostatin inhibits insulin and glucagon secretion via two receptor subtypes: an in vitro study of pancreatic islets from somatostatin receptor-knockout mice [J]. Endocrinology, 2000, 141(1): 111—117
[5] Schmidt P T, Naslund E, Gryback P, et al. A role for pancreatic polypeptide in the regulation of gastric emptying and short-term metabolic control [J]. The Journal of Clinical Endocrinology & Metabolism, 2005, 90(9): 5241—5246
[6] Jiang G Q, Zhang B B. Glucagon and regulation of glucose metabolism [J]. American Journal of Physiology - Endocrinology and Metabolism, 2003, 284(4): E671–E678
[7] Huang X G, Wu X B. Immunohistochemical location of endocrine cells in the gastrointestinal tract of MT.WUYI Cascade-frog [J]. Acta Hydrobiologica Sinica, 2007, 31(2): 162—168 [黄徐根, 吴孝兵. 武夷湍蛙胃肠道内分泌细胞的免疫组织化学定位. 水生生物学报, 2007, 31(2): 162—168]
[8] Zhang S Z, Xue L H, Tao S W. Immunohistochemical identification and localization of endocrine cells in the gastroentero-pancreatic system of bullfrog Rana catesbeiana [J]. Acta Laser Biology Sinica, 2008, 17(5): 689—694 [张盛周,薛立辉, 陶少武. 牛蛙胃肠胰系统内分泌细胞的免疫组织化学鉴定与定位. 激光生物学报, 2008, 17(5): 689—694]
[9] Pan H Z, Chen H H, Zhu L J, et al. Adaptive changes of the frog gastro-entero- pancreatic system endocrine cells after fasting [J]. Current Zoology, 2009, 55(4): 301—308
[10] Yang G B, Wang P. Effects of food composition on enterochromaffin cells in the gut mucosa of rat [J]. Acta Zoological Sinica, 1997, 43(1): 55—60 [杨贵波, 王平. 改变食物组成对大鼠胃肠道嗜铬细胞的影响. 动物学报, 1997, 43(1): 55—60]
[11] Zhang S Z, Wang Y, Sun S. Localization of 5-Hydroxytryptamine immunoreactive cells in the digestive tract of Manis pentadactyla [J]. Chinese Journal of Histochemistry and Cytochemistry, 2008, 17(2): 200—203 [张盛周, 王洋, 孙晟. 中国穿山甲消化道5-羟色胺免疫活性细胞的定位. 中国组织化学与细胞化学杂志, 2008, 17(2): 200—203]
[12] Naya D E, Farfan G, Sabat P, et al. Digestive morphology and enzyme activity in the Andean toad Bufo spinulosus: hard-wired or flexible physiology [J]? Comparative Bio-chemistry and Physiology, Part A , 2005, 140(2): 165—170
[13] Song Z B, He X F. Effects of starvation on morphology and histology of digestive system in larval and juvenile Silurus meridionalis Chen [J]. Acta Hydrobiological Sinica, 2000, 24(2): 155—160 [宋昭彬, 何学福. 饥饿对南方鲇仔稚鱼消化系统的形态和组织学影响. 水生生物学报, 2000, 24(2): 155—160]
[14] Overgaard J, Andersen J B, Wang T. The effects of fasting duration on the metabolic response to feeding in Python molurus: An evaluation of the energetic costs associated with gastrointestinal growth and upregulation[J]. Physiological and Biochemical Zoology, 2002, 75(4): 360—368
[15] Andrews M T. Advances in molecular biology of hibernation in mammals [J]. Bioessays, 2005, 29(5): 431—440
[16] Carey H V, Andrews M T, Martin S L. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature [J]. Physiological Reviews, 2003 , 83(4): 1153—1181
[17] Su Z H, Chen X W, Liu J X, et al. Immunocytochemical study on 5-HT and gastrin endocrine cells gastrointestinal tract of soft-shelled turtle, Trionyx sinensis [J]. Journal of Nanjing Agricultural University, 2006, 29(1) : 89—93 [苏泽红, 陈晓武, 柳金雄, 等. 中华鳖胃肠道 5-羟色胺和胃泌素内分泌细胞的免疫细胞化学研究. 南京农业大学学报, 2006, 29(1): 89—93]
[18] Rossol'ko G N, Ivanova V F. Seasonal changes in the endocrine cells of the gastric epithelium of Rana temporaria [J]. Arkhiv Anatomii Gistologii Embriologii, 1987, 92(2): 55—61
[19] Li S L, Liu C, Lu X H, et al. Comparative research of endocrine cells in the digestive tract of Rana amurensis during hibernation and non-hibernating period [J]. Chinese Journal of Histochemistry and Cytochemistry, 2010, 19(3): 245—251 [李淑兰, 刘超, 吕晓慧, 等. 黑龙江林蛙冬眠和非冬眠消化道内分泌细胞的比较研究. 中国组织化学与细胞化学杂志, 2010, 19(3): 245—251]
[20] Lambrecht N W, Yakubov I, Sachs G. Fasting-induced changes in ECL cell gene expression [J]. Physiological Genomics, 2007, 31(2): 183—192
[21] Wang S H, Dong L, Luo J Y, et al. Decreased expression of serotonin in the jejunum and increased numbers of mast cells in the terminal ileum in patients with irritable bowel syndrome [J]. World Journal of Gastroenterology, 2007, 13(45): 6041—6047
[22] Wu V, Sumii K, Tari A, et al. Regulation of rat antral gastrin and somatostatin gene expression during starvation and after refeeding [J]. Gastroenterology, 1991, 101(6): 1552—1558
[23] Kido T, Sumii K, Kawano M, et al. Food deprivation enhances somatostatin and somatostatin receptor subtype expression in rat colon [J]. Regulatory Peptides, 2003, 114(2-3): 167—173
[24] Ichikawa T, Ishihara K, Nozue K, et al. Serum and antral gastrin levels in fed and fasted rats: relation to aging [J]. Comparative Biochemistry and Physiology, 1998, 121(3): 223—228
[25] Bauman W A, Meryn S, Florant G L. Pancreatic hormones in the nonhibernating and hibernating golden mantled ground squirrel [J]. Comparative Biochemistry and Physiology A: Comparative Physiology, 1987, 86(2): 241—244
CHANGES OF ENDOCRINE CELLS IN THE GASTRO-ENTERO-PANCREATIC SYSTEM OF RANA CATESBEIANA DURING STARVATION AND HIBERNATION
CHEN Hui, GUO Hui, FANG Xiang, PENG Li, HAN Min-Jie and ZHANG Sheng-Zhou
(College of Life Science, Anhui Normal University, Wuhu 241000, China)
牛蛙; 饥饿; 冬眠; 胃肠胰; 内分泌细胞
Rana catesbeiana; Stravation; Hibernation; Gastro-Entero-Pancreatic; Endocrine cell
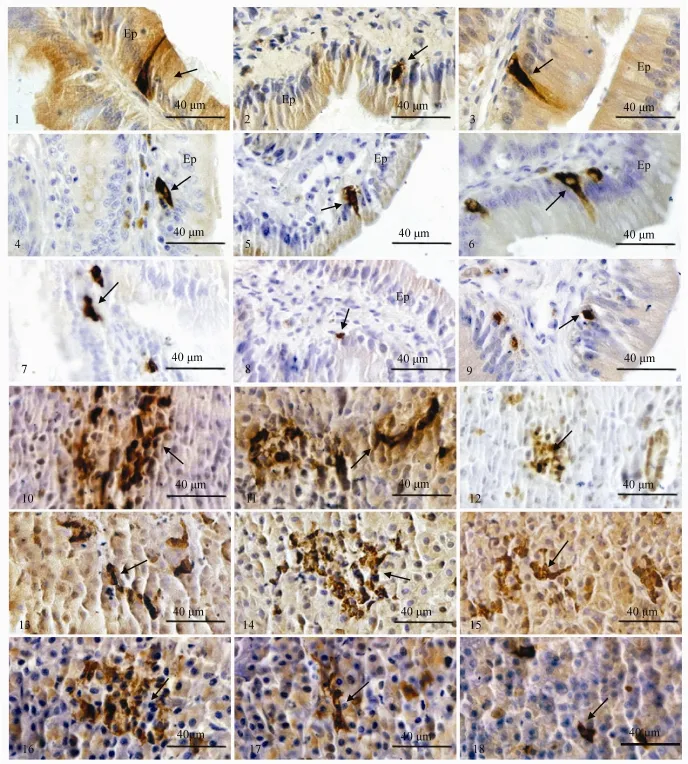
图版Ⅰ 饥饿和冬眠期牛蛙胃肠胰系统内分泌细胞的形态学变化PlateⅠ Morphological changes of endocrine cells in the GEP system of Rana catesbeiana during starvation and hibernation
Q954; Q253
A
1000-3207(2014)01-0187-06
10.7541/2014.26
2012-11-08;
2013-10-18
安徽省自然科学基金(No. 11040606M75); 芜湖市科技计划项目; 《现代遗传学》省级教学团队本科生研究性项目; 生物环境与生态安全省级重点实验室及安徽省重要生物资源保护与利用重点实验室建设基金(2007-10)资助
陈慧(1991—), 女, 安徽阜阳人; 主要从事动物细胞学研究。E-mail:1549178505@qq.com
张盛周, E-mail: szzhang@mail.ahnu.edu.cn

