脑震荡大鼠脑组织MDA、SOD、TNF-α及IL-1β表达变化
高峰,赵丽,谷振勇,丛斌
(1.河北医科大学法医系,河北石家庄050000;2.河北省公安厅物证鉴定中心,河北石家庄050017)
脑震荡是在临床和法医检案中经常遇到的一种颅脑损伤,以头部外伤后出现一过性意识丧失和短期记忆障碍为特点,多可自行恢复。有研究[1-2]表明,这种损伤与轻型弥漫性轴索损伤(diffuse axonal injury,DAI)相似。因脑震荡患者昏迷时间较短且常规病理学检查变化不明显,常被视为一种一过性的轻型颅脑损伤。但在临床上脑震荡后可能出现短暂性昏迷、记忆障碍及持久的躯体、认知和行为障碍症状等综合征,说明脑震荡后可能存在继发性脑损伤。本实验通过采用单摆式打击装置建立大鼠脑震荡模型,观察脑组织内丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活性及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)表达变化,探讨脑震荡后继发性脑损伤机制。
1 材料与方法
1.1 材料
健康Wistar大鼠32只(河北医科大学实验动物中心提供),雌雄不限,体质量200~220 g,随机分为对照组和实验组,对照组8只,实验组24只。
MDA和SOD测定试剂盒(南京建成生物工程研究所),兔抗大鼠TNF-α和IL-1β多克隆抗体及免疫组化SP试剂盒(北京中山生物技术有限公司)。
1.2 方法
1.2.1 建立大鼠脑震荡模型
建模:根据文献[3]的方法建立大鼠脑震荡模型,将大鼠用乙醚轻度麻醉后,俯卧位固定于单摆打击装置上,待大鼠刚恢复意识时,用长30 cm、2.5 kg金属单摆,以135°起始角下落打击大鼠枕外隆突部,选取打击后立即出现一过性昏迷,且昏迷时间在1~3min,清醒后活动正常,解剖时无大体损伤,组织病理学检查未见脑出血和挫伤者作为脑震荡模型建立成功大鼠。脑震荡大鼠打击后分别观察2、6、12h,每个时间点8只大鼠。分别在不同时间点放血处死。
对照组大鼠(n=8)经乙醚麻醉后绑缚在打击装置上不给予打击,待清醒活动正常后处死。
1.2.2 观察脑组织病理学改变
将大鼠脑组织沿正中矢状线切开,一侧完整固定,包括大脑、小脑及脑干,作为大鼠脑组织矢状位观察面,另一侧冠状取包括海马部位的大脑中部脑组织,置于4%甲醛溶液中固定,然后采用Weil氏染色进行镜下观察。
1.2.3 检测脑组织中MDA含量和SOD的活性
脑组织匀浆制备:将大鼠迅速断头取脑,在冰盘上取额部大脑皮质100mg,制成10%脑组织匀浆。匀浆液离心(2500×g,10min),取上清液测定MDA含量和SOD活性。
MDA含量检测:采用硫代巴比妥酸比色法测定,MDA与硫代巴比妥酸在酸性条件下煮沸缩合,生成红色化合物,此化合物在波长532 nm处有最大吸收峰,其吸光度与MDA含量呈正比。
SOD活性检测:超氧阴离子自由基(O2-)能氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,在550nm处有最大吸收峰,其吸光度与SOD活性呈反比。
1.2.4 检测大脑皮质和海马区TNF-α、IL-1β的表达
采用免疫组化SP法测定大鼠大脑皮质和海马区TNF-α、IL-1β表达,TNF-α、IL-1β均在细胞质内表达,阳性反应均呈棕黄色。
1.2.5 统计学分析
2 结果
2.1 脑组织病理学改变
大鼠脑震荡打击后立即昏迷,组织学检查未见脑出血和挫伤。Weil氏染色观察,脑震荡6h后可见皮质和小脑等部位轻度水肿、血管淤血,胼胝体、脑干、小脑白质等部位可见神经髓鞘排列紊乱、断裂、弯曲肿胀,12h上述变化更明显(图1)。

图1 小脑及胼胝体的神经纤维排列情况Weil氏染色×400
2.2 脑组织MDA含量和SOD活性改变
脑震荡2h组脑组织MDA含量较对照组明显增高(P<0.05),6、12h MDA含量下降,与对照组相比差异无统计学意义(表1)。
脑震荡2 h组脑组织SOD活性较对照组下降(P<0.05),6、12 h SOD活性与对照组相比差异无统计学意义(表1)。
2.3 大脑皮质和海马区TNF-α、IL-1β的表达
对照组大脑皮质、海马区中TNF-α和IL-1β不表达或表达较少。脑震荡组上述部位6、12h的TNF-α和IL-1β表达范围及表达强度均增加(图2~3)。
表1 各组脑组织中MDA以及SOD含量变化(n=8,±s)
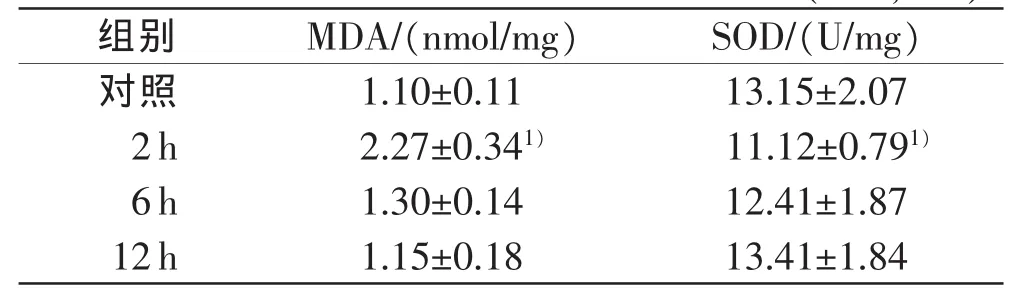
表1 各组脑组织中MDA以及SOD含量变化(n=8,±s)
注:1)与对照组相比,P<0.05
组别MDA/(nmol/mg)SOD/(U/mg)对照1.10±0.1113.15±2.07 2h2.27±0.341)11.12±0.791)6h1.30±0.1412.41±1.87 12h1.15±0.1813.41±1.84
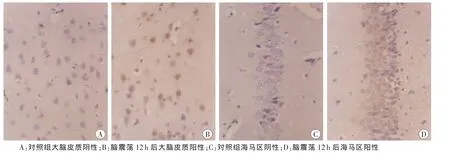
图2 大脑皮质和海马区脑组织TNF-α表达结果SP×400
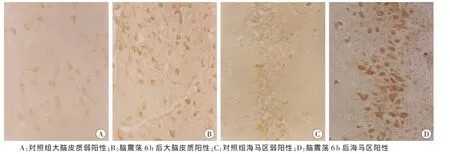
图3 大脑皮质和海马区脑组织IL-1β表达结果SP×400
3 讨论
研究闭合性颅脑损伤模型很多,本实验参照于晓军等[3]的模型自制单摆式机械打击装置制作大鼠脑震荡模型,采用单摆式打击模型,大鼠头部处于可活动状态,打击后可发生相应的直线或旋转运动,致伤物的能量可通过枕部颅骨传入脑组织造成损伤,而且单摆打击前大鼠头部不先给予损伤刺激,更能模拟现实生活中某些情况下头部受外力打击的作用过程。
大鼠脑震荡打击后6 h可见皮质和小脑等部位轻度水肿、血管淤血,Weil氏染色观察到胼胝体和脑干部位神经髓鞘排列紊乱、断裂、弯曲肿胀,12h变化更加明显。结果提示,大鼠脑震荡后脑组织存在一定的病理学变化。传统观点认为,脑震荡无器质性病变,损伤轻微,不留有后遗症。近年来,人们对脑震荡的机制及其脑组织结构的改变进行了研究[4],认为脑震荡的机制可能既有功能性变化,如外伤超强刺激引起脑皮质阻抑,也有器质性损伤,如脑内剪应力形成可使脑中间神经元受损,本实验结果也支持上述观点。
有学者[1-2]支持脑震荡与DAI的发生机制相同,是一种弥漫性的脑损伤,损伤不局限于受力部位。本实验选取受力部位的对侧脑组织进行脑震荡后氧化损伤情况的观察。
由于脑组织细胞含脂质较多,易受自由基攻击发生脂质过氧化损害,而SOD是体内主要的抗氧化酶,具有防止细胞膜脂质过氧化的作用,MDA则是氧自由基攻击生物膜后形成的脂质氧化代谢产物,因此MDA含量可反映机体内脂质过氧化程度。大鼠脑震荡损伤后2h脑组织MDA含量明显增加,而SOD活性降低,6h基本恢复,说明脑震荡大鼠脑组织中存在氧化损伤。有报道[5-7]显示,大鼠脑震荡早期脑血管痉挛、脑血流减少,随后血管反射性扩张,血流量回复并有可能超过伤前水平,因此氧自由基损伤可能与脑震荡后脑微循变化有关。也有实验[8]结果提示脑震荡大鼠脑组织存在氧化应激反应,氧自由基可通过攻击细胞膜、损伤线粒体DNA以及增加脑内兴奋性氨基酸等多种途径造成脑组织受损,这可能是脑震荡后继发性损伤的途径之一。
脑组织中TNF-α及IL-1β主要由神经元和胶质细胞产生,是外伤后较早释放的具有多种生物学效应的重要促炎细胞因子[9],表达区域主要在海马区、下丘脑以及脉络丛等部位[10]。本实验观察到对照组大鼠大脑皮质、海马区细胞胞浆中TNF-α和IL-1β不表达或表达较少,大鼠脑震荡后6h及12h表达明显增加,说明炎症细胞因子TNF-α和IL-1β参与调控脑震荡损伤后脑组织病理生理变化。TNF-α及IL-1β表达增高可激活磷脂酶A2[11]、中性粒细胞和单核巨噬细胞,介导脑创伤后的许多病理生理反应[12-14],包括发热、白细胞聚集以及血管内皮渗透性增加等,促进脑水肿的形成、颅内压的增高等,与继发性脑损害密切相关。脑震荡后两种炎症细胞因子随时间变化的趋势仍需进一步探讨。
脑震荡的发生、发展及预后不仅取决于不同原因引起的原发性损伤,还与继发性损伤有关。本实验结果表明,脑震荡大鼠组织存在脂质过氧化反应及炎症细胞因子TNF-α、IL-1β表达变化,提示上述指标可能是脑震荡后继发性损伤的重要介质。
[1]李上勋,刘丹,何光龙,等.弥漫性轴索损伤的研究进展[J].中国法医学杂志,2010,25(5):338-341.
[2]Onaya M.Neuropathological investigation of cerebral white matter lesions caused by closed head injury[J].Neuropathology,2002,22(4):243-251.
[3]于晓军,赵福弟,刘卯阳,等.大鼠脑震荡模型的建立及病理学研究[J].法医学杂志,1992,8(3):119-123.
[4]周青峰,尚定昆,满龙,等.脑震荡患者血清NSE和S-100B的检测及其意义[J].当代医学,2008,(8):29-30.
[5]Tadao M,Yuji O.Role of free radicals in the development of severe acute pancreatitis[J].Nihon Rinsho,2004,62(11):2015-2020.
[6]Shi C,Andersson R,Zhao X,et al.Potential role of reactive oxygen species in pancreatitis-associated multiple organ dysfunction[J].Pancreatology,2005,5(4-5):492-500.
[7]肖兴义,陈学田,冯渊春,等.脑震荡时脑血流变化规律特点研究[J].中国超声医学杂志,1998,14(6):38-40.
[8]Nito C,Kamiya T,Amemiya S,et al.The neuroprotectiveeffectofafreeradicalscavengerand mild hypothermia following transient focal ischemia in rats[J].Acta Neurochir Suppl,2003,86:199-203.
[9]张秀丽,孙志扬.大鼠脑损伤后TNF-α和IL-10的研究及地塞米松对其影响[J].浙江创伤外科,2010,15(5):563-565.
[10]严治,孙小丽,胡玉莲,等.大鼠脑挫伤后脑与其他器官组织中TNF-α表达的比较[J].法医学杂志,2012,28(4):261-264.
[11]王松军,丛斌,马春玲,等.IL-1β和TNF-α在大鼠弥漫性轴索损伤中的作用[J].中国法医学杂志,2010,25(5):323-326.
[12]Raivich G,Banati R.Brain microglia and blood-derived macrophages:molecular profiles and functional roles in multiple sclerosis and animal models of autoimmune demyelinating disease[J].Brain Res Brain Res Rev,2004,46(3):261-281.
[13]牛廷献,史智勇,罗建军.缺血缺氧脑损伤大鼠IL-6和TNF-α的变化及其临床意义[J].放射免疫学杂志,2009,22(6):559-562.
[14]Ito H,Yamamoto N,Arima H,et al.Interleukin-1beta induces the expression of aquaporin-4 through a nuclear factor-kappaB pathway in rat astrocytes[J].J Neurochem,2006,99(1):107-118.

