Fe2+对水稻生长及土壤微生物活性的影响
陈 娜, 廖 敏*, 张 楠, 徐培智, 解开治, 徐昌旭, 刘光荣
(1 浙江大学环境与资源学院,杭州 310058; 2 浙江省亚热带土壤与植物营养重点研究实验室,杭州 310058; 3 广东省农业科学院土壤肥料研究所,广州 510640; 4 江西省农业科学院土壤肥料与资源环境研究所,南昌 330200)
冷浸田是长期浸水的强潜育性低产水稻田,又称冷浸性水稻土,土壤中以Fe2+为主的还原性物质大量积累并对水稻生长产生毒害作用。冷浸田主要分布在我国南方各省山地、 丘陵和冲积平原的低洼地,全国约有346万公顷,占全国稻田面积的15.07%,占低产稻田面积的44.2%,是我国低产水稻土的一个主要类型[4]。目前,关于铅、 镉等重金属对水稻的毒害效应及临界值已有不少的研究[5,6],但对我国有关冷浸田还原态铁致毒剂量临界值及其机理的研究却鲜有报道,且相关研究主要集中在以营养液培养试验来探讨过量Fe2+对水稻的毒害效应及其机理[7]。其缺点是水培试验条件与大田相差悬殊,无法模拟土壤中的复杂环境状况,从而难以将研究者的试验结果广泛应用于实际农业生产,严重影响了冷侵田土壤毒害和养分供应障碍的调控,制约了冷侵田土壤生产力提升。
鉴此,本研究以广泛应用的杂交组合杭43为材料,以土培试验模拟冷浸田土壤环境,研究了不同外源Fe2+质量浓度处理下微生物生物量活性及其生态特征、 水稻的生理生长及抗氧化酶系统活性等土壤-水稻生态系统的动态变化[8],探讨水稻铁毒胁迫的生态毒理性,以期为冷浸田土壤铁毒剂量临界值及其机理等的研究提供理论依据。
1 材料和方法
1.1 土壤采集与水稻栽培
供试土壤为采自浙江大学紫金港试验场的水稻土。取表层0—20 cm土层的土样, 土样自然风干后过3.2 mm筛备用, 供试土壤的基本理化性质见表1。分别称取相当于4.0 kg烘干土质量的风干土样置于80 cm2×20 cm(底面积×高)塑料盆钵中,外源添加硫酸亚铁。设计亚铁处理水平为0、 100、 200、 400、 800和1600 mg/kg土壤 (纯亚铁计), 重复3次。同时分别拌入0.4 g/kg尿素、 0.4 g/kg磷酸氢二钾做基肥,混匀,淹水培养5 d后移栽具有25 d苗龄的水稻秧苗,每盆定苗4株。试验过程中模拟冷浸田土壤低温浸水的还原态环境,在盆口覆保鲜膜以减少外界空气对内部土壤还原环境的氧化,盆底安装循环去热通水水槽以降低盆内土壤温度,整个生育期保证每天定时浇水补充盆内水分损失并始终保持2 cm水层以隔绝外部空气,常规管理。为避免自然水体中养分离子对后期试验的影响,本试验特选定符合GB17324—2003《瓶(桶)装饮用纯净水卫生标准》的纯净水为唯一供试用水,供试水稻品种为常规晚粳稻杭43,试验在浙江大学紫金港校区网室进行。
1.2 样品采集
土壤样品于淹水预培养5 d后,在移栽水稻秧苗的15 d(苗期)、 30 d(分蘖期)采集。用特制的注射取样器(将医用50 mL注射器前端针孔与针管连接处平切成带活塞芯杆的圆柱管状采样器,利用芯杆拔出产生的气压采集土壤),多次、 多点抽取0—10 cm的表层土壤样品,集中于封口袋中,用玻璃棒拌均,制成混合土样,测定新鲜土壤微生物数量、 微生物量碳及亚铁含量。
在水稻分蘖期阶段测定水稻株高及成活率,使用便携式叶绿素仪测定水稻倒三叶叶片SPAD值,采集水稻倒三叶放入垫有纱布的托盘中,冰浴冷冻处理,带回室内分析过氧化物酶(POD)、 超氧化物歧化酶(SOD)、 过氧化氢酶(CAT)活性及脯氨酸(proline)含量。
1.3 测定方法
土样的基本理化性质采用常规分析方法。土壤亚铁用0.1 mol/L硫酸铝浸提,分光光度法测定; 土壤微生物量碳用氯仿熏蒸—0.5 mol/L K2SO4提取,TOC-500自动分析仪测定[9]; 同类型的微生物数量采用稀释平板计数法测定; 叶绿素含量(SPAD值)—叶绿素仪非破坏性快速测定[10]; 脯氨酸含量—磺基水杨酸提取,茚三酮比色法测定[11]; 过氧化物酶(POD)活性—愈创木酚法测定[12]; 超氧化物歧化酶(SOD)活性—采用南京建成生物公司SOD试盒进行,SOD抑制率达50%为一个亚硝酸盐单位,以u/g表示; 过氧化氢酶(CAT)活性—氧电极法[13]。土壤微生物活性和水稻生理指标皆用鲜样测定。
2 结果与讨论
2.1 不同水平外源亚铁处理对分蘖期水稻生理指标的影响
据报道,水稻种子从发芽期开始,经历幼苗期、 分蘖期、 拔节期这4个时期构成了水稻的第一个生长发育阶段—营养生长阶段。其中,水稻分蘖期是营养生长的关键时期,水稻-土壤-亚铁-微生物之间相互作用、 相互影响的关系已趋于稳定。而拔节期正处于营养生长和生殖生长的交替时期,是水稻生长的敏感时期。水稻在这一生长阶段受到高浓度Fe2+的毒害,抑制其细胞分裂和伸长[15],变得矮小细弱,表现出的铁毒胁迫症状尤为明显。与植株存活率等变化一致,植株株高、 地上部干重及根系干重随外源Fe2+浓度的增加而显著降低。土壤环境容量协作组1991年规定, 当作物产量减产10%或20%时为重金属毒害土壤的临界浓度[16]。由表2分析可知,以水稻农艺性状抑制率(y)与土壤中总Fe2+含量(x)的曲线拟合相关方程式y株高=-20.819+0.116x+4.17*10-8x3(r2=0.982), y干物质=-222.927+42.863lnx(r2=0.993), 分别求出株高抑制10%和20%的Fe2+临界浓度为259.41和338.01 mg/kg(土); 干物质积累减产10%和20%时的临界浓度分别为269.76 mg/kg和340.64 mg/kg。供试土壤的本底亚铁含量为207.77 mg/kg(土),当加入的外源性Fe2+浓度为100 mg/kg处理水平时,土壤总亚铁含量符合相应临界浓度范围,据此可推定供试水稻土土壤亚铁毒害的临界浓度约为300 mg/kg(土)。变异系数反映了水稻表观生理指标各参数对外源性铁毒胁迫的敏感程度,由以上分析可知,水稻植株存活率与干物质积累量是铁毒胁迫后更为敏感的生理指标。

表2 不同水平外源亚铁处理对分蘖期水稻农艺性状的影响
2.1.2 外源Fe2+对水稻叶绿素含量、 抗氧化酶系统活性和脯氨酸含量的影响 分蘖期处于水稻营养生长的旺盛时期,土壤—植株生态系统趋于稳定,不同浓度外源Fe2+处理对水稻的生理指标影响变化明显(表3)。植株SPAD值与其叶绿素含量呈显著正相关[10],外源性Fe2+处于100 mg/kg以下较低浓度范围时,水稻叶片SPAD值随Fe2+浓度提高显著增加,表观叶色也随Fe2+浓度的增加而加深,可能因为铁是形成叶绿素必需的营养元素,少量铁有利于叶绿素形成。当外源性Fe2+浓度为400 mg/kg以上时,抗氧化酶系统活性降低致使大量氧自由基扩散进入叶绿体并氧化叶绿素[20],使叶片SPAD值逐渐下降。随着外源Fe2+浓度的增加,土壤逆境环境增强,多种自由基生成造成氧化胁迫,POD作为植物体内清除活性氧的主要酶类,在外源性Fe2+浓度低于200 mg/kg处理以下保持平稳, 200 mg/kg处理以上快速增加。与POD的变化趋势一致,SOD活性在外源性Fe2+浓度低于100 mg/kg处理水平时表现出小幅波动,但无显著差异,之后显著上升然后显著下降,最后低于对照水平。CAT活性在外源性Fe2+浓度低于100 mg/kg 时即显著上升到达峰值又逐渐下降至对照水平以下。植物分泌脯氨酸能够调节细胞渗透压和细胞氧化还原潜能,起到稳定生物大分子结构、 清除体内活性氧的作用。与POD活性变化一致,水稻脯氨酸含量随Fe2+处理水平的增加而逐渐上升,研究结果与以往的报道相似[21]。
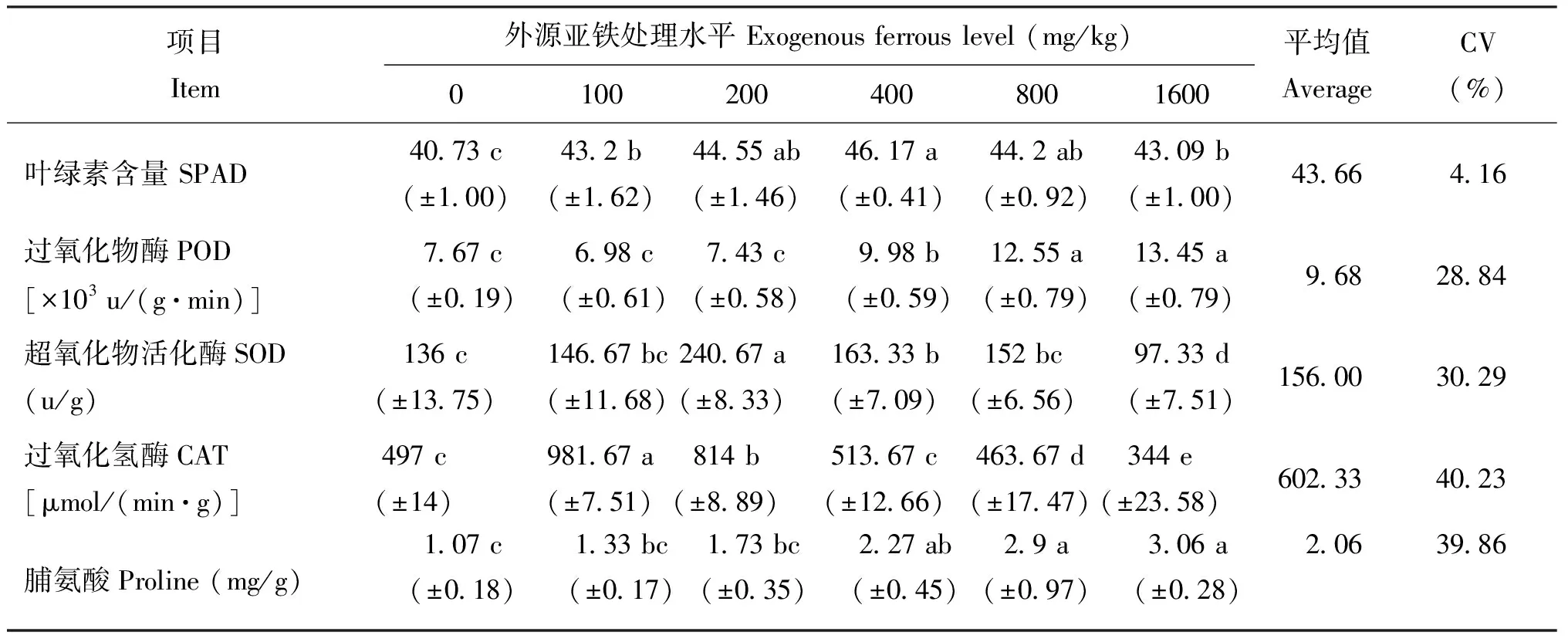
表3 分蘖期不同水平外源亚铁处理后水稻生理指标的变化
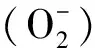
2.2 不同水平外源亚铁处理对土壤生态系统的影响

图1 不同生育期土壤Fe2+含量的变化Fig.1 Soil Fe2+concentrations at rice growth stages
2.2.1不同生育期土壤Fe2+含量的变化 由图1可知,土壤Fe2+含量在苗期和分蘖期与外源性Fe2+加入量成正相关关系,但由于土壤自身的缓冲作用和外界环境的氧化等影响,外源性亚铁处理为100 mg/kg时的损失率分别为6.54%和15.97%,浓度为800 mg/kg时分别达11.34%和30.99%,损失程度随外源亚铁处理水平和水稻的生长发育而加强。这主要是由于随着水稻的生长发育,外界环境温度升高,盆口覆膜等措施不足以消除外界环境对盆栽水稻内部土壤的氧化,Fe2+被氧化的程度随之严重。因此,本试验选定水稻适应性生长的苗期和生命活动旺盛的分蘖期为研究重点,以期更准确地反映亚铁处理对土壤-水稻-亚铁-微生物相互作用体系的影响。
2.2.2 外源Fe2+对土壤微生物活性的影响
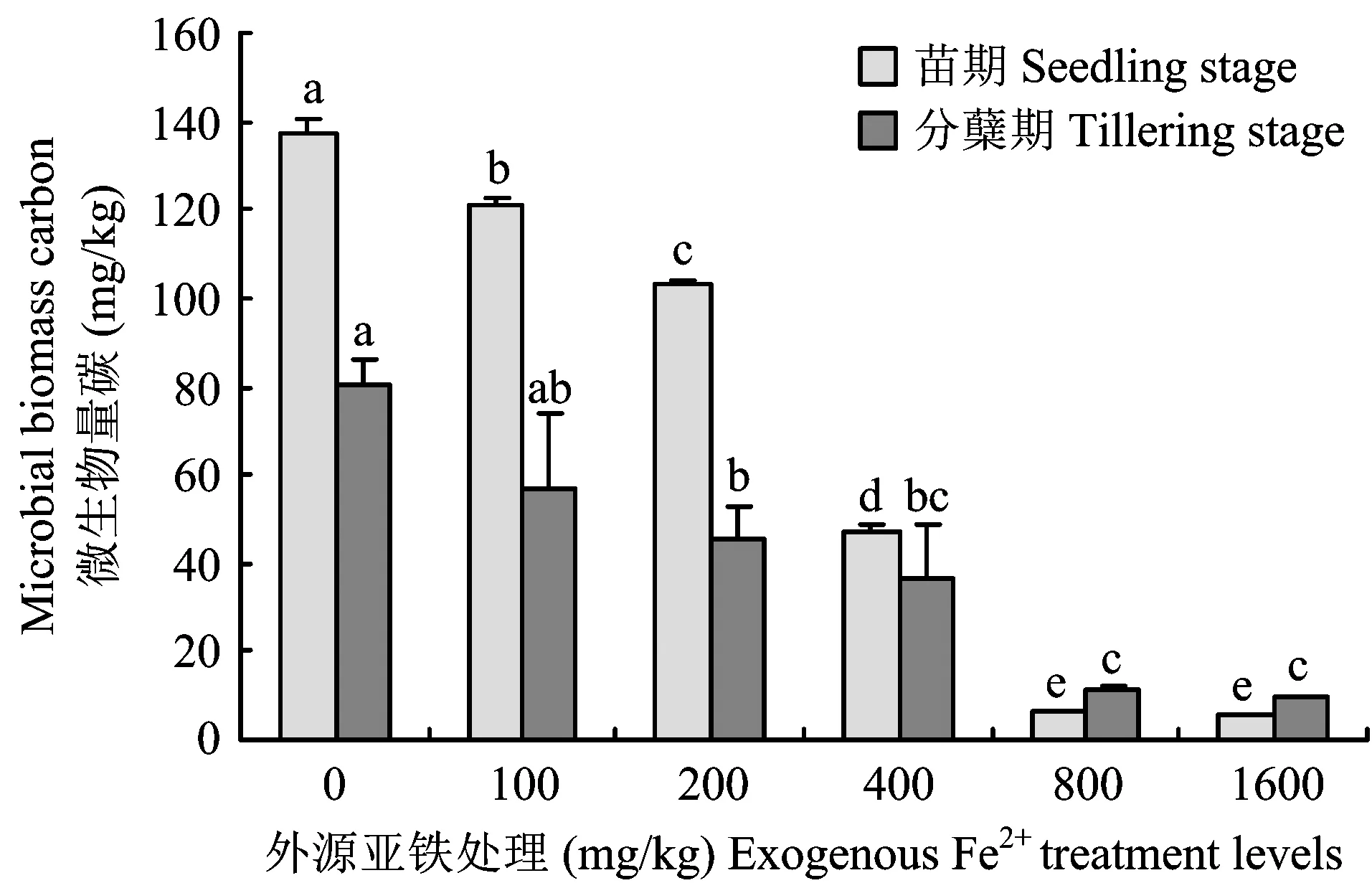
图2 外源亚铁处理对土壤微生物量碳总量的影响Fig.2 Soil microbial biomass carbon amounts under different exogenous Fe2+ treatment levels
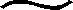
2.2.2.2 外源 Fe2+对土壤细菌、 真菌、 放线菌总量的影响 土壤中基础菌系包括细菌、 真菌、 放线菌三大类群微生物区系。细菌是土壤微生物中数量最多的类群,主要起到有机物分解和有机碳氮转化的作用[24]。真菌是参与土壤中有机质分解过程的主要成员之一,能与植物共生,为植物提供养分,是生态系统健康的有效指示物。土壤中的放线菌是抗生素的主要生产菌,能够分解土壤中的纤维素、 木质素和果胶类物质等,进而改善土壤的养分状况,便于作物直接吸收利用土壤养分和防治病虫害。综上所述,基础菌系在土壤有机质分解、 转化过程中起到重要作用,其数量大幅减少必然导致有机质的循环矿化速度减缓,导致土壤有机质积累,养分供应失调。
图3 外源亚铁处理对水稻不同生育期三大基础菌系总量的影响Fig.3 Soil basic bacteria amounts under different exogenous Fe2+ treatment levels
由图3可知,三大基础菌系微生物总量随外源Fe2+浓度的增加而显著减少,水稻分蘖期生命活动旺盛,土壤微生物反应强烈,基础菌系微生物总量明显高于水稻苗期生长发育阶段。基础菌系微生物总量在外源Fe2+浓度为100 mg/kg水平以下迅速减少,100 mg/kg水平以上缓慢降低。外源性Fe2+浓度为100 mg/kg较低水平时,基础菌系微生物总量在苗期和在分蘖期分别占空白对照的77.05%和66.55%,浓度为400 mg/kg时分别仅占空白对照的45.64%和50.06%,由此可见,高浓度铁毒胁迫导致微生物活动明显偏弱,降低土壤有机质分解速率,造成土壤养分供应失调,不利于水稻的生长。
2.2.2.3 外源 Fe2+对土壤氨化细菌、 固氮菌、 纤维分解菌总量的影响 土壤中三大功能菌系包括氨化细菌、 固氮菌、 纤维分解菌三类,是土壤中主要的降解性微生物,能够有效地促进土壤养分元素循环和污染物降解转化。氨化细菌可将植物残体中的蛋白质氨化,使土壤中不能被植物利用的有机含氮化合物转化为有效态氮,供给植物和部分微生物同化吸收。固氮菌与植物共生能够将大气中气态氮素还原为氨供植物吸收利用[25],有效促进土壤氮素积累及植物氮素营养吸收。纤维素分解菌及其分泌的酶类物质担负着分解植物残体带到土壤中的纤维素的重要功能,在生态系统碳素循环中有重要作用[26],其分布状况与土壤性状、 土壤肥力有着密切的关系。因此,三大功能菌系在土壤中主要起到分解转化有机态氮素、 固定大气中氮素和分解纤维素的作用,但由于冷浸田土壤常年积水、 光照不足,使得其水冷土温低,氧化还原电位较低,土体表现出强还原性,不利于上述三类好氧微生物的生长。
在水稻苗期和分蘖期阶段,随着外源性Fe2+浓度增加及其毒性的增强,土壤中三大功能菌系微生物活性受到显著抑制,导致其微生物总量先快速减少后保持平稳降低,并在外源性Fe2+浓度为100 mg/kg时发生下降转折点,这一结果与上述基础菌系的变化趋势一致。由图4可知,外源性Fe2+浓度达200 mg/kg以上水平时,土壤中功能菌系微生物量在苗期和分蘖期平均分别仅占空白处理的43.67%和48.52%,不能够满足土壤中各元素循环的需要,造成土壤养分失调。此外,在较高浓度铁毒胁迫下的功能菌总量整体呈平稳下降的趋势,这可能是由于土壤中微生物对高浓度铁毒胁迫的适应性机制,其机理仍需进一步研究。
2.2.2.4 外源 Fe2+对土壤铁还原菌总量的影响 铁还原菌(FRB)是指在生长过程中以生长基质中的Fe3+作为电子受体,氧化有机物作为电子供体,将Fe3+还原为Fe2+的厌氧或兼性厌氧微生物[27]。供试水稻土壤长期处于淹水嫌气状态,氧化还原电位较低,在铁还原菌的作用下容易生成致毒性较强的还原态Fe2+。但是,随着外源性Fe2+浓度的增加及其毒性的增强,铁还原菌可用Fe3+相对减少,致使其异化Fe3+还原生成Fe2+的途径减少,总量也随之显著降低(图5)。

图4 外源亚铁处理对水稻不同生育期三大功能菌系总量的影响Fig.4 Soil functional bacteria amounts under different exogenous Fe2+ treatment levels
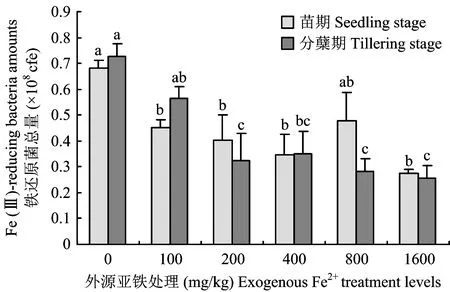
图5 外源亚铁处理对水稻不同生育期铁还原菌总量的影响Fig.5 Soil Fe (Ⅲ)-reducing bacteria amounts under different exogenous Fe2+ treatment levels
由图5可知,不同浓度外源Fe2+处理后,水稻不同生育期土壤铁还原菌总量都随外源Fe2+浓度的增加而显著降低。水稻苗期阶段,用100、 200、 400、 800和1600 mg/kg 外源Fe2+处理后,土壤可培养的微生物总量分别占空白处理的56.64%、 59.03%、 50.59%、 69.89%和40.16%。水稻分蘖期阶段,各处理微生物总量分别占空白对照的77.45%、 44.69%、 48.08%、 37.70%和35.14%,各处理间差异较显著。水稻分蘖期是营养生长的关键时期,土壤-亚铁-微生物之间相互作用、 相互影响的关系已趋于稳定,此时土壤铁还原菌总量在外源Fe2+浓度100 mg/kg以下时显著下降,之后处于相对平稳期,总量仅达到空白处理的41.40%左右,极大减缓了土壤有机质分解,不利于作物生长发育的需要。以上结果表明,外源性Fe2+浓度在100 mg/kg以下是土壤微生物相对耐受但变化敏感的区间,应注意防治土壤Fe2+含量的继续增长,防止铁毒胁迫危害的增强。
2.2.3 土壤微生物活性指标在水稻不同生育期的土壤亚铁总量半效应浓度值 土壤微生物活性对土壤环境变化反应敏感,是反映土壤污染、 表征土壤质量的重要生物学指标,其活性随土壤污染程度的加强而逐渐减弱。欧洲经济合作发展组织(OECD)的相关试验(编号208)研究发现, 半效应浓度EC50是评价重金属对植物急性毒害效应的重要参考参数[28-29]。据此,本试验设定对微生物活性的抑制率50%为准,参考林志华[30]的研究计算土壤Fe2+总量对土壤微生物活性的抑制率,应用GraphPad Prism 5.0软件计算出土壤微生物活性指标在水稻不同生育期的土壤亚铁总量半效应浓度值(表4)。
由表4分析可知,水稻苗期土壤微生物活性指标的EC50存在较大差异,这可能是由于苗期阶段水稻移栽入盆,土壤微生物不能适应复杂土壤环境导致,其机理还有待继续研究。水稻分蘖期是营养生长的关键时期,此时土壤-亚铁-微生物之间相互作用、 相互影响的关系已趋于稳定,多数微生物活性指标(微生物基础菌系总量、 功能菌系总量、 铁还原菌总量)的土壤亚铁总量EC50达300 mg/kg,且表现出显著相关性。供试土壤的本底亚铁含量为207.77 mg/kg(土),当加入的外源性Fe2+浓度为100 mg/kg处理水平时,土壤亚铁总量符合相应临界浓度范围,且与水稻多数生理指标指示的临界浓度范围吻合,据此可推定供试水稻土土壤亚铁毒害的临界浓度约为300 mg/kg(土),超出此浓度需加强农艺技术措施以防止亚铁毒害。
2.3 不同水平外源亚铁处理后水稻生长与土壤微生物活性的相关性分析
表5表明,不同水平外源亚铁处理后水稻农艺性状(单株分蘖数、 株高、 干物质积累)与其对应的水稻分蘖期土壤微生物活性指标(基础菌总量、 功能菌总量、 铁还原菌总量、 微生物量碳)存在极显著正相关性,二者表征的供试土壤亚铁毒害临界浓度范围吻合; 相反,以过氧化物酶活性为代表的水稻抗氧化酶系统活性和水稻脯氨酸含量与供试土壤微生物活性指标显示出极显著负相关性,这主要是因为它们的数量反映了水稻受环境胁迫的影响程度,随水稻受胁迫程度而增加,这与以往的报道较为一致[31]。
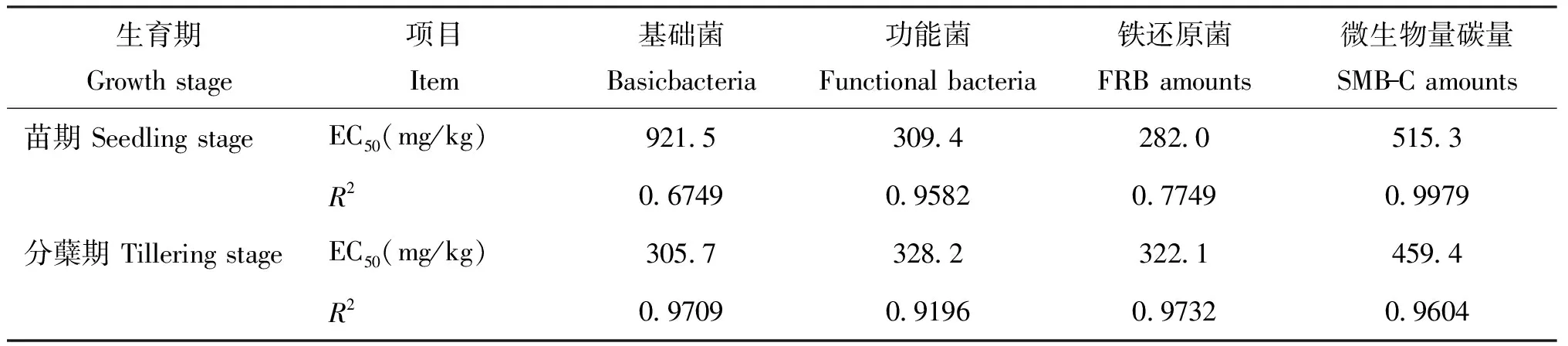
表4 土壤微生物活性指标的土壤亚铁总量半效应浓度值
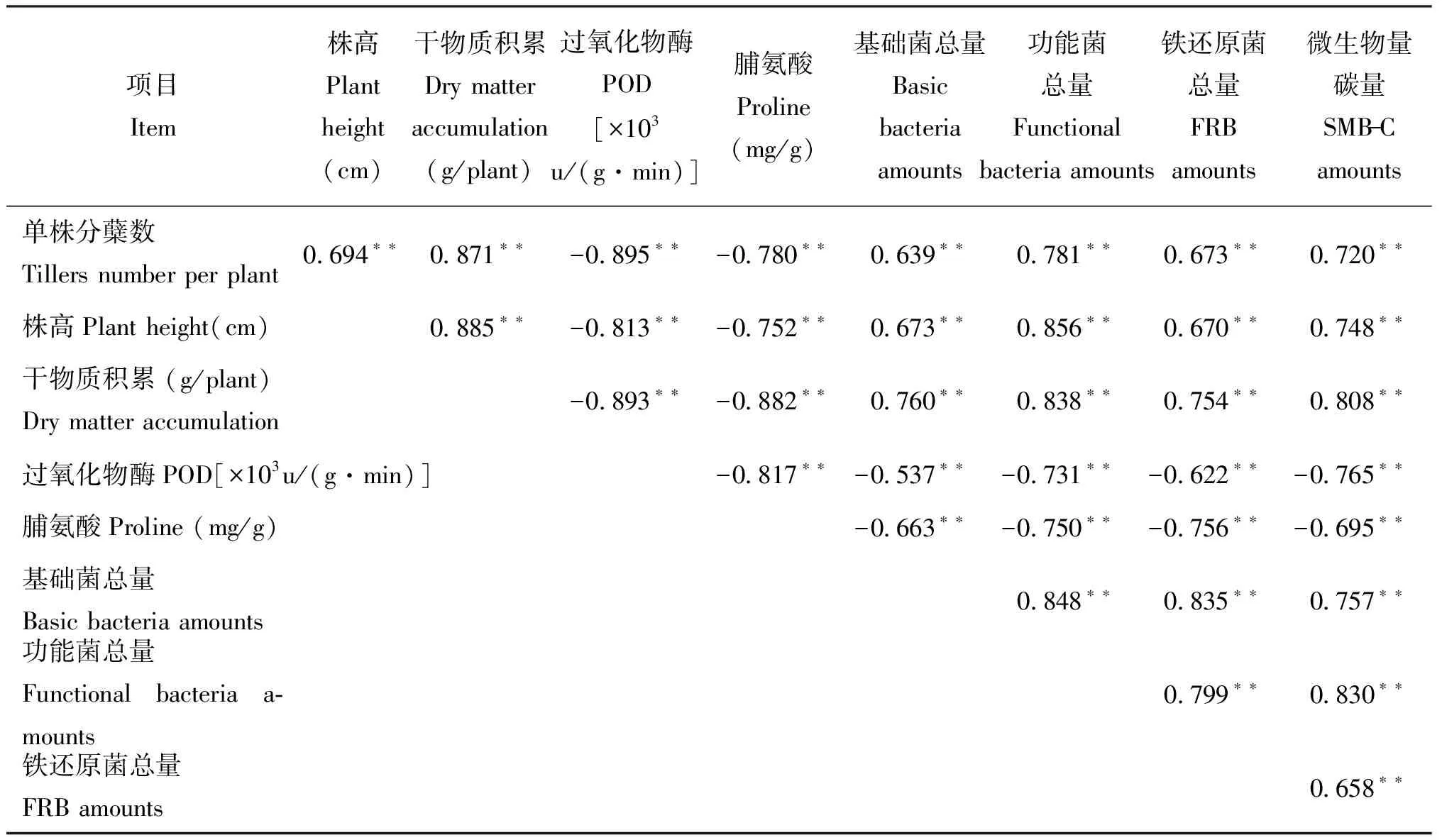
表5 不同水平外源亚铁处理后水稻生长与土壤微生物活性的相关性
上述结果表明,试验条件下,土壤-水稻-亚铁-微生物体系之间相互影响相互作用是同步的,继而表现出各处理指标变化趋势存在显著相关性,外源亚铁浓度超出100 mg/kg处理时开始严重抑制水稻生长、 降低土壤微生物活性,因此当土壤中亚铁浓度超出一定限制后,应加强农艺技术措施防止亚铁毒害,保证土壤-水稻-亚铁-微生物体系的环境协调性,保障水稻正常生长所需的环境,实现水稻的稳产与高产。
3 结论
1)过量Fe2+胁迫抑制了水稻地上部和根系的生长,分蘖期植株株高和干物质积累量随外源亚铁处理水平的增加而显著降低,通过曲线拟合推定导致水稻铁毒胁迫的供试土壤亚铁总量临界浓度约为300 mg/kg(土)。
2)水稻其他生理指标如存活率、 单株分蘖数及抗氧化酶系统活性也能较好地反映土壤亚铁浓度对水稻生长的影响,多数指标在外源性Fe2+浓度超出100 mg/kg(土)时出现显著差异。供试土壤的本底亚铁含量为207.77 mg/kg(土),此时土壤中亚铁总量约为300 mg/kg(土),据此可推定供试土壤亚铁总量达300 mg/kg(土)是影响水稻生长的浓度转折点。
3)在土壤-水稻生态系统中,土壤微生物量碳、 微生物总量、 基础菌(细菌、 真菌、 放线菌)总量, 功能菌(氨化细菌、 固氮菌、 纤维分解菌)总量和铁还原菌总量都随外源亚铁处理水平的增大而降低,多数微生物活性指标(微生物基础菌系总量、 功能菌系总量、 铁还原菌总量)的土壤亚铁总量EC50达300 mg/kg(土),与水稻农艺性状表征的临界浓度吻合,从土壤微生物毒理学角度分析,也可以推定300 mg/kg(土)是供试土壤亚铁毒害的临界浓度。
4)在土壤-水稻-亚铁-微生物相互作用的体系中,不同水平外源亚铁处理后水稻生长与土壤微生物活性存在显著相关性,表明亚铁对土壤-水稻-微生物体系的相关影响是同步的,因此在实际农业生产中应注意土壤Fe2+的积累对土壤-水稻-微生物生态系统的影响,Fe2+含量达到产生负效应浓度时,应加强农艺技术措施以防止亚铁毒害。
参考文献:
[1] 李达模, 唐建军, 苏以荣, 等. 湘中、 湘北地区早籼稻耐土壤潜育性评价[J].武汉植物学研究, 1992, 10(2): 139-151.
Li D M, Tang J J, Su Y Retal. Appraisal of early rice tolerance to gleyic paddy soil in central and northern Hunan[J]. Journal of Wuhan Botanical Research, 1992, 10(2): 139-151.
[2] 李达模, 唐建军, 李阳生.水稻耐(抗)潜育性土壤抗逆境的生理生态机制及抗逆品种选育进展[J].水稻文摘, 1991, 10(2): 1-4.
Li D M, Tang J J, Li Y S. Physiological mechanism of anti-stress and resilience breeding progress of resistant gley soil of rice[J]. Rice Abstracts, 1991, 10(2): 1-4.
[3] 胡彬, 吴平, 廖春燕, 等. 水稻依赖抗坏血酸H2O2清除系统在抗铁毒中的作用[J].植物生理学报, 1999, 25(1): 43-48.
Hu B, Wu P, Liao C Yetal. Effect of ascorbate-specific H2O2-scavenging on tolerance to iron toxicity in rice[J]. Acta Phytophysiologica Sinica, 1999, 25(1): 43-48.
[4] 柴娟娟, 廖敏, 徐培智, 等. 我国主要低产水稻冷浸田养分障碍因子特征分析[J].水土保持学报, 2012, 26(2): 284-288.
Chai J J, Liao M, Xu P Zetal. Feature analysis on nutrient's restrictive factors of major low productive waterlogged paddy soil in China[J]. Journal of Soil and Water Conservation, 1999, 25(1): 43-48.
[5] 陈会, 任艳芳, 陈秀兰, 等.镉胁迫下不同耐性水稻植株幼苗生长和抗氧化酶的变化[J].江西农业大学学报, 2012, 34(6): 1099-1104.
Chen H, Ren Y F, Chen X Letal. Changes of seedlings growth and antioxidant enzyme activities of different Cd-tolerant rice cultivars under cadmium stress[J]. Acta Agriculturae Universitis Jiangxiensis, 2012, 34(6): 1099-1104.
[6] 郭成士.土壤铅对作物的毒害效应及临界值研究[D].福建: 福建农林大学硕士学位论文, 2011.
Guo C S. Study of the effects of soil lead to plant and the toxicity threshold of soil lead[D]. Fujian: MS thesis of Fujian Agriculture and Forestry University, 2011.
[7] 邢成华, 蔡妙珍. 过量Fe2+对水稻的毒害作用[J]. 广东微量元素科学, 2007, 14(1): 17-22.
Shao C H, Cai M Z. Toxological effect of excessive Fe2+on rice[J]. Guangdong Trace Elements Science, 2007, 14(1): 17-22.
[8] 蔡妙珍, 林咸永, 罗安程, 等. 过量Fe2+对水稻生长和某些生理性状的影响[J].植物营养与肥料学报, 2002, 8(1): 96-99.
Cai M Z, Lin X Y, Luo A Cetal. Effects of excessive Fe2+on growth and physiological characters of rice[J]. Plant Nutrition and Fertilizer Science, 2002, 8(1): 96-99.
[9] 陈果, 刘岳燕, 姚槐应, 等. 一种测定淹水土壤中微生物生物量碳的方法: 液氯熏蒸浸提—水浴法[J].土壤学报, 2006, 43(6): 986.
Chen G, Liu Y Y, Yao H Yetal. A method for measuring microbial biomass C in waterlogged soil: chloroform fumigation extraction-water bath method[J]. Acta Pedologica Sinica, 2006, 43(6): 986.
[10] 薛香, 吴玉娥.小麦叶片叶绿素含量测定及其与SPAD值的关系[J].湖北农业科学, 2010, 49(11): 2701-2702.
Xue X, Wu Y E. Chlorophyll content determination and its relationship with SPAD value in wheat[J]. Hubei Agricultural Sciences, 2010, 49(11): 2701-2702.
[11] 张殿忠, 汪沛洪, 赵会贤.测定小麦叶片游离脯氨酸含量的方法[J].植物生理学通讯, 1990(4): 62-65.
Zhang D Z, Wang P H, Zhao H Xetal. Determination of the content of free proline in wheat leaves[J]. Plant Physiology Communications, 1990(4): 62-65.
[12] 王延璞, 王静, 孙晓艳.锰胁迫对大豆幼苗POD活性及其同工酶的影响[J].安徽农业科学, 2011, 39(9): 5065-5067.
Wang Y P, Wang J, Sun X Y. Effects of manganese stress on POD activities and isozymes of soybean[J]. Journal of Anhui Agricultural Sciences, 2011, 39(9): 5065-5067.
[13] 张志良.植物生理学实验指导(第二版)[M].北京: 高等教育出版社, 1990.154-157.
Zhang Z L. Plant physiology experiment instruction(Second Edition)[M]. Beijing: Higher Education Press, 1990. 154-157.
[14] 朱鹤健.水稻土[M].北京: 农业出版社, 1985. 226-228.
Zhu H J. Paddy soil[M]. Beijing: Agriculture Press, 1985. 226-228.
[15] 冯双华, 贾凌辉, 苏以荣.不同浓度亚铁培养液对水稻生长发育及产量构成的影响[J].农业现代化研究, 1992, 13(6): 361-365.
Feng S H, Jia L H, Su Y R. Effect of different Fe2+culture medium on rice growth and yield[J]. Research of Agricultural Modernization, 1992, 13(6): 361-365.
[16] 赵雪梅.重金属Cd污染土壤毒性的复合指标的研究[D].广西: 广西大学硕士论文, 2008.
Zhao X M. Studies on toxicity indexes of cadmium contamination soil[D]. Guangxi: MS thesis Guangxi University, 2008.
[17] 宋金敏, 刘鹏, 徐根娣, 等.水稻根尖边缘细胞对铁胁迫的缓解效应[J].中国水稻科学, 2009, 23(5): 503-508.
Song J M, Liu P, Xu G Detal. Border cells alleviating ferrous toxicity in rice root tips[J]. Chinese Journal of Rice Science, 2009, 23(5): 503-508.
[18] 原红娟, 陈丽.盐胁迫对几种叶菜生理生化指标的影响[J].北方园艺, 2011, (24): 52-54.
Yuan H J, Chen L. Effect of salt stress on the physiology and biochemistry indexes of several leafy vegetable[J]. Northern Horticulture, 2011, (24): 52-54.
[19] 龙应霞, 刘荣鹏, 刘洋. Fe2+对水稻苗期根系的影响及保护酶POD活性变化[J].黔南民族师范学院学报, 2011, (3): 56-59.
Long Y X, Liu R P, Liu Y. Effect of Fe2+on rice root system and POD activity in seedling stage[J]. Journal of Qiannan Normal College for Nationalities, 2011, (3): 56-59.
[20] 周锋利, 江玲等.钾离子对水稻亚铁毒害的缓解作用[J].南京农业大学报, 2005, 28(4): 6-10.
Zhou F L, Jiang Letal. Amelioration of Fe2+toxicity by K+in rice[J]. Journal of Nanjing Agricultural University, 2005, 28(4): 6-10.
[21] Lin C C, Kao C H. Proline accumulation is associated with inhibition of rice seedling root growth caused by NaCl[J]. Plant Sciences, 1996, 114: 121-128.
[22] 闫晗, 吴祥云, 黄静, 等.评价土壤质量的微生物指标及其研究方法[J].山西农业科学, 2010, 38(10): 78-81.
Yan H, Wu X Y, Huang Jetal. Microbial indicator of soil quality evaluation and its studying methods[J]. Journal of Shanxi Agricultural Sciences, 2010, 38(10): 78-81.
[23] 柴娟娟, 廖敏, 徐培智, 等.我国主要低产水稻冷浸田土壤微生物特征分析[J].水土保持学报, 2013, (1): 249-253, 259.
Chai J J, Liao M, Xu P Zetal. Analysis on soil microbial characteristics of major low productive waterlogged paddy soils in China[J]. Journal of Soil and Water Conservation, 2013, (1): 249-253, 259.
[24] 李杨, 徐国强, 黄国宏, 等.开放式空气二氧化碳浓度增高(FACE)对稻麦轮作土壤微生物数量的影响J].应用生态学报, 2004, 15(10): 1847-1850.
Li Y, Xu G Q, Huang G Hetal. Effects of free-air CO2enrichment (FACE) on soil microbial biomass under rice-wheat rotation[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1847-1850.
[25] 吴凡, 张楠, 张莎莎, 等.桑树根际固氮细菌的分离鉴定及固氮酶活力测定[J].蚕业科学, 2008, 34(3): 387-392.
Wu F, Zhang N, Zhang S Setal. Isolation, identification and nitrogenase activities of mulberry rhizosphere azotobacter[J]. Acta Sericologica Sinica., 2008, 34(3): 387-392.
[26] Nowak J, Nowak D, Chevallier P. Analysis of composite structure and primordial wood remains in petrified wood[J]. Applied Spectroscopy, 2007, 61(8): 889-895.
[27] Lovley D R. Dissimilatory metal reduction[J]. Annual Review of Microbiology., 1993, 47: 263-290.
[28] 张自立, 常江, 汪成胜, 等.混合稀土对作物生长量的影响[J].中国稀土学报, 2001, 19(1): 85-87.
Zhang Z L, Chang J, Wang C Setal. Effect of rare earth elements on growth of crops[J]. Journal of the Chinese Rare Earth Society, 2001, 19(1): 85-87.
[29] 陈世宝, 林蕾, 魏威, 等.基于不同测试终点的土壤锌毒性阈值及预测模型[J].中国环境科学, 2013, 33(5): 922-930.
Chen S B, Lin L, Wei Wetal. Comparative study of Zn-toxicity thresholds in 16 Chinese soils as determined by different bioassay endpoints and its predicted models[J]. China Environmental Science, 2013, 33(5): 922-930.
[30] 林志华, 刘长辉, 王海斌, 等.不同浓度瑞飞特对土壤微生物及土壤酶活性的影响[J].农产品加工学刊, 2009, (9): 10-11, 15.
Lin Z H, Liu C H, Wang H Betal. The soil microbe and soil enzyme activity after treated with different concentrations pretilachlor[J]. Academic Periodical of Farm Products Processing, 2009, (9): 10-11, 15.
[31] 曾路生, 廖敏, 黄昌勇, 等. 外源铅对水稻土微生物量、 微生物活性及水稻生长的影响[J].生态环境, 2008, 17(3): 993-998.
Zeng L S, Liao Min, Huang C Yetal. Effects of lead contamination on soil microbial biomass, microbial activities and rice growth in paddy soils[J]. Ecology & Environment, 2008, 17(3): 993-998.

