贵阳猫源弓形虫株基因分型及毒力研究
孟德娣,王 林,楼 研,房功思,沈继龙
刚地弓形虫(Toxoplasmagondii)是一种世界性分布的专性细胞内寄生原虫,可感染包括人类在内的几乎所有恒温动物,引起人兽共患弓形虫病。人类对弓形虫普遍易感,据估计全世界约有1/3的人感染弓形虫,中国人群弓形虫血清抗体平均阳性率为7.88%[1]。人类感染弓形虫主要通过摄入含有包囊的生的或未煮熟的肉类,食入被卵囊污染的食物或饮水,及母婴垂直传播[2]。正常人群感染弓形虫后主要表现为无症状的隐性感染,但对免疫功能低下或缺陷者(如恶性肿瘤、器官移植及HIV感染者),则可引起中枢神经系统损害,甚至导致致死性机会感染。
已知全球弓形虫基因型主要来源于6个分支进化单位,且在不同地域具有不同的优势基因型[3]。在北美、欧洲弓形虫的基因型主要以无性系原型(archetype)克隆谱系I、II和III型为主[4-5].I型对小鼠的致死剂量为一个速殖子,属强毒株;II和III型对小鼠的致死剂量超过1000个速殖子,属弱毒株。最近报告,Type 12为流行北美野生动物中的优势基因型[6],而在南美地区,其基因型具有丰富的遗传多样性,主要为非典型[7]。在非洲,弓形虫分离株基因型主要以II型和III型为主; Africa 1型和Africa 3型也是流行于非洲的优势基因型[8]。我们对中国东南、中部和西部地区调查发现,中国弓形虫分离株具有有限的遗传多态性,且China 1型为其优势基因型[1,9-11]。西南地区具有丰富的遗传多样性,作为弓形虫宿主的动物种类较多,但该地区弓形虫的遗传进化和毒力未见报道。本文采用PCR-RFLP对中国西南地区(贵阳)猫源弓形虫株进行基因分型,探讨其与中国其他地区有无遗传差异,以及分离株对不同品系小鼠的毒力。现将结果报告如下。
1 材料与方法
1.1实验动物和虫株 猫购自于贵州贵阳,雌雄各半,所有猫均麻醉处死,取脑组织进行弓形虫虫株分离。雌性KM,BALB/c,C57BL及ICR小鼠各10只,SPF级, 5~6 w龄,体重20±2 g,购于安徽省实验动物中心,室温下自由进食标准颗粒饲料、饮水。参考虫株DNA (GT1(基因I型),PTG(基因II型),CTG株(基因III型))由美国田纳西大学苏春雷教授惠赠。
1.2试剂及主要仪器 DNA纯化试剂盒购自德国QIAGEN 公司;PCR预混液购自美国Promega 公司;琼脂糖购自美国Invitrogen公司;限制性内切酶Sau96Ⅰ,HaeⅡ,Hinf I,TaqI,NciI,BsiE I,MseI,BsmA I,MboII,HpyCH4 Ⅳ,RsaI,HaeIII,NlaIII,AvaI,AflII,DdeI购自美国Ferments公司;PCR纯化试剂盒购自杭州爱思进生物技术有限公司;SAG1,SAG2,SAG3,BTUB,GRA6,c22-8,c29-2,L358,PK1,Apico引物由上海生工生物工程有限公司合成;凝胶成像系统为珠海Hema公司产品,ATC 201型 PCR 扩增仪为美国 Apollo 公司产品。
1.3方法
1.3.1猫源弓形虫的分离 采取与文献报道[12]相似的方法:取猫脑组织50 g,加入125 mL无菌生理盐水,制备形成匀浆液,加入 37 ℃预热的盐酸胃蛋白酶消化液,置恒温摇床中,37 ℃,150 r/min,消化1 h。离心,弃上清液,加入约 20 mL 的 PBS,用1.2%碳酸氢钠溶液调pH为中性,离心,灭菌生理盐水稀释,(氨苄西林1 000 U,链霉素 100 μg/mL)制成混悬液。将上述组织悬液腹腔接种KM小鼠3只,每只小鼠接种 1 mL。每d观察,如小鼠有竖毛、弓背、厌食等明显症状时,收集腹腔灌洗液涂片,镜检。
1.3.2弓形虫DNA的提取与基因分型 分别取弓形虫感染小鼠的腹水,PBS洗涤3次,离心收集弓形虫速殖子后,用QIAamp®DNA Mini kit试剂盒提取基因组DNA,于-20 ℃保存备用。
使用苏春雷等发表的SAG1、SAG2、SAG3、BTUB、GRA6、c22-8、c29-2、L358、PK1及Apico基因特异性引物[5],以弓形虫参考虫株及本室分离株的基因组DNA为模版,扩增上述10个基因片段,反应总体积为50 μL,其中PCR master mix 25 μL、上下游引物各1 μL、DNA模板1.5 μL。扩增条件为94℃预变性5 min,然后94℃变性30 s,60 ℃退火60 s,72 ℃延伸90 s,循环35次,最后72 ℃延伸10 min。反应结束后,每管取5 μL PCR产物在含溴化乙锭(Ethidium Bromide,EB)的1%琼脂糖凝胶中100 V电泳30 min,并在凝胶成像仪中观察结果。然后各管余下PCR产物经1%的琼脂糖凝胶电泳后用DNA胶回收试剂盒切胶回收,纯化的PCR产物用相应的内切酶酶切。酶切后产物经2.5%琼脂糖凝胶电泳,0.5 μg/mL溴化乙锭染色后,在凝胶成像系统中观察并记录结果。
1.3.3弓形虫的毒力 弓形虫CT-1株感染KM小鼠,待出现明显症状后收集腹水,PBS洗涤3次后经梯度离心法纯化速殖子[1],纯化后速殖子经PBS稀释至2 mL置显微镜下计数,按1×103个/只腹腔感染SPF级KM,BALb/c,C57BL,ICR小鼠,每组10只。逐日观察小鼠状态并计算死亡率和存活时间,至感染后45 d颈椎脱臼处死各组存活小鼠,脑组织压片观察包囊是否形成。累积死亡率=死亡小鼠个数/感染小鼠个数。
1.4统计学分析 采用SPSS13.0软件进行统计分析。根据不同品系的小鼠的存活时间、死亡率,采用χ2检验对CT-1虫株感染4种品系小鼠反应有无差异,χ2分割法对不同品系小鼠的两两检验。
2 结 果
2.1弓形虫基因分型 采用10个遗传位点,对本室分离的2株猫源弓形虫株进行基因分型,共揭示了1个基因型(ToxoDB#9, China 1)(表1)。基因型China 1型在SAG2、GRA6、L358、PKl、c22-8位点为基因II型;在SAG3、BTUB、c29-2位点为基因III型;在Apico位点为基因I型,图1。
2.2小鼠毒力 BALB/c、C57BL、KM 、ICR四个品系雌鼠各10只,经腹腔接种1×103个CT-1虫株速殖子。小鼠的生存时间和死亡率观察结果见图2。C57BL小鼠感染后第5天开始出现竖毛、腹水、抽搐等明显症状甚至死亡,第6 d完全死亡。BALB/c小鼠在第5、6、7这3 d之内全部死亡。KM 小鼠感染后6-7 d,活动减少,出现弓背、竖毛等症状,第10 d死亡2只小鼠,感染后第15 d至观察45 d结束,小鼠恢复正常活动,一直存活。ICR小鼠相对于BALB/c、C57BL小鼠症状轻微,在第10、14 d分别死亡了2只和1只小鼠,其余的在45 d内存活。存活的感染小鼠45 d后颈椎脱臼处死,脑组织压片发现有大量包囊形成。通过进行不同品系小鼠毒力对比,显示CT-1虫株感染C57BL、BALB/c、KM、ICR小鼠死亡率有统计学意义(P<0.01),C57BL、BALB/c小鼠两者之间及KM、ICR小鼠两者之间对虫株无统计学意义(P>0.01)。

表1 中国贵阳2株猫源性弓形虫虫株基因分型
Note:*unique RFLP genotypes
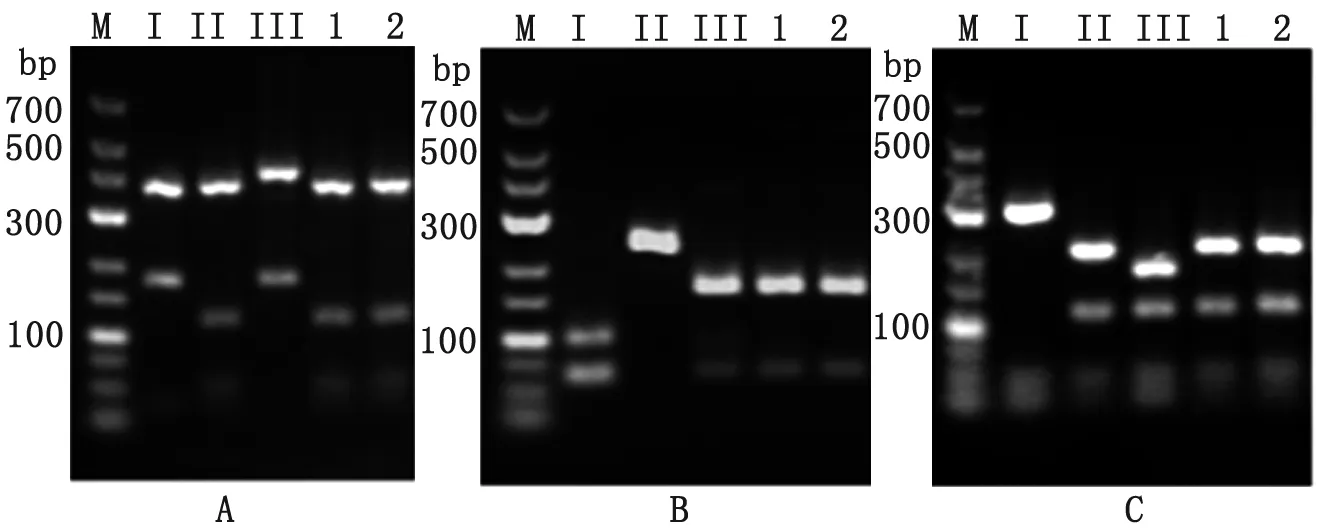
图1酶切电泳图
A:SAG2位点 B:SAG3位点 C:L358位点
Fig.1RestricteddigestionofPCRproductbyagarosegelelectrophoresis
A: SAG2; B: SAG3; C: L358; M: 700 bp marker;
I, II and III: GT1, PTG, and CTG; 1 and 2: CT-1 and CT-2.

图2 弓形虫CT-1虫株感染不同品系小鼠的毒力
3 讨 论
最近的研究显示,流行中国的动物源性弓形虫分离株具有有限的遗传多样性,且China 1型(ToxoDB#9)为其优势基因型[1,9-11]。China 1基因型在SAG2、GRA6、L358、PK1、c22-8位点为基因II型,在c29-2、SAG3及BTUB位点为基因III型,在Apico位点为基因I型。Dubey等[13]首先采用PCR-RFLP技术对分离自中国广东猫源弓形虫株进行基因分型研究,通过扩增10个遗传标记,将15个弓形虫株分为基因ToxoDB#9型。随后,又有很多应用PCR-RFLP方法对中国不同地域猫源性弓形虫株进行遗传特性研究。本实验室和其他学者[1,9,14]对从中国华东(山东,江苏,安徽)、华南(广东)、华中(湖北)和华北(北京、山西)地区分离的54株猫源性弓形虫株,在SAG1、SAG2、SAG3、BTUB、GRA6、c22-8、c29-2、L358、PK1和Apico等10个位点进行PCR-RFLP分析(见表2),并结合动物实验进行毒力鉴定,结果显示所有的分离株共包含4个基因型,分别为ToxoDB#9(China 1)型(41/54)、ToxoDB#10 (Type I)型(1/54),ToxoDB#3型(8/54), ToxoDB#205型(4/54)。因此,China 1基因型为中国猫源性弓形虫株优势基因型。基因型China 1亦在分离自中国不同地域的猪源及人源性弓形虫中亦有过报道[9-11]。 同时,China 1基因型在亚洲的越南、斯里兰卡,南美的巴西、哥伦比亚及北美的鸡源,猫源和狗源弓形虫分离株中均有过报道,表明China 1基因型为中国优势基因型并在全球广泛分布[2]。本研究对贵州猫源性弓形虫株进行生物与遗传特性研究,运用PCR-RFLP技术对10个遗传位点进行扩增,结果发现均为China 1型,进一步验证了我国弓形虫株具有有限的遗传多态性。

表2 中国各地区报道的猫源性弓形虫基因型
猫科动物是弓形虫生活史中唯一的终宿主,可分泌对环境有抵抗力的卵囊,污染食物,饮水和土壤,增加包括人在内的绝大多数哺乳动物、家畜和家禽的感染,全国各地调查猫弓形虫感染率随着地域差异有所变化,中国兰州阳性率21.3%,广东为25.2%~79.4%,北京为14.1%~57.8%[15-16]。孕妇感染弓形虫可通过胎盘传播导致胎儿出现严重的感染甚至死亡,正常人感染弓形虫后通常形成无症状的隐性感染状态,当人免疫力降低时(如肿瘤患者、艾滋病及器官移植者)可引起严重的疾病甚至死亡。
弓形虫属仅有刚地弓形虫一种,但来自全球各地的分离株却具有丰富的遗传多样性,不同虫株基因有微小差异,对小鼠毒力却存在很大差异。不同基因型的弓形虫感染不同活化的巨噬细胞亚群,调节不同的信号通路。已经明确棒状体蛋白激酶ROP16和致密颗粒蛋白GRA15都是毒力决定因子。Ⅰ型和Ⅲ型弓形虫的ROP16能够组成性地磷酸化STAT6,使巨噬细胞极化为M2;而Ⅱ型弓形虫GRA15则活化NF-κb,诱导促炎症性的M1基因表达[20]。中国优势基因型(China 1型)弓形虫株不同虫株对小鼠的毒力不同。王林等用China 1 型弓形虫株腹腔感染SW小鼠,发现大部分虫株在1周内致死所有小鼠;但是TgCtwh6(China 1型)虫株感染小鼠只出现一过性的炎症反应,且感染3周后在存活小鼠脑内发现大量的包囊[9]。陈兆武等用14株虫株感染KM小鼠,提示为China 1型弓形虫株强度株,有趣的是已经证实为强毒株的TgCtys1, TgCtwh1 和 TgCtwh4感染小鼠可存活至45 d,同时脑组织中含有大量包囊[1]。钱伟锋等用同一基因型弓形虫株TgCatBj2不同剂量腹腔感染BALB/c小鼠,发现China 1型弓形虫株为中等毒力株[19]。据此推测,流行我国的优势基因型China 1型弓形虫株存在不同毒力株。目前为止,优势基因型China 1型弓形虫株感染不同品系小鼠的生存时间和死亡率鲜见报道,本文用CT-1虫株1 000个速殖子腹腔感染近交系小鼠(C57BL、BALB/c)和远交系小鼠(ICR、KM),观察感染小鼠的存活时间和死亡率。显示同一虫株的毒力随不同品系小鼠反应不同,死亡率差异明显,具有统计学意义(P<0.01)。近交系小鼠中C57BL、BALB/c小鼠分别在6、7 d内全部死亡,两者之间对虫株的反应无明显差异(P>0.01),与李亚飞等[20]的报道相似,说明近交系小鼠无胸腺,细胞免疫缺陷,对China 1型抵抗力低,是研究弓形虫急性感染的理想模型。远交系KM、ICR小鼠对CT-1虫株有更强的耐受性,存活率高,两者之间无明显差异,而且在脑组织中发现大量包囊,因此为研究弓形虫慢性感染的发病机制、生物学特征等相关研究提供了良好的感染动物模型。因此,用China 1基因型对不同品系小鼠的探求为后续研究提供了一个科学、适宜的小鼠感染模型。
总之,在中国西南地区弓形虫的基因分型及毒力研究丰富了我国弓形虫种群遗传学、流行病学研究的资料,为更好地理解弓形虫基因型相关的致病机制具有重要意义。
参考文献:
[1]Chen ZW, Gao JM, Huo XX, et al. Genotyping ofToxoplasmagondiiisolates from cats in different geographic regions of China[J]. Vet Parasitol, 2011, 183(1-2): 166-170. DOI: 10.1016/j.vetpar.2011.06.013
[2]Wang L, Shen JL. Research progress on genotype and genotype-associated pathogenesis ofToxoplasmagondii[J]. Chin J Parasitol Dis, 2013, 31(4): 319-324 . (in Chinese)
王林,沈继龙. 刚地弓形虫基因型和与基因型相关的致病机制研究进展[J] .中国寄生虫学与寄生虫病杂志, 2013,31(4) :319-324.
[3]Su C, Khan A, Zhou P, et al. Globally diverseToxoplasmagondiiisolates comprise six major clades originating from a small number of distinct ancestral lineages[J]. Proc Natl Acad Sci U S A, 2012, 109(15) : 5844-5849. DOI: 10.1073/pnas.1203190109
[4]Rajendran C, Su C, Dubey JP. Molecular genotyping ofToxoplasmagondiifrom Central and South America revealed high diversity within and between populations[J]. Infect Genet Evol, 2012, 12(2): 359-368. DOI: 10.1016/j.meegid.2011.12.010
[5]Ferreira IM, Vidal JE, de Mattos Cde C, et al.Toxoplasmagondiiisolates: multilocus RFLP-PCR genotyping from human patients in Sao Paulo State , Brazil identified distinct genotypes[J]. Exp Parasitol, 2011, 129(2): 190-195. DOI: 10.1016/j.exppara.2011.06.002
[6]Dubey JP, Velmurugan GV, Rajendran C, et al. Genetic characterisation ofToxoplasmagondiiin wildlife from North America revealed widespread and high prevalence of the fourth clonal type[J]. Int J Parasitol, 2011, 41(11): 1139-1147. DOI: 10.1016/j.ijpara.2011.06.005
[7]Pena HF, Gennari SM, Dubey JP, et al. Population structure and mouse-virulence ofToxoplasmagondiiin Brazil[J] . Int J Parasitol, 2008, 38(5): 561-569.
[8]Mercier A, Devillard S, Ngoubangoye B, et al. Additional haplogroups ofToxoplasmagondiiout of Africa: population structure and mouse-virulence of strains from Gabon[J]. PLoS Negl Trop Dis, 2010, 4(11): e876. DOI: 10.1371/journal.pntd.0000876
[9]Wang L, Chen H, Liu D, et al. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[J]. PLoS One, 2013, 8(1): 1-11. DOI: 10.1371/journal.pone.0053483
[10]Wang H, Wang T, Luo Q, et al. Prevalence and genotypes ofToxoplasmagondiiin pork from retail meat stores in Eastern China[J]. Int J Food Microbiol, 2012, 157(3): 393-397. DOI: 10.1016/j.ijfoodmicro.2012.06.011
[11]Jiang HH, Huang SY, Zhou DH, et al. Genetic characterization ofToxoplasmagondiifrom pigs from different localities in China by PCR-RFLP[J]. Parasit Vectors, 2013, 6: 227. DOI: 10.1186/1756-3305-6-227
[12]Dubey JP. Refinement of pepsin digestion method for isolation ofToxoplasmagondiifrom infected tissues[J]. Vet Parasitol, 1998, 74(1): 75-77.
[13]Dubey JP, Zhu XQ, Sundar N, et al. Genetic and biologic characterization ofToxoplasmagondiiisolates of cats from China[J]. Vet Parasitol, 2007, 145(3-4): 352-356.
[14]Zhou P, Zhang H, Lin RQ, et al. Genetic characterization ofToxoplasmagondiiisolates from China[J] . Parasitol Int, 2009, 58: 193-195. DOI: 10.1016/j.parint.2009.01.006
[15]Wu SM, Zhu XQ, Zhou DH, et al. Seroprevalence ofToxoplasmagondiiinfection in household and stray cats in Lanzhou, northwest China[J]. Parasit Vectors, 2011, 4: 214. DOI: 10.1186/1756-3305-4-214
[16]Liu Q, Cai J, Zhao Q, et al. Seroprevalence ofToxoplasmagondiiinfectionin yaks (Bos grunniens) in northwestern China[J] . Trop Anim Health Prod, 2011, 43(4): 741-743. DOI: 10.1007/s11250-010-9711-2
[17]Qian W, Wang H, Su C, et al. Isolation and characterization ofToxoplasmagondiistrains from stray cats revealed a single genotype in Beijing, China[J]. Vet Parasitol, 2012, 187(3-4): 408-413. DOI: 10.1016/j.vetpar.2012.01.026
[18]Wang YF , Wang H , Pan CW , et al. Model estabishment on mice infected withToxoplasmagondiicysts of PRU strain[J]. Chin J Zoonoses, 2010, 26(8): 769-771. (in Chinese)
王亚飞,王寒,潘长旺,等. PRU株弓形虫包囊感染小鼠模型的建立[J].中国人兽共患病学报, 2010 , 26(8) :769-771.

