小肠结肠炎耶尔森菌尿素酶基因多态性及尿素酶活性分析
王嘉正,梁俊容,邱海燕,段 然,肖玉春,王 鑫,景怀琦
小肠结肠炎耶尔森菌是一种革兰阴性的肠道病原菌,它通过粪口传播途径感染人体,除了能引起多种胃肠道疾病外,由其引发的反应性关节炎、结节性红斑、耶尔森菌肝炎等更是引起人们的广泛关注。小肠结肠炎耶尔森菌有六种生物型。其中,生物1A型为非致病性菌,2-5型为低致病菌,1B为高致病菌。在成为肠道病原菌之前,小肠结肠炎耶尔森菌需要先穿过胃部,定植并在肠粘膜内扩散,这就要求其具有一定的抗酸能力[1-2]。有数据表明尽管小肠结肠炎耶尔森菌的最适pH生长范围是7.0至8.0,但它在pH值5.0至9.0的范围内都能生存[3-4]甚至在pH4.4的情况下仍然能够存活48 h[5]。尽管现在还无法确切的知道小肠结肠炎耶尔森菌的耐酸机制,但我们猜想尿素酶在这其中可能发挥着重要作用[3]。
小肠结肠炎耶尔森菌的尿素酶基因是由7个开放读码框(ureA, B, C, E, F, G and D)构成[6]。其中ureA、ureB、ureC是结构基因,ureE、ureF、ureG、ureD是附加基因,它们编码的蛋白共同组成一个完整的尿素酶分子。尿素酶可以水解尿素产生氨气和碳酸,氨气中和了H+,溶液的pH值随之提高,从而使细菌获得耐酸能力。既然尿素酶能够增加小肠结肠炎耶尔森菌抵御胃酸的能力而使其成为肠道病原菌,那么小肠结肠炎耶尔森菌致病力的强弱与尿素酶的活性之间是否具有一定关联?为了弄清这个问题,本研究选取不同致病力的小肠结肠炎耶尔森菌,通过PCR扩增和测序进行尿素酶基因的多态性分析,同时测定尿素酶活力以了解不同致病力菌株尿素酶活性之间的关联性。
1 材料与方法
1.1材料
1.1.1实验菌株 选取跨越25年,分离自福建、吉林、浙江等9个省的43株不同致病力的小肠结肠炎耶尔森菌及4株NCBI上尿素酶基因参考序列,见表1。

表1 43株小肠结肠炎耶尔森菌的生物血清型及4株尿素酶基因测序株的NCBI Reference Sequence或GenBank号
1.2方法
1.2.1核酸提取及PCR DNA提取和PCR扩增体系参照[7]。引物序列见表2、表3。
扩增条件(ureABCEFGD条件一样):94℃预变性5 min,94℃变性15 s,53.5℃退火30 s,72℃延伸30 s,共进行30个循环,最后72℃延伸10 min。
1.2.2DNA测序及结果分析 将PCR产物和相应的引物,送往北京擎科新业生物技术有限公司进行测序。
测序结果用DNAStar软件的SeqMan模块进行序列拼接和ORF的截取,并将每株菌尿素酶基因(ureABCEFGD)的7个ORF按顺序拼接在一起,再连同4株NCBI上尿素酶基因参考序列一起用MEGA软件进行比对和构建序列的聚类树。

表2 非致病性小肠结肠炎耶尔森菌尿素酶引物

表3 致病性小肠结肠炎耶尔森菌尿素酶引物
1.2.3尿素酶活性测试 选取8株不同致病力的小肠结肠炎耶尔森菌(生物血清型及致病力强弱见表4)。传菌并分别刮取适量菌苔制成菌悬液,麦氏比浊至浊度为1.2麦氏单位(当麦氏浊度为1.2时小肠结肠炎耶尔森菌的菌量约为108个/mL),倍比稀释将菌的浓度依次调整为108、107、106个/mL。取200 μL 102个/mL浓度的菌液涂平板(每个浓度涂3块平板)并进行菌落计数取平均值,以确定实际菌量。每株菌的三个浓度梯度分别取0.5 μL 菌液离心,弃上清,用0.5 μL 的尿素培养液重悬菌体后加入到4.5 μL 的尿素培养液中混匀,同时设置一个阴性对照(阴性对照加入5 μL 的尿素培养液,不加菌液)。放入25 ℃敷箱中培养,每隔一小时拍照并记录颜色变化,连续观察66 h。
2 结 果
2.1测序结果 在不同致病力小肠结肠炎耶尔森菌的比对和聚类分析结果中发现:
41株致病性小肠结肠炎耶尔森菌尿素酶基因的ORF序列可聚为3组,低致病性O∶3、O∶9血清型菌株、高致病性 O∶8血清型菌株各自聚为一组,而6株非致病性菌株的尿素酶ORF可聚为3组(聚类结果见图1)。
在低致病性小肠结肠炎耶尔森菌中,所有18株O∶3血清型菌株的尿素酶基因7个开放读码框(ureABCEFGD)的序列完全一致;17株O∶9血清型菌株中有16株尿素酶基因的七个开放读码框(ureABCEFGD)的序列完全一致,只有NX1997-IE419与其他O∶9血清型菌株的尿素酶基因序列不同,而NX1997-IE419与O∶3血清型菌株的序列非常接近。高致病菌与非致病菌的尿素酶基因序列相对不保守,除与低致病性菌株的尿素酶基因序列存在差异外,各菌株之间尿素酶基因也存在较大的多态性。
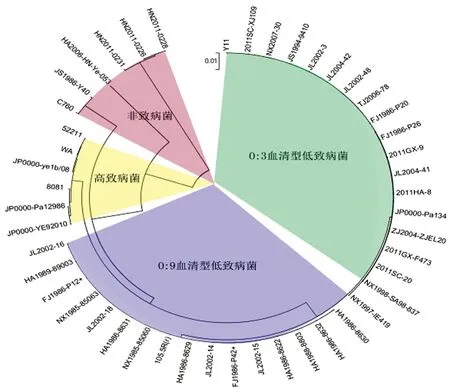
图147株小肠结肠炎耶尔森菌尿素酶基因的聚类分析
(红色为非致病菌,黄色为高致病菌,蓝色和绿色分别为O∶9血清型和O∶3血清型低致病菌)
Fig.1Cladogrambasedon43Yersiniaenterocoliticaureasegene
Red shadow represented non-pathogenic strain. Yellow shadow represented high pathogenic strain. Blue shadow represented O∶9 low pathogenic strain and green shadow represented O∶3 low pathogenic strain.
2.2菌落计数结果及菌的浓度 25 ℃隔夜培养后,进行菌落计数,并利用公式:浓度=(N1+N2+N3)/3×5×106推算出每株菌相应的浓度(见表4)。
2.3尿素酶活性测试结果 在尿素酶活性实验中我们发现:非致病株HA2006-HN-Ye-053的3个浓度梯度的反应,无论在变色的起始时间还是变色的终止时间上均早于其他的7株小肠结肠炎耶尔森菌(具体反应的变色起始时间和变色终止时间见表5)。高致病菌YE92010 108浓度梯度的反应于20 h开始变色,而此时非致病株HA2006-HN-Ye-053以及低致病株NX1998-SA98-837已发生了明显的颜色变化。在第27h,非致病株HA2006-HN-Ye-053 108浓度梯度的反应结束,早于其他致病菌。45h时,低致病株NX1998-SA98-837 108浓度梯度的反应也到达终点,早于高致病株52211和YE92010。66h时,高致病株52211 107和106浓度梯度的反应尚在进行中,但非致病株HA2006-HN-Ye-053以及低致病株NX1998-SA98-837、LN1996-YE105.5R三个浓度梯度的反应都已达到终点,见图2。
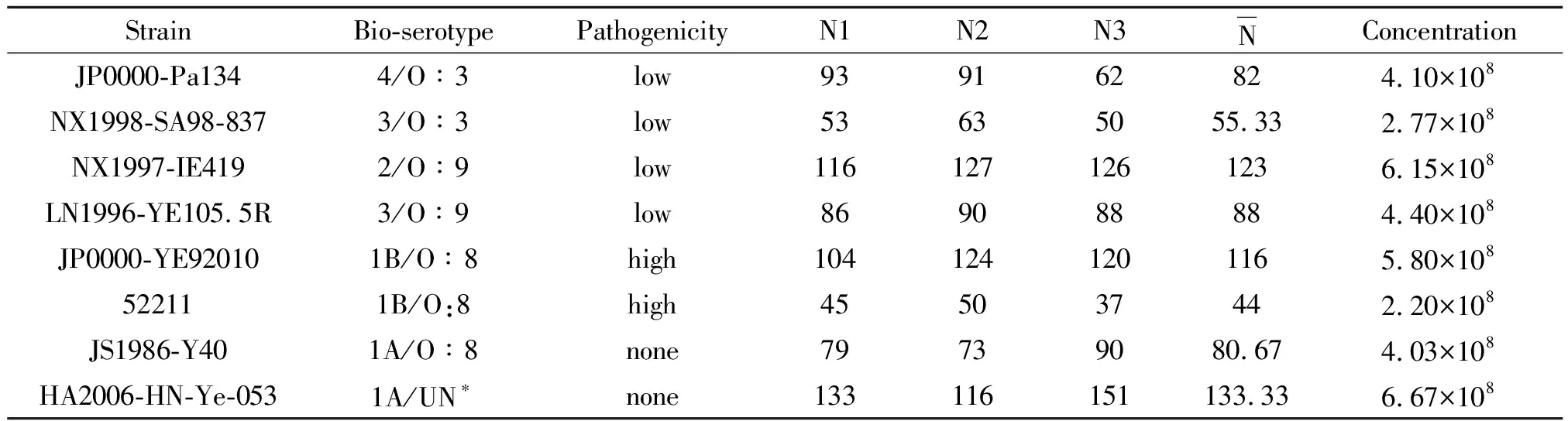
表4 尿素酶活力试验所选菌株及菌落计数结果和相应的浓度
注:由于生物1A型非致病性小肠结肠炎耶尔森菌血清型别众多,分型血清种类有限,且其与现有实验室分型血清均不凝集,无法确定其血清型,故为UN。
Note: Non-pathogenicYersiniaenterocolitica(biotype 1A) had many serotypes. However, serotyping kind was limited and some strain cannot agglutinate with serum in our laboratory. Because serotype can’t be determined, we defined them as UN.
3 讨 论
小肠结肠炎耶尔森菌是一种肠道病原菌,能引起包括:胃肠炎、肠系膜淋巴结炎、反应性关节炎和败血症在内的多种疾病[8-9]。尿素酶是一种含镍的蛋白酶,在诸如幽门螺杆菌、产气克雷伯菌、奇异变形杆菌以及小肠结肠炎耶尔森菌等细菌中都有尿素酶的存在[10]。它通过水解尿素产生氨气和碳酸,而氨气能够中和溶液中的H+,从而增强病原菌的耐酸能力,使病原菌在胃酸中有更强的生存能力[3]。尿素酶基因由多个ORF构成,它们功能相关前后连接成串形成一个尿素酶操纵子。尿素酶基因在细菌种内相对保守,而在不同的属间则可能存在一定的差异[11]。小肠结肠炎耶尔森菌的尿素酶基因是由7个开放读码框(ureA, B, C, E, F, G and D)构成[6],其中ureA、ureB、ureC是小肠结肠炎耶尔森菌尿素酶基因的结构基因,分别编码γ、β、α蛋白亚单位,γ、β、α蛋白亚单位共同构成尿素酶的核心部分,单独的核心部分是没有活性的。ureE、ureF、ureG、ureD是小肠结肠炎耶尔森菌尿素酶基因的附加基因,附加基因编码的蛋白能够使Ni离子与尿素酶核心部分结合,从而形成一个完整的有活性的尿素酶分子。
本实验中我们选取43株不同致病力的小肠结肠炎耶尔森菌进行尿素酶基因的测序和多态性分析。结果我们发现18株低致病性O∶3血清型菌株的尿素酶基因7个开放读码框(ureABCEFGD)的序列完全一致;17株低致病性O∶9血清型菌株中有16株的尿素酶基因7个开放读码框(ureABCEFGD)的序列完全一致,只有NX1997-IE419与其他O∶9血清型菌株的尿素酶基因序列不同。由此我们发现低致病性小肠结肠炎耶尔森菌的尿素酶基因序列比较保守并且与血清型密切相关,O∶9血清型(NX1997-IE419)菌株的尿素酶基因可能是起源于O∶3血清型的小肠结肠炎耶尔森菌。高致病性小肠结肠炎耶尔森菌和非致病性小肠结肠炎的尿素酶基因均呈现出不保守性,不仅与低致病性小肠结肠炎耶尔森菌存在很多个位点的突变,而且在所有高致病性小肠结肠炎耶尔森菌及非致病性小肠结肠炎耶尔森菌的开放读码框ureE中都会出现不同程度的碱基插入现象。在高致病株的小肠结肠炎耶尔森菌以及非致病性小肠结肠炎耶尔森菌各菌株之间也存在很多个位点的不同。
在尿素酶的活性测定实验中,我们可以看出在一定范围内,小肠结肠炎耶尔森菌菌量越多,尿素酶反应发生的时间越早,即尿素酶活性越大。非致病菌HA2006-HN-Ye-053的变色起始时间早于其他的7株小肠结肠炎耶尔森菌,且其到达尿素酶终止反应的时间也最早,显示其尿素酶活性很强。而高致病株YE92010的反应时间长于非致病株HA2006-HN-Ye-053以及低致病株NX1998-SA98-837。尿素酶是尿素分解的必要条件,虽然它在细菌体内合成,但它的活性表达除了与本身不同尿素酶基因编码的多亚基聚合体有关,还受到外界环境因素的影响。本研究中可以看出:小肠结肠炎耶尔森菌尿素酶的活性与其致病性之间并未呈现出一定的关联。这表明尿素酶虽然能够赋予小肠结肠炎耶尔森菌一定的耐酸能力并在一定程度上增加了肠道中小肠结肠炎耶尔森菌的数量,但是致病性强的小肠结肠炎耶尔森菌其尿素酶活性不一定强。这提示我们小肠结肠炎耶尔森菌致病力的强弱并不是由尿素酶直接决定的,决定致病力强弱的主要因素可能还是毒力质粒及侵袭素毒力基因等的有无和种类,尿素酶对于毒力强弱的贡献可能只是辅助性的。此外,相同基因型的Pa134和NX1998-SA98-837菌株之间的反应时间差距也很大。这提示我们一级结构虽然是尿素酶蛋白的功能的基础,但并不能直接决定尿素酶总活性的大小,尿素酶的总活性的大小可能还受其表达量、外界环境等诸多因素的影响,这些因素还需我们进一步探索。

表5 8株小肠结肠炎耶尔森菌的变色起始时间和终止时间(观察到66h)

图28株不同致病力小肠结肠炎耶尔森菌尿素酶反应的颜色变化
4张图片分别是20 h、27 h、45 h、66 h的颜色变化。每张图片A排1、2、3号和4、5、6号分别是52211 和JP0000-YE92010 108、107、106三个浓度梯度的反应情况。B排1、2、3和4、5、6号分别是NX1998-SA98-837和 JP0000-Pa134菌株3个浓度梯度的反应。C排1、2、3号和4、5、6号分别是NX1997-IE419和LN1996-YE105.5R菌株3个浓度梯度的反应。D排1、2、3号和4、5、6号分别是非致病菌HA2006-HN-Ye-053和JS1986-Y40 菌株3个浓度梯度的反应。每张图的7号一竖排是阴性对照。
Fig.2UreasereactioncolorchangeofeightdifferentpathogenicYersiniaenterocolitica
These 4 pictures represented color change of 20 h, 27 h, 45 h, and 66 h respectively;In each picture, number 1, 2, 3 and number 4, 5, 6 of rowA represented three concentration gradients (108,107,106) of 52 211 and JP0000-YE92010 respectively;
Number 1, 2, 3 and number 4, 5, 6 of rowB represented three concentration gradients of NX1998-SA98-837 and JP0000-Pa134 respectively;
Number 1, 2, 3 and number 4, 5, 6 of rowC represented three concentration gradients of NX1997-IE419 and LN1996-YE105.5R respectively;
Number 1, 2, 3 and number 4, 5, 6 of rowD represented three concentration gradients of HA2006-HN-Ye-053 and JS1986-Y40 respectively;
Number 7 of each picture is negative control.
参考文献:
[1]Giannella RA, Broitman SA, Zamcheck N, et al. Influence of gastric acidity on bacterial and parasitic enteric infections: a perspective[J]. Ann Intern Med, 1973, 78(2): 271-276. DOI: 10.7326/0003-4819-78-2-271
[2]De Koning-Ward TF, Robins-Browne RM. A novel mechanism of urease regulation inYersiniaenterocolitica[J]. FEMS Microbiol Lett, 1997, 147(2): 221-226. DOI: 10.1111/j.1574-6968.1997.tb10245.x
[3]De Koning-Ward TF, Robins-Browne RM. Contribution of urease to acid tolerance inYersiniaenterocolitica[J]. Infect Immun, 1995, 63(10): 3790-3795. DOI: 10.1111/j.1745-4565.2011.00325.x
[4]Hanna M, Stewart J, Carpenter Z, et al. Effect of heating, freezing, and pH [hydrogen-ion concentration]onYersiniaenterocolitica-like organisms from meat[J]. J Food Protect, 1977, 40(10): 689-692.
[5]Stern NJ, Pierson M, Kotula A. Effects of pH and sodium chloride onYersiniaenterocoliticagrowth at room and refrigeration temperatures[J]. J Food Sci, 1980, 45(1): 64-67. DOI: 10.1111/j.1365-2621.1980.tb03871.x
[6]De Koning-Ward TF, Ward AC, Robins-Browne RM. Characterisation of the urease-encoding gene complex ofYersiniaenterocolitica[J]. Gene, 1994, 145(1): 25-32. DOI: 10.1016/0378-1119(94)90318-2
[7]Gu WP. Comparative related-antigens and proteomic analysis of the pathogenicYersiniaenterocoliticabio-serotype 1B/O∶8 and 2/O∶9 cultured at different temperatures[D]. Beijing:Chinese Center for Infectious Disease Prevention and Control, 2011.(in Chinese)
古文鹏.致病性小肠结肠炎耶尔森菌生物血清型1B/O∶8和2/O∶9不同温度培养条件下相关抗原和蛋白质组学比较研究[D].中国疾病预防控制中心,2011.
[8]Cornelis G, Laroche Y, Balligand G, et al.Yersiniaenterocolitica, a primary model for bacterial invasiveness[J]. Rev Infect Dis, 1987, 9(1): 64-87. DOI: 10.1093/clinids/9.1.64
[9]Cover TL, Aber RC.Yersiniaenterocolitica[J]. N Engl J Med, 1989, 321(1): 16-24.
[10]Mobley H, Island MD, Hausinger RP. Molecular biology of microbial ureases[J]. Microbiol Revm, 1995, 59(3): 451-480.
[11]De Koning-Ward TF, Robins-Browne RM. Analysis of the urease gene complex of members of the genusYersinia[J]. Gene, 1996, 182(1): 225-228. DOI: 10.1016/S0378-1119(96)00556-2

