乳腺非肿块型强化病变性质的MRI分析
董晓燕,刘红霞,崔延安,周 静
美国放射学会2003年推出了MRI乳腺影像报告和数据系统(breast imaging reporting and data system magnetic resonance imaging, BI-RADS MRI),这个系统对一种比较特殊的强化方式——非肿块样强化(non-mass-like enhancenment,NMLE)作了较详细的描述[1],指在MRI图像上无占位效应的一类病变。由于NMLE病灶松散,病灶中间夹杂正常的纤维腺体和脂肪组织,多数病变经钼靶或超声检出的阳性率较低,是临床诊断工作的难点。乳腺MRI成像软组织分辨率高,不受乳腺致密度的影响,动态增强MRI通过血供特征显示非肿块样病灶具有较高的敏感度[2]。本研究通过回顾性分析经病理证实的非肿块样强化病灶患者的MRI影像资料,与病理进行对照,旨在提高乳腺非肿块样病灶的MRI诊断及鉴别诊断水平。
1 资料与方法
1.1 一般资料 收集2008年11月至2014年3月有病理结果的NMLE患者54例,年龄22~71岁,中位年龄43岁。纳入标准:(1)在MRI上由两位医师共同判断为NMLE患者;(2)非哺乳期、妊娠期及使用雌激素妇女;(3)未绝经妇女于月经后3~7天接受乳腺检查;(4)在手术或活检之前均行MR常规扫描、动态增强、扩散加权成像。
1.2 仪器与方法 MRI检查:采用德国西门子公司Avanto1.5T超导磁共振扫描仪,乳腺圆极化阵列线圈,8通道数据采集。患者取俯卧位,双乳自然悬垂于线圈洞穴内。MR平扫序列为快速自旋回波T1加权(T1WI:TR 775 ms, TE 12 ms,层厚4.0 mm,间隔1.0 mm)和T2加权(T2WI:TR 4 300 ms,TE 105 ms,层厚4.0 mm,间隔1.0 mm)成像;压脂像采用短恢复时间反转恢复(STIR:TR 9 410 ms,TE 76 ms,层厚4.0 mm,间隔1.0 mm)序列。MR动态增强扫描采用三维容积超快速多期动态序列(TR 4.42 ms,TE 1.63 ms,层厚1.2 mm,矩阵338×512),肘正中静脉团注对比剂马根维显(Gd-DTPA),剂量0.2 mmol/kg,流率2.0 ml/s,然后等量生理盐水冲刷。DWI采用自旋回波-回波平面成像(SE-EPI:TR 3 300 ms,TE 94 ms),扩散敏感系数(即b值)取1 000 s/mm2。
1.3 图像分析 MRI诊断参考医疗诊断报告,由两位5年以上经验的放射科医师达成一致意见,所有病灶均按照美国放射学会BI-RADS分级标准进行分级,BI-RADS 1~3级病灶划为良性,4~5级病灶划为恶性。回顾性分析术前MRI对非肿块样强化病变诊断的敏感度及特异度。
2 结果
2.1 病理结果 54例病理诊断良性35例,恶性19例。分别是浸润性导管癌11例,导管原位癌5例,浸润性小叶癌3例,乳腺腺病16例,导管内乳头状瘤2例,乳腺炎症15例,纤维腺瘤2例。
2.2 MRI表现及BI-RADS分级 平扫较小的NMLE病灶呈局灶性分布,形态特征不明确;较大的NMLE病灶呈区域性或节段性分布,T1WI呈等或稍低信号;T2WI压脂呈不均匀稍高信号,与正常的腺体信号较难分辨。在动态增强的MRI图像相,这些病灶显示突出。本组病例中,17例(31.5%)呈段样不均匀强化,11例(20.1%)呈区域性强化;7例导管样强化(12.9%)(图1),簇状(卵石样)强化8例(14.8%)、网状强化2例(3.7%),多发环样强化4例(7.4%),混合有肿块和非肿块样强化4例(7.4%)。恶性组病灶分布呈节段性和区域性的比例为47.3%(9/19);非恶性组1例导管内乳头状瘤病表现为卵石样强化,2例多发环形强化分别为肉芽肿性乳腺炎和浆细胞性乳腺炎(图2)。

图1 病例女性,69岁,右乳血性溢液,术前BI-RADS 4c级,病理:右侧乳腺导管原位癌。
DWI-ADC值不可测量的共19例;恶性病灶中ADC<1.3×10-3mm2/s的有16例,ADC>1.3×10-3mm2/s 2例;良性病灶中ADC<1.3×10-3mm2/s 5例,ADC>1.3×10-3mm2/s 12例。TIC曲线无法测得的共4例;恶性病变中Ⅰ型曲线2例,Ⅱ型曲线6例,Ⅲ型曲线13例;良性病变中Ⅰ型曲线11例,Ⅱ型曲线13例,Ⅲ型曲线5例。本组中,BI-RADS 4级占27.8%(15/54),5级22.2%(12/54),3级16.7%(9/54)。本组MRI诊断敏感度为90.7%,特异度为61.4%。
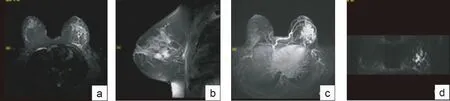
图2 病例女性,40岁,发现左乳肿块1个月,术前BI-RADS 4b,病理:左乳浆细胞性乳腺炎。a、b:分别为轴位和矢状位T2WI图像,显示左乳区域性分布稍高信号,病灶累及乳头及胸大肌,乳晕区皮肤增厚;c:增强扫描病灶不均匀强化,病变侧血管明显增粗;d:DWI 病灶呈高信号,中心ADC值低至1.0×10-3 mm2/s,病理证实病变中心为微脓肿形成。
3 讨论
非肿块样强化(NMLE)的乳腺恶性病变主要见于导管原位癌(ductal carcinoma in situ,DCIS)、浸润性小叶癌(invasive lobular carcinoma,ILC)和浸润性导管癌;良性病变见于乳腺腺病、腺瘤、导管内乳头状瘤、激素替代和炎症的改变。除部分DCIS和导管内乳头状瘤有乳头溢液外,其他病变临床表现均无特征,因此有效的鉴别NMLE良恶性将直接影响患者治疗方案的选择及预后。
MRI诊断分析指标包括病灶形态学特征、TIC(time-signal intensity curve)动态变化和DWI-ADC值。龚良庚等[3]认为平扫T1WI和T2WI的作用是判断病灶中是否伴有出血、囊变和坏死等病理改变,以及病变是否累及邻近组织,如皮肤、Cooper韧带、胸大肌及胸壁受累等。在MRI图像上,常规的T1WI和T2WI扫描时NMLE类病变显示不明确,可通过增强扫描后病变的强化特征来反映NMLE形态学变化[4]。非肿块样病变强化主要从分布形式、内部强化特征进行分析,而内部增强情况最有助于诊断[5-8]。顾雅佳等[5]利用生物医学数据挖掘技术,对非肿块样强化的各个分类征象在诊断与鉴别诊断的效能进行分析,认为丛状小环样强化、块状强化和不均匀强化更倾向恶性病变;而网状强化、点簇状强化和均匀强化则易出现在良性病变中。本组19例恶性病变中,15例表现为段样分布的不均匀强化和块状强化,2例表现为小环样强化,分别为导管原位癌及浸润性导管癌1级,明显低于Tozaki等[9]报道的丛状小环样强化出现在63%的恶性病灶中(其中DCIS占85.7%),主要原因为病例数较少和扫描方位的不同。本组病例中3例导管原位癌表现为不均匀段样强化,其中1例同时伴有导管扩张及乳头血性溢液,2例表现为分支导管样强化(如图1)。而2例导管内乳头状瘤表现为沿导管分布的小结节样强化伴导管扩张及乳头浆液性溢液。但浆细胞性乳腺炎(乳腺导管扩张症)亦可以表现为小叶节段分布或导管样分布,是导致形态学上诊断的原因。对于NMLE的观察还包括两侧乳腺强化是否对称,对称强化指乳腺镜面样强化,多提示良性,见于良性增生性改变和应用激素替代治疗的女性。
BI-RADS-MRI提出[1]分析病变的形态学表现和动态增强的血流动力学表现同等重要,通常对于病变的良恶性诊断,动态曲线可以提供决定性信息。但是在非肿块样强化中,乳腺良性病变与恶性病变动态增强参数之间无显著差异[10]。相对于肿块性乳腺癌,非肿块样乳腺癌更倾向DCIS或ILC,由于其少血供、多钙化特点和肿瘤组织弥漫浸润生长方式,非肿块样强化乳腺癌病变倾向增强后缓慢强化,流出亦缓慢。本组病例中的TIC以Ⅱ型和Ⅲ型为主,其中Ⅲ型曲线的恶性预测值为68.4%(13/19),有10例显示肿瘤血供增粗的血管影,也从另外一个方面证明肿瘤的血供增加。
非肿块样强化病灶在DWI上可呈局灶性或区域性、导管样、段样高信号,单纯的DWI图像对于非肿块样病变的鉴别诊断价值不大,选择较高的b值,亦可以提高病灶的检出率[11]。本组研究b值选取1 000 s/mm2,由于非肿块样病变松散,在测量时会不可避免的包含一部分的正常腺体组织,因此ADC域值选为1.30×10-3mm2/s,略高于肿块型病变ADC阈值1.2×10-3mm2/s。本组2例浸润性小叶癌,ADC值大于1.6×10-3mm,考虑与其特殊的病理学特征有关,ILC呈多中心多灶性生长,其肿瘤细胞呈经典的单一纵向排列,正常的小叶结构不被破坏。11例炎性病变中,5例由于大量炎性细胞增生,使弥散扩散受限,ADC小于1.30×10-3mm2/s,与恶性病变重叠,但病变表现为无边界、弥漫性分布,且有早期累及皮肤征象,有助于鉴别诊断(如图2)。
从本组资料来看,MRI对非肿块样强化病灶的敏感性及特异性较高,尤其对于小病灶、多灶性和多中心性病灶以及乳腺深部病灶方面占优势,MRI可以客观的评估病变的范围,值得在临床诊疗中推广。
参考文献:
[1] American College of Radiology.Breast imaging reporting and data system[M].4ed.Reston,VA:American College of Radiology,2003:1-114.
[2] Shao Z, Wang H, Li X, et al.Morphological distribution and internal enhancement architecture of contrast-enhanced magnetic resonance imaging in the diagnosis of non-mass-like breast lesions:a meta-analysis[J].Breast J,2013,19(3):259-268.
[3] 龚良庚,程流泉.乳腺非肿块性浸润性导管癌的MRI诊断[J].中国医学影像学杂志,2011,19(8):601-604.
[4] Yabuuchi H, Mastsuo Y, Kamiani T, et al.Non-mass-like enhancement on contrast-enhanced breast MR imaging: lesion characterization using combination of dynamic contrast-enhanced and diffusion-weighted MR images[J].Eur J Radiol,2010,75(1):e126-e132.
[5] 顾雅佳,肖勤,邱龙华,等.非肿块样乳腺病变的MRI诊断步骤分析[J].中国肿瘤影像学,2009,l(I):39-42.
[6] 谭红娜,苏懿,李瑞,等.数据挖掘技术判定MRI乳腺非肿块样强化病灶的初步研究[J].中华放射学杂志,2009,43(5): 455-459.
[7] Sakamoto N,Tozaki M,Higa K,et al.Categorzation of non-mass-like breast lesions detected by MRI[J].Breast Cancer, 2008,15(3):241-246.
[8] Newell D,Nie K,Chen JH,et al.Selection of diagnostic features on breast MRI to differentiate between malignant and benign lesions using computer-aided diagnosis: differences in lesions presenting as mass and non-mass-like enhancement[J].Eur Radiol,2010,20(4):771-781.
[9] Tozaki M,Igarashi T,Fukuda K.Breast MRI using the VIBE sequence:clustered ring enhancement in the differential diagnosis of lesions showing non-mass-like enhancement?[J].AJR,2006,187(2):313-321.
[10] Jansen SA, Fan X, Karczmar GS, et al.DCEMRI of breast lesions: is kinetic analysis equally effective for both mass and non-mass-like enhancement?[J].Med Phys,2008,35(7):3102-3109.
[11] Thomassin-Naggara I,De Bazelaire C,Chopier J,et al.Diffusion-weighted MR imaging of the breast:advantages and pitfalls[J].Eur J Radiol,2013,82(3):435-443.

