慢性心力衰竭患者合并肾功能异常的发生情况分析
牟丽娜 张俊岭
慢性心力衰竭(chronic heart failure,CHF)是威胁人类健康和生命的重要疾病,其发病率、病死率逐年升高。随着心功能的下降,全身各系统均会受到影响,近些年,人们对心功能不全合并肾功能不全患者进行了相关研究,对其相互影响的病理生理机制有了更加深刻的了解,故而提出了心肾综合征(cardiorenal syndrome,CRS)的概念[1]。心力衰竭患者肾小球滤过率(GFR)<60 ml·min-1·1.73 m-2者占 20% ~67%,CHF合并肾功能损害往往会加重患者病情,肾功能的进行性减退同时也与心功能不全本身的进展密切相关,因此,这种关联在CHF合并肾功能异常患者治疗及预后方面的指导作用显得尤为重要[2]。本文对308例慢性CHF患者的临床资料进行回顾性分析,旨在了解CHF患者肾功能异常的发生情况,探讨心功能变化对肾功能的影响及肾功能损害对心衰疾病进展的反映,从而为临床医疗工作提供参考和帮助。
1 资料与方法
1.1 一般资料 选择2011年1月至2014年3月在我院门诊及住院的患者308例为心衰组,其中男172例,女136例;年龄38~90岁,平均年龄(69.6±7.2)岁。按照美国纽约心脏病协会(NYHA)标准进行分级评定,其中 NYHAⅡ级72例,Ⅲ级110例,Ⅳ级126例。按照患者入院时 eGFR是否 <90 ml·min-1·1.73 m-2将心衰组分为单纯心衰组219例和CRS组89例。选择同一时期于我院门诊体检的心功能正常者125例为对照组,均左心室射血分数(LVEF)>50%。其中男66例,女59例;年龄37~86岁,平均年龄(67.8±6.9)岁。所有患者均排除急性心功能不全、重度肺动脉高压、肝功能异常(ALT>160 U/L或AST>160 U/L)、恶性肿瘤、颅脑病变、合并原发性肾脏疾病、认知功能障碍、其他疾病并发的肾功能不全者。
1.2 方法
1.2.1 临床资料收集:调阅所有研究对象的病历资料并进行整理记录,记录内容包括姓名、年龄、性别、吸烟史(每天吸烟包数×吸烟年数>5包×年)、基础心脏病、基础用药情况、既往史(高血压、糖尿病、慢性支气管炎、脑卒中以及外伤、手术等)、个人史、家族史、一般体格检查(身高、体重、心率、血压),并按体重(kg)/身高2(m2)计算体重指数(BMI)。
1.2.2 实验室测定:包括血常规、凝血功能、尿常规、肝、肾功能、电解质、血脂、血糖、心肌酶、肌钙蛋白、胱抑素等,采用免疫荧光法检测脑钠肽(brain natriuretic peptide,BNP),正常参考值68~112 pg/ml。以肾脏病膳食改良试验(MDRD)公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR),eGFR=175 × 血肌酐(SCr)-1.234×年龄 -0.179,若为女性则 ×0.79。
1.2.3 超声心动图检查:采用美国Acuson128XP/10型彩色多普勒超声诊断仪,探头频率为2.5 MHz。M超测量如下指标每搏输出量(SV)、左心室舒张末内径(LVEDD)、左心房内径(LAD)、LVEF、左心室后壁厚度(LVPW)、室间隔厚度(IVS)。
1.2.4 心、肾功能不全诊断标准:心功能不全遵循美国纽约心脏病协会(NYHA)标准分成Ⅱ~Ⅳ级。肾功能不全分4期:肾功能代偿期血清肌肝[Scr(133~177 μmol/L),肾 功 能 失 代 偿 期 (Scr178 ~422 μmol/L),肾功能衰竭期(Scr 423 ~707 μmol/L),尿毒症期(Scr>707 μmol/L)]。
1.3 统计学分析 应用SPSS 13.0统计软件,计量资料以表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 心衰组与对照组基础资料及相关指标比较 见表1。
表1 心衰组与对照组基础资料及相关指标比较±s

表1 心衰组与对照组基础资料及相关指标比较±s
注:与对照组比较,*P <0.05,#P <0.01
项目 心衰组(n=308) 对照组(n=125)年龄(岁)69.6 ±7.2 67.8 ±6.9男性[例(%)] 172(55.8) 66(52.8)身高(cm) 166.17 ±7.25 167.23 ±7.38体重(kg) 67.16 ±10.42 66.23 ±8.56吸烟史[例(%)] 105(34.1) 41(32.8)饮酒史[例(%)] 96(31.1) 38(30.4)高血压[例(%)] 120(38.9)# 37(29.6)糖尿病[例(%)] 82(26.6)* 23(18.4)心率(次/min) 84.76 ±10.73# 68.65 ±7.23收缩压(mm Hg) 119.34 ±17.49* 115.38 ±12.56舒张压(mm Hg) 78.47 ±10.36* 75.63 ±8.42 Scr(μmol/L) 135.2 ±33.8# 83.6 ±11.7 BUN(mmol/L) 11.3 ±4.2# 6.4 ±2.1 UA(μmol/L) 368.5 ±58.2# 316.5 ±62.4 GFR(ml·min -1·1.73 m -2) 75.3 ±29.6# 91.7 ±23.5 LVEDD(mm) 50.8 ±8.6# 45.7 ±3.2 LVEF(%) 36.9 ±5.8# 61.3 ±7.2 LAD(mm) 43.63 ±7.48# 33.58 ±3.96 IVS(mm) 9.2 ±2.8* 8.4 ±1.7 LVPW(mm)9.45 ±0.63 9.15 ±0.87
2.2 单纯心衰组与CRS组比较 2组患者基础资料比较,差异无统计学意义(P>0.05),具有可比性。CRS组患者 Scr、BUN、UA、GFR、Nt-proBNP 水平均高于单纯心衰组,差异有统计学意义(P<0.05)。超声心动图 CRS组较单纯心衰组LVEF值明显降低,LVEDD值明显增加,SV值明显减低,差异有统计学意义(P<0.05),2 组 LAD、IVS、LVPW 值无明显变化(P>0.05)。见表2、3。
表2 2组治疗前后肾功能指标及BNP比较±s

表2 2组治疗前后肾功能指标及BNP比较±s
注:与单纯心衰组比较,*P <0.05
ScrBUNUAGFR(ml·min -1Nt-proBNP组别 (μmol/L)(mmol/L)(μmol/L)·1.73 m -2)(pg/ml)单纯心衰组(n=219)106.2 ±29.7 7.0 ±2.3 342.5 ±64.6 102.3 ±10.3 868.5 ±121.2 CRS 组(n=189) 221.5 ±28.6* 12.3 ±4.2* 376.8 ±59.3* 75.3 ±27.5* 1 328.7 ±94.6*
表3 2组治疗前后超声心动图指标比较±s

表3 2组治疗前后超声心动图指标比较±s
注:与单纯心衰组比较,*P <0.05
组别 LVEDD(mm) LVEF(%) LAD(mm) IVS(mm) LVPW(mm) SV(ml)单纯心衰组(n=219) 46.5 ±7.8 39.8 ±5.5 42.54 ±6.34 9.4 ±2.9 9.31 ±0.57 56.2 ±8.47 CRS 组(n=89) 52.8 ±8.6* 33.2 ±5.9* 43.63 ±7.48 9.2 ±2.8 9.45 ±0.63 45.3 ±7.63*
2.3 CHF原发心血管疾病构成及合并肾功能异常
所有心衰患者中冠心病106例(34.4%),高血压98例(31.8%),心肌病 52例(16.9%)瓣膜疾病 30例(9.7%),慢性心律失常22 例(7.2%)。见表4。

表4 心衰组不同原发病合并肾功能异常者比较 例(%)
2.4 参照 2002年 K/DOQI指南以 eGFR<90 ml·min-1·1.73 m-2为肾功能异常。CHF 患者肾功能异常者比例为28.9%(89/308),其中男49例(55.1%),女40 例(44.9%);平均年龄 71.8(65.4 ±8.2)岁,较对照组肾功能异常者的比例12.8%(16/125)显著增高,差异有统计学意义(P<0.05)。89例心肾综合征患者中,NYHAⅡ~Ⅳ级的患者分别为15例(16.8%),28 例(31.5%),46 例(51.7%)。随着心功能的减退,肾功能异常发生率明显上升。见图1。
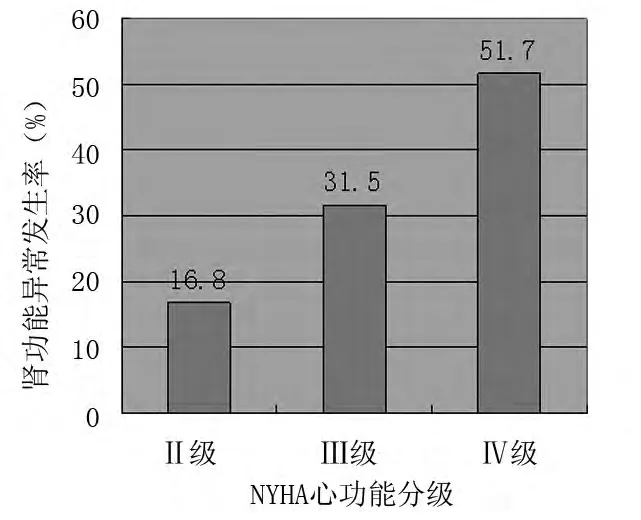
图1 不同心功能分级肾功能异常发生率比较
2.5 心衰组按照NYHA分级标准,其中NYHAⅡ级72例,Ⅲ级110例,Ⅳ级126例。CRS组肾功能不全分期多为肾功能代偿期和失代偿期,其次为肾功能衰竭期,发生尿毒症的机率最小。NYHAⅣ级组伴发肾功能不全的比例明显高于NYHAⅡ、Ⅲ级组,差异有统计学意义(P<0.05),而Ⅱ、Ⅲ级组之间差异无统计学意义(P>0.05)。见表5。
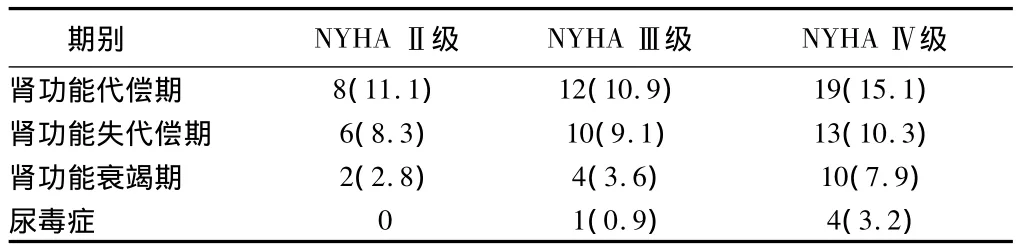
表5 NYHA分级合并肾功能异常者比较 例(%)
3 讨论
近年来,国内外学者对心血管疾病、肾脏疾病的产生和发展进行了深入研究,尤其对心肾疾病合并发生情况研究愈加重视。CHF的发生率逐年上升,其并发症也日渐增多,其中肾功能不全最为常见[3]。CRS是指,由于慢性心功能不全导致肾功能恶化,进而造成过重的容量负荷,最终导致CHF的进一步加重,这期间往往并发利尿剂抵抗[4],通常认为CRS是CHF发展到终末期的一种表现。心脏与肾脏之间的功能障碍同时发生且相互影响,最终形成恶性循环,致使心血管及肾脏系统功能恶化[5]。心力衰竭时心输出量下降,器官得到的有效灌注减少,神经体液系统包括RAAS系统及交感神经系统等因而被激活,出现水钠潴留、加速心力衰竭的进展,同时血管收缩引起肾血管灌注压降低和肾血流量减少,这也是肾功能损害的主要原因,是心肾共损的重要危害机制。最近一系列的研究证实,充血性心衰与慢性肾脏病(CKD)互相影响,互为因果关系[6],所以,CRS被临床医师高度关注,成为心肾两科室共同面对的问题。目前大家较为认同的CRS分型是由Ronco等[7]提出的,它根据起病急缓和最早出现异常功能器官的不同,对CRS进行5种分型,对心肾之间的联系进行了更加详细地描述。其中2型CRS是指CHF导致的进展性肾功能不全。本文主要探讨2型CRS。
研究结果分析:本次研究调查发现,在我院心内科门诊及住院慢性心功能不全患者中2型CRS患病率较高,接近30%,明显高于国内外一般人群慢性肾脏病(chronic kidney diseases,CKD)的患病率[8,9]。另外,心肾疾病相关的传统危险因素也在CRS患者中较多存在。国外专家Mc Alicster等[10]研究发现,CRS患者多数集中在症状性心力衰竭、高龄人群和女性患者中,且这些患者还存有高血压等基础疾病。本研究结果表明,在年龄、性别等指标无统计学差异的情况下,通过比较心衰组及心功能正常组,发现心衰组患者更容易出现肾功能异常的情况。心功能下降还有可能引起心排血量下降及静脉压增高,并对全身多个脏器造成影响,特别是出现肾脏灌注不足。本研究显示:与单纯心衰组比较,CRS患者除肾功能明显减退外,从超声心动态参数及BNP水平都反映心功能亦有显著下降。在CHF合并肾功能不全患者中,冠心病、心肌病、高血压、心脏瓣膜病、心律失常等是常见的原因。有实验证实,25%的CHF患者中合并肾功能障碍,CRS发病率高致使心血管事件的发生率增加,并且增加再住院率及病死率[11-13]。
本研究发现肾功能损害的发生和发展与心功能密切相关,心功能下降常引起肾功能损害进行性加重。通过对CRS患者不同心功能水平进行肾功能分期发现。心衰组发生肾功能异常多为肾功能代偿期和失代偿期,而发生肾功能重度异常者仅占少数。CRS患者不同心功能分级合并肾功能异常的程度有明显差别。这种情况可以证明,心衰与肾功能损伤之间联系紧密,如临床心衰症状越重,相伴随的肾功能损伤概率也就越大。金争鸣等[14]报道肾脏基础疾病的CHF患者,肾小球滤过功能显著下降,心力衰竭程度愈加严重,肾功能的损害也愈加明显。CRS多出现于顽固性、难治性心衰患者中,使临床治疗十分棘手[15]。CHARM研究证实不同心功能分级合并肾功能异常的比例不同,肾小球滤过率越低的患者心功能分级越差[16]。当SCr> 84.05 μmol/L时或 eGFR < 84.845 ml·min-1·1.73 m-2时,患者心衰症状会比较严重,需要尽快尽早检查肾功能等相关指标,密切关注病情变化,以达到预防疾病进展的目的。相关报道表示,在慢性心力衰竭患者中,发现有60% ~80%肌酐水平接近正常[17],出现这种情况的原因可能是:肾小管分泌、肾外清除、年龄增加、肌肉消耗及营养不良等因素都可使肌酐产生减少,故即使肌酐指标提示正常,也应密切注意患者的病情变化。
机制探讨:CRS的发生是一个多因素共同作用的、复杂的病理生理现象。Guyton[18]模型之后,Bongartz[19]又提出了“心肾模型”概念,即通过 NO-ROS平衡以及交感神经、RAAS系统和炎性反应对心肾间的关系进行更加全面的分析。现在,CRS的产生机制还不是十分清楚,可能与下列原因有关:(1)CHF导致心排血量减少,使肾脏低灌注,处于长期缺血、低氧的状况,使肾单位出现进一步的凋亡和坏死。(2)随着年龄增加,肾脏的生理结构及功能会发生退化,其对CHF中有害因子的敏感性也因此增强。(3)对于CHF的常见基础性疾病,如糖尿病、高血压、动脉粥样硬化等情况也会造成肾脏结构和功能的异常。(4)慢性心衰中血流动力学异常可引起交感神经和肾素血管紧张素系统激活过度,缩血管物质产生增加,造成肾血管阻力增加,继而使肾脏血流量减少。(5)由于GFR的下降,导致血液中儿茶酚胺增多,进而损伤肾血管,同时,增多的血管紧张素Ⅱ,对肾细胞发生作用,因此造成肾小球硬化,导致肾脏缺血,使促红细胞生成素生成减少,引起贫血,贫血则又使CHF的心肾功能恶化。(6)CHF使静脉压力增大,致使出球小动脉收缩甚至栓塞,以上等均可造成肾小球囊内压力升高,引起肾脏发生增生性变化。(7)在治疗CHF过程中,过度降压可使肾脏灌注减少,继发 GFR下降,出现肌酐上升的现象[20]。
综上所述,心脏和肾脏之间存在着密切的关系,其相互作用的机制也十分复杂。对于CHF患者,肾功能损坏不能忽视。CRS通过心肾之间的相互相影响而逐步的发生发展。在具体的临床实践中,必须重视早期诊断,早期治疗原发病,主动、有效减少两脏器间的不利影响。在诊断方面,CHF患者的心功能分级、肾功能分期的评定及相关指标如BNP的检测可提供帮助,在治疗方面心衰控制不佳会导致肾功能以每月下降1 ml/min的速度快速减退,而肾功能的减退又会进一步加重心衰的进展,形成恶性循环,因此,同时积极纠正心衰和肾衰对改善患者预后有重要作用。本研究为一项单中心回顾性研究,结果还需更多前瞻性研究以证实。
1 Ronco C.Cardiorenal and renocardiac syndromes:clinical disorders in search of a systematic definition.Int J Artif Organs,2008,31:1-2.
2 Pimentaj M,Almeida R,Araujo JP,et al.Amino terminal B-type Natriuretic peptide,renal function,and prognosis in acute heart failure:A hospital cohort study.J Cardiac Fail,2007,13:275-280.
3 Liu PP.Cardiorenal syndrome in heart failure:a cardiologist’s perspective.Can J Cardial.2008,24:25B-29B.
4 Geisberg C,Butler J.Addressing the challenges of cardiorenal syndrome.Cleve Clin J Med,2006,73:485-491.
5 Shlipak MG.Phannacotherapy for heart failure in patients with renal insufficiency.Annintem Med,2003,138:917-923.
6 Silverberg D,Wexler D,Blum M,et al.The cardio renal anemia syndrome:correcting anemisin patients with resistant congestive heart failure can improve both thecardiac and renalfunction and reduce hospitalization.Clin Nephrol,2003,60(Suppl 1):S93-S102.
7 Ronco C,Haapio M,Housea A,et al.Cardiorenal syndrome.J Am Coll Cardiol,2008,52:1527-1539.
8 Xue JL,Ma JZ,Louis TA,et al.Forecast of the number of patients with end-stage renal disease in the United States to the year 2010.Am Soc Nephml,2001,12:2753-2758.
9 张路霞,左力,徐国宾,等.北京是石景山地区中老年人群中慢性肾脏病的流行病学研究.中华肾脏病杂志,2006,22:67-71.
10 Mc Alister FA,Ezekowitz J,Tonelli M,et al.Renal insumciency and heart failure:Prognostic and therapeutic implications from a prospective cohort study.Circulation,2004,1:1004-l009.
11 Hillege HL,Nitseh D,Pfeffer MA,et al.Renal function as a predictor of outcome in abroad spectrum of patients with heart failure.Circulation,2006,113:671-678.
12 Bhatia RS,Tu JV,Lee DS,et al.Outcome of heart failure with preserved ejection fraction in a population-based study.N Engl J Med,2006,355:260-269.
13 Mc culloush PA.Contrast induced acute kidney injury.J Am Coll Cardiol,2008,51:1419-1428.
14 金争鸣,胡晓晟,陈君柱,等.慢性心力衰竭患者早期肾损害的临床研究.中华内科杂志,2005,44:262-264.
15 Shtipak MG,Massie BM.The clinical challenge of cardiorenal syndrome.Circulation,2004,110:1514-1517.
16 Hans L,Hilleg E,Dorothea N,et al.Renal function as a predictor of outcome in abroad spectrum of patients with heart failure.Circulation,2006,113:671-678.
17 Scrutinio D,Passantino A,Laglola R,et al.Detectionand prognostic impact of renal dysfunction in patients with chronic heart failure and normal selum creatinine.Int J Cardiol,2009,.
18 Guyton AC.The surprising kidney-fluid mechanism for pressure control its infinite gain.Hypertension,1990,16:725-730.
19 Bongartz LG,Cramer MJ,Doevendans PA,et al.The severe cardiorenal syndrome:Guyton revisited’.Eur Heart J,2005,26:11-7.
20 RoncoC,House AA,Haapio M.Cardiorenal syndrome:refining the definition of a complex symbiosis gone wrong.Intensive Care Med,2008,34:957-962.

