环介导等温扩增技术(LAMP)检测棘球绦虫感染犬粪DNA的研究Ⅱ
陈 璐,吾拉木·马木提,张德亭,金一帮
棘球蚴病(Echinococcosis)又称包虫病(hydatid disease),是由棘球属(Echinococcus)绦虫的幼虫—棘球蚴(metacestode ofEchinococcusor hydatid cyst)寄生于偶蹄或啮齿类动物以及人体所致的一种严重危害人体健康和阻碍畜牧业发展的慢性人兽共患寄生虫病[1]。该病在我国主要是绵羊/犬动物循环,因此建立一种有效检测感染犬的方法,并结合进行彻底驱虫治疗,将切断棘球绦虫终末宿主向中间宿主的传播途径,成为防治包虫病的重要措施和有力手段。随着人们对于寄生虫病在分子生物领域的不断深入研究,一种全新的核酸扩增技术—环介导的等温扩增技术(Loop-mediated isothermal amplification,LAMP)越来越受到研究人员的亲睐。该方法是由日本学者Notomi 等[2]首先提出,其特点是针对靶基因的6个独立区域设计两对特异引物,在链置换 DNA 聚合酶(Bst DNA polymerase)的作用下,恒温水浴(60~65℃)30~60 min可将原有几个拷贝的靶核酸扩增到109水平[3]。
1 材 料
1.1仪器与试剂 PCR 扩增仪 (BIO-RAD) ;DYY-6D型电泳仪 (北京市六一仪器厂) ;凝胶成像仪 (Gel Doc 2000 BIO-RAD) ;DK-8D 电热恒温水槽 (上海精宏) ;Bst DNA Polymerase(Biolabs);Betaine(Sigma);氨苄青霉素(Sigma); MgSO4(Invitrogen);SYBR GreenI(Invitrogen);蛋白酶K(Merk);酚:氯仿:异丙醇(25∶24∶1);DNA Ladder;Taq plus DNA 聚合酶;dNTP 均购自大连宝生物公司,粪便提取试剂盒(QIAGEN)胶回收试剂盒(Bioteke);消化液(NaCl 100 mmol/L,EDTA 25 mmol/L,Tris-HCl 100 mmol/L pH=8.0,DNA沉降液NaCl 100 mmol/L,10% SDS)。
1.2菌种与质粒 pEASY-T1载体、E.coliDH5ɑ购自上海生工生物工程有限公司。
1.3寄生虫标本 多房棘球绦虫、细粒棘球绦虫、犬蛔虫、泡状带绦虫、肥胖带绦虫成虫,牛囊尾蚴均由新疆医科大学寄生虫教研室提供,均保存于液氮中。
1.4犬粪便标本 6份E.m实验感染阳性犬粪由青海省疾病控制中心采集提供;2份单纯犬弓首蛔虫感染剖检犬粪和4份单纯犬泡状带绦虫感染犬粪便样本采自四川省石渠县;11份剖检细粒棘球绦虫绦虫阳性犬粪标本采自新疆博尔塔拉蒙古自治州巴音布勒克加克查乡;8份人工感染细粒棘球绦虫犬粪和15份未感染健康犬粪取自实验室留样。
2 方 法
2.1寄生虫DNA模板的制备 按酚氯仿DNA经典提取法进行:①取100~300 mg -80℃冻存的细粒棘球绦虫成虫标本,于研钵中液氮研磨3~5次,待组织研碎呈粉末状,将粉末刮入1.5 mL离心管中称得净重0.3 g。②按1.2 mL/100 mg,加入1 200 μL消化液,蛋白酶K(20 mg/mL)加入30 mL,10%的SDS加10 μL,温和混匀,56 ℃恒温水浴消化过夜。③从水浴锅中取出过夜消化的标本,轻柔摇匀,加入等体积的蛋白抽提液:酚∶氯仿∶异戊醇=(24∶25∶1),放入匀浆器倾斜30°,15 r/min,混匀5 min,至两相混匀至乳液状。4 ℃离心,12 000 g×10 min,取上层水相于新的1.5 mL的离心管中。重复该步骤1次。④取上层水相,加入0.5倍体积的100 mol/L NaCl溶液和两倍体积的无水乙醇,室温下缓慢摇匀,-20 ℃冰箱,沉降1 h。4 ℃离心,12 000 g×5 min,小心弃去上清。⑤在沉淀内加入1 mL 70%乙醇,轻柔洗涤沉淀。5 000 g×5 min,4 ℃,小心弃去上清。⑥用干净滤纸小心吸去残留的乙醇,超净台晾干通风干燥5~10 min,待干燥,加入50 μL的TE液溶解。
2.2棘球绦虫ND2基因的克隆及标准管的建立 设计ND2基因(GenBank: AF297617.1,G1基因型)的上下游引物进行PCR扩增,上游引物TGTCTATATTTGTGTGCAGGT,下游引物TCTGTTAAATCAGAGACGACC,反应体系为20 μL,模板DNA 1.0 μL,上、下游引物(10 μmol/L)各0.5 μL,10×PCRmix Buffer 2.0 μL,ddH2O 13.5 mL,Taq酶0.5 μL反应条件为:①95 ℃ 5 min,②95 ℃ 30 s,③ 59 ℃ 30 s,④72 ℃ 30 s,⑤72 ℃ 6 min,⑥4 ℃∞。其中②~④步循环30次。扩增产物进行琼脂糖凝胶进行电泳,紫外灯下观察结果,将208 bp的目的扩增片段切胶回收后,与pEASY-T1载体连接,25 ℃反应10 min将连接产物转入E.coliDH5ɑ感受态细胞,接种于含50 μg/μL氨苄青霉素的LB平板,通过蓝白斑菌落筛选含目的基因的白色菌落,37 ℃培养过夜。送测序鉴定,作为LAMP反应灵敏性和特异性的标准阳性对照。
2.3犬粪DNA提取 将收集的犬粪在-80 ℃冻存1周灭活虫卵。粪便DNA的提取按照Qiagen mini stool kit试剂盒(德国)说明书进行。每次称取0.22 g粪便,同一标本不同部位取2份,同时提取DNA。获得的DNA立即进行PCR或储存于-20 ℃备用。
2.4检测棘球绦虫LAMP引物 针对细粒棘球绦虫mtDNA的ND2基因序列(登陆号:GenBank:AF297617.1)的六个位点设计引物以及针对,通过PrimerExplorer V4设计四条LAMP引物(序列见表1),其中包括2条外引物(F3、B3)和2条内引物分别为FIP和BIP。以上引物序列由北京英骏公司合成。运用DNAman设计酶切位点(见图1)。
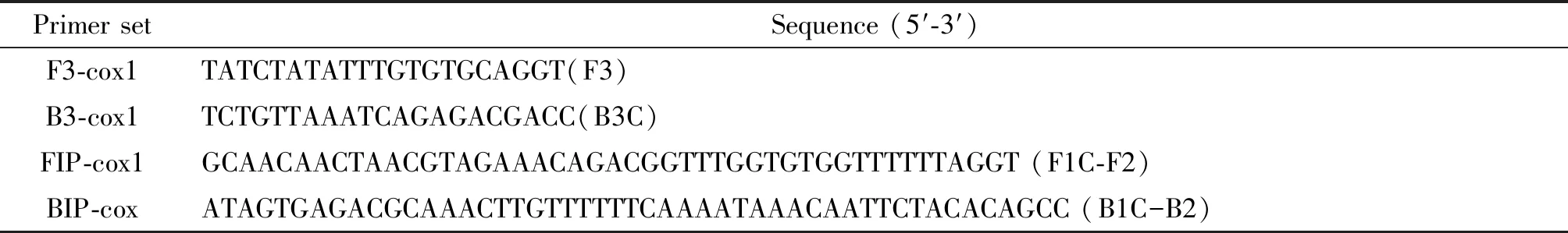
表1 细粒棘球绦虫 LAMP寡核苷酸引物序列

图1 细粒棘球绦虫线粒体ND2基因 (登录号:AF297617.1) 4条 LAMP 引物靶序列
Fig.1NucleotidesequencesoftargetsforprimersintheLAMPassayonEchinococcusgranulosus(E.g)
The sequences are AF297617.1 and MseI enzyme site.
2.5LAMP检测棘球绦虫 反应体系25 μL:模板DNA 1.0 μL,H2O 7.5 μL ,FIP、BIP(40 μmol/L)各1.0 μL,F3、B3(10 μmol/L)各0.5 μL,10×Bst DNA Polymerase Buffer 2.5 μL,dNTP Mixture(10 mmol/L) 3.5 μL,Betaine(5 mol/L)5.0 μL,MgSO4(50 mmol/L)1.5 μL,Bst DNA Polymerase (8 U/μL) 1.0 μL,ddH2O 6.5 μL,混匀后轻微离心,水箱 63 ℃孵育 60 min,80 ℃ 10 min灭活酶结束 LAMP 反应。
2.6LAMP扩增产物的检测
2.6.1加染料后检测 每25 μL体系的反应管加1000×SYBR Green I 1~2 μL,1~5 min观察结果,反应液变绿为阳性,保持橙色或棕色为阴性。
2.6.2电泳检测 2 μL扩增产物与0.4 μL上样缓冲液混匀后点样于含0.8 μg/mL 溴化乙锭的1.5~2 %琼脂糖凝胶中,70 V电泳约60 min,电泳图片显示LAMP特征性梯状条带,则结果为阳性;无任何条带则结果为阴性。
2.7棘球绦虫LAMP扩增产物的酶切鉴定 利用限制性内切酶进行LAMP扩增产物鉴定,选取MseI限制性内切酶,酶切位点见图1,20 μL酶切反应体系如下: 10.0 μL LAMP产物;4.8 μL ddH2O;2.0 μL MseI 10×buffer ;3.0 μL MseI(10 U/μL)。混匀后16 ℃ 过夜。MseI 酶切片段计算[2]。
2.8PCR检测棘球绦虫 利用F3和B3作为PCR扩增细粒棘球绦虫的上、下游引物,反应体系为25 μL,模板DNA 1.0 μL,F3、B3(10 μmol/L)各1.0 μL,10×PCRmix Buffer 12.5 μL,ddH2O 9. 5 μL。反应条件为:①95℃ 4 min,②95 ℃ 30 s,③ 59 ℃ 30 s,④ 72 ℃ 30 s,⑤ 72 ℃ 7 min,⑥4℃ ∞。其中②~④步循环35次。PCR扩增产物进行100 V 琼脂糖电泳30 min后观察有无预期大小的目的DNA片段208 bp。
2.9LAMP和PCR检测细粒棘球绦虫ND2基因标准重组质粒的特异性分析 将多房棘球绦虫、犬弓首蛔虫、泡状带绦虫、肥胖带绦虫成虫、牛囊尾蚴,作为对照组,利用上述LAMP和PCR反应体系同时检测对5种对照组寄生虫和细粒棘球绦虫提取的DNA进行特异性检测,并对扩增产物进行电泳分析。
2.10LAMP和PCR检测细粒棘球绦虫ND2基因标准重组质粒的敏感性分析 以细粒棘球绦虫线粒体基因ND2片段成功构建的标准质粒为检测对象,对其进行梯度稀释,用消毒灭菌的双蒸水做10倍梯度稀释,运用公式,进行计算DNA分子拷贝数分别为4×108(18.2 ng/μL),4×107(1.82 ng/μL),4×106(182 pg/μL),4×105(18.2 pg/μL),4×104(1.82 pg/μL),4×103(182 ag/μL),4×102(18.2 pg/μL),4×101(18.2 pg/μL),4×100(1.82 pg/μL),阴性对照。分别用PCR方法和LAMP法检测。
3 结 果
3.1灵敏度检测比较 经pEASY-T1/E.gND2基因片段灵敏度检测发现针对E.g线粒体ND2基因设计的LAMP引物最低检测下限是4×101copies(18.2 pg/μL),比普通PCR方法(上下游引物分别为F3-ND2、B3-ND2检测)高103倍,呈现出较好的敏感度。重复实验过程3遍,PCR方法和LAMP法检测结果稳定(见图2),加入SYBE Green I颜色鉴别结果与电泳结果相一致(见图3)

图2LAMP(左)扩增技术和普通PCR(右)方法敏感性分析比较
M:2000bpDNA分子标准品,1-9为细粒棘球绦虫ND2基因标准质粒梯度稀释浓度: 4×108(18.2 ng/μL), 4×107(1.82 ng/μL), 4×106(182 pg/μL), 4×105(18.2 pg/μL), 4×104(1.82 pg/μL), 4×103(182 ag/μL), 4×102(18.2 pg/μL), 4×101(18.2 pg/μL), 4×100(1.82 pg/μL), 10为阴性对照。
Fig.2ComparativeanalysisofsensitivityofLAMPassay(left)andconventionalPCR(right)
M: 2 000 bp DNA marker; 1-10:E.gmitochondrial standard recombinant plasmid 4×108(18.2 ng/μL), 4×107(1.82 ng/μL), 4×106(182 pg/μL), 4×105(18.2 pg/μL), 4×104(1.82 pg/μL), 4×103(182 ag/μL), 4×102(18.2 pg/μL), 4×101(18.2 pg/μL), 4×100(1.82 pg/μL), and negative control, respectively.

图3加入染料SYBRGreenILAMP扩增E.gND2标准重组质粒的敏感性分析
1-9为细粒棘球绦虫ND2基因标准质粒梯度稀释浓度: 4×108(18.2 ng/μL), 4×107(1.82 ng/μL), 4×106(182 pg/μL), 4×105(18.2 pg/μL), 4×104(1.82 pg/μL), 4×103(182 ag/μL), 4×102(18.2 pg/μL), 4×101(18.2 pg/μL), 4×100(1.82 pg/μL), 10为阴性对照。
Fig.3AnalysisofsensitivityofLAMPmethodwithE.gND2standardrecombinantplasmidvisualizationbyaddingSYBRGreenI
Lane 1-10:E.gND2 standard recombinant plasmid 4×108(18.2 ng/μL), 4×107(1.82 ng/μL), 4×106(182 pg/μL), 4×105(18.2 pg/μL), 4×104(1.82 pg/μL), 4×103(182 ag/μL), 4×102(18.2 pg/μL), 4×101(18.2 pg/μL), 4×100(1.82 pg/μL), and negative control, respectively.
3.2特异性检测比较
3.2.1E.g线粒体ND2基因片段重组质粒为标准阳性对照的特异性分析 以线粒体ND2基因重组质粒为标准阳性对照,将LAMP法与PCR法的特异性进行对比,与CO1基因不同[4],选取ND2基因的特异性LAMP引物除了能够区别棘球绦虫属与其它肠道寄生虫,检测结果发现该引物不与E.m发生交叉反应,针对E.g具有较好的特异性(见图4)。

图4LAMP(左)和PCR(右)扩增细粒棘球绦虫ND2基因的标准重组质粒的特异性分析
1:细粒棘球绦虫ND2基因片段重组质粒标准阳性对照;2-7:分别为多房棘球绦虫、犬弓首蛔虫、泡状带绦虫、肥胖带绦虫成虫、牛囊尾蚴、阴性对照。
Fig.4SpecificityofLAMPassayinND2E.gstandardplasmid
1:EchinococcusgranulosusDNA; 2:EchinococcusmultilocularisDNA; 3:ToxocaracanisDNA; 4:TaeniahydatigenaDNA; 5:BlisterstaeniaDNA; 6:TaeniasaginataDNA; 7: Negative control.
3.2.2ND2基因LAMP引物的酶切鉴定 利用限制性内切酶进行LAMP扩增产物鉴定,选取MseI限制性内切酶,酶切结果与理论计算一致(见图5)。

图5E.gND2基因片段标准重组质粒LAMP扩增产物MseI酶切片段凝胶电泳分析
M:1000 bp DNA分子量标准品 1:细粒棘球绦虫DNA LAMP 扩增产物;2:MseI酶切片段
Fig.5GelelectrophoresisanalysisofMseIrestrictionenzymedigestedfragmentsofLAMPproductofE.gND2genestandardrecombinantplasmid
M: 1 000 bp DNA marker; 1: LAMP products ofE.gDNA; 2: LAMP products after digestion with MseI (224 bp, 131 bp, 96bp).
3.3LAMP法ND2基因检测46例棘球绦虫感染犬粪DNA 样本结果 运用LAMP 法ND2基因引物检测46份样本(重复3次),结果见表2。
表2LAMP法ND2基因引物诊断效果评价
Tab.2TheLAMPmethodEvaluationofDiagnosisinND2gene

LAMPNecropsy+-Total+19120-02626Total192746
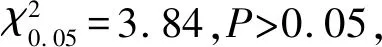
4 讨 论
鉴于LAMP技术引物设计的严格性,特异性引物的筛选,正确的引物设计是LAMP技术的关键。该技术在寄生虫病检测及相关领域的实际应用中表现出卓越的灵敏度和特异性[4-7]。本研究选取细粒棘球绦虫线粒体基因设计特异性LAMP引物,正确构建了标准重组质粒,并将LAMP引物在敏感性和特异性上进行了初步评估,针对不能将E.g、E.m两个相近种属进行鉴别这一情况[4],研究选取细粒棘球绦虫mtDNA ND2(E.gND2)基因设计LAMP引物,使用GenBank和BLAST软件进行分析筛选,将E.g,E.mND2基因序列同源性比对。结果同源性为84.13%,最后选定ND2基因种属差异较大区域设计特异性LAMP引物,进行灵敏度和特异度的检测评估,发现ND2基因LAMP引物进行检测的灵敏度为4×101DNA分子拷贝数,比普通PCR方法高出103倍 ,在特异性检测过程中LAMP法不仅区别出其他绦虫及常见的犬肠道寄生虫,还进一步鉴别了细粒棘球绦虫与多房棘球绦虫,检测结果比CO1基因LAMP引物更加特异[4]。最后将46份提取的犬粪DNA作为评估LAMP法的样本,研究证明该引物的LAMP检测结果与6例E.m粪便样本,2例犬弓首蛔虫样本,4例泡状带绦虫样本均不发生交叉反应,实验结果表明针对E.gND2设计的LAMP引物表现出较好的灵敏度和特异性,研究总体呈现出较好的检测结果。由于实验检测样本数量有限,尚需后续进一步的流行病学统计研究。
参考文献:
[1]Zhan XM, Human parasitology[M]. Beijing: People’s Medical Publishing House, 2001: 177-189. (in Chinese).
詹希美.人体寄生虫学[M]. 北京: 人民卫生出版社,2001:177-189.
[2]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28 (12): E63. DOI: 10.1093/nar/28.12.e63
[3]Nagamine K, Watanage K, Ohtsuka K, et al. Loop-mediated isothermal amplification reaction using a nondenaured template[J]. Clin Chem, 2001, 47: 1742-1743.
[4]Chen L, Mamuti W, Chen J, et al. Loop-mediated isothermal amplification for rapid detection of dogs infected withEchinococcusspecies on copro-DNAⅠ[J]. Chin J Zoonoses, 2011, 27(11): 1011-1015. (in Chinese).
陈璐, 吾拉木·马木提, 陈洁,等. 环介导等温扩增技术(LAMP)检测棘球绦虫感染犬粪DNA的研究[J]. 中国人兽共患病学报,2011,27(11): 1011-1015.
[5]Goto M, Honda E, Ogura A, et al. Colorimetric detection of loop mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. BioTechniques, 2009, 46: 167-172. DOI: 10.2144/000113072
[6]Nkouawa A, Sako Y, Nakao M. Loop-mediated isothermal amplification method for differentiation and rapid detection ofTaeniaspecies[J]. J Clin Microbiol, 2009, 47(1): 168-174. DOI:10.1128/JCM.01573-08
[7]Nkouawa A, Sako Y, Li TY. Evaluation of a loop-mediated isothermal amplification method using fecal specimens for differential detection ofTaeniaspecies from humans[J]. J Clin Microbio, 2009, 48(9): 3350-3352. DOI: 10.1128/JCM.00697-10

