HPLC法同时测定白喉乌头中高乌甲素、乌头碱、新乌头碱
王 伟, 赵翡翠, 陈 良, 聂继红*
(1. 新疆医科大学中医学院,新疆 乌鲁木齐 830054;2新疆医科大学附属中医医院药学部,新疆 乌鲁木齐 830000)
白喉乌头为毛茛科植物白喉乌头AconitumleucostomumWorosch的干燥根,主产于我国新疆地区,在治疗风湿类疾病方面有独特疗效[1]。据报道[2-3],白喉乌头中含有氢溴酸高乌甲素、喉乌碱及去乙酰刺乌头碱等,其中高乌甲素氢溴酸盐在我国作为非成瘾性镇痛药生产,而其在白喉乌头中含有量很高,约占总生物碱量的40%,但未见有采用HPLC法测定白喉乌头药材中氢溴酸高乌甲素量的相关报道,同时白喉乌头为乌头属植物,应含有乌头属植物常见的双酯型生物碱,其可能是白喉乌头中的药效成分和毒性成分[4],有必要对白喉乌头中生物碱成分和含有量进行研究分析。因此本实验采用高效液相色谱法(HPLC)同时测定白喉乌头中氢溴酸高乌甲素、乌头碱、新乌头碱,为白喉乌头植物资源的开发利用提供依据。
1 仪器与试药
1.1 仪器 Waters2695高效液相色谱仪(美国Waters公司),Direct-QTM5超纯水仪(Millipore公司),SK3300LH超声清洗器(上海科导超声仪器有限公司),SI-234电子天平(北京丹佛仪器有限公司),AG-135电子分析天平(上海梅特勒-托利多仪器有限公司),XBridge-C18色谱柱。
1.2 试药 白喉乌头样品(2013年采自新疆尼勒克地区,经新疆医科大学中医医院药学部李永和主任中药师鉴定为毛茛科植物白喉乌头AconitumleucostomumWorosch的干燥块根);高乌甲素对照品(北京世纪奥科生技术有限公司,批号97792-45-5);乌头碱对照品(中国科学院成都生物研究所,批号MUST-13012802);新乌头碱对照品(中国科学院成都生物研究所,批号MUST-13012207);氨水(分析纯);乙腈(色谱纯);无水乙醇(分析纯);盐酸(分析纯);三氯甲烷(分析纯)。
2 方法与结果
2.1 色谱条件 XBridgeTM-C18生物碱专用色谱柱(250 mm×4.6 mm,5 μm);填充剂为十八烷基硅烷键合硅胶;流动相为 乙腈(B)-0.05%冰醋酸(三乙胺调pH为7.25)(D)梯度洗脱(洗脱程序见表1);检测波长 235 nm;体积流量1.0 mL/min;柱温30 ℃;进样量10 μL。结果对照品和供试品色谱图呈现良好的分离度,见图1。
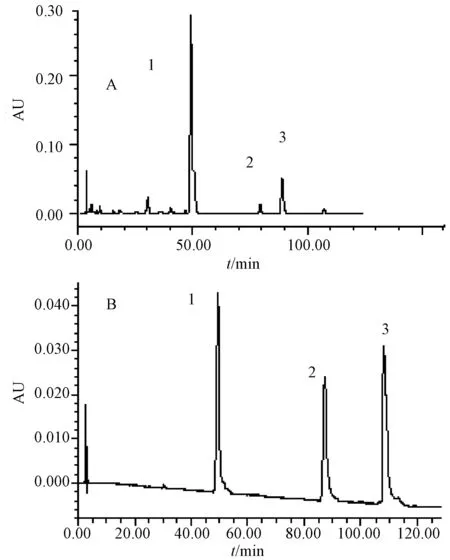
A.样品 B.对照品1.氢溴酸高乌甲素 2.新乌头碱 3.乌头碱A.sample B.reference substance;1.hydrobromide lappaconitine 2.mesaconitine 3.aconitine
2.2 对照品溶液的制备 分别取氢溴酸高乌甲素、乌头碱、新乌头碱适量对照品并精密称定,用色谱纯乙腈定容配制成质量浓度分别为4.075 mg/mL、2 mg/mL、2.05 mg/mL的混合对照品溶液,再依次梯度配制成6种不同质量浓度的混合对照品溶液备用(见表2)。
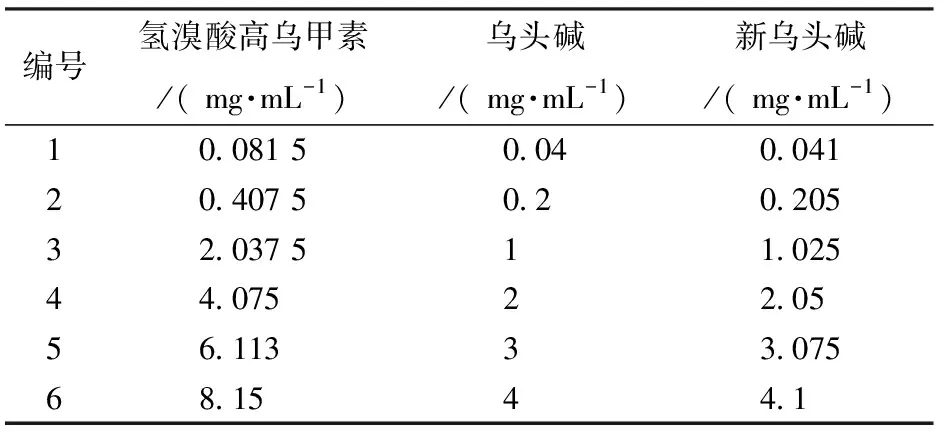
表2 混合对照品质量浓度
2.3 供试品溶液的制备 取白喉乌头样品粉末(过六号筛)约5 g并精密称定,加入氨试液5 mL密闭浸润后加入50 mL无水乙醇称定质量,超声(23 ℃,53 kHZ)提取20 min后再次称定质量并用无水乙醇补足,过滤,滤液60 ℃以下挥干;残渣加20 mL1%HCl调pH 2左右,再加入氨水调pH 11左右,然后用三氯甲烷萃取3次(每次10 mL),合并三氯甲烷层并60 ℃以下挥干,残渣加乙腈定容至5 mL量瓶,微孔滤膜滤过,取续滤液即得。
2.4 方法学考察
2.4.1 线性关系考察 取“2.2”项下不同质量浓度混合对照品溶液按“2.1”项下色谱条件分别进样,记录峰面积值,以质量浓度(mg/mL)为横坐标(x),峰面积为纵坐标(y)进行线性回归,得氢溴酸高乌甲素回归方程y=8 271 176.586 3x-91 106.980 7,相关系数r=0.999 2;乌头碱回归方程y=11 388 026.846 3x-409 124.842 3,相关系数r=0.999 1;新乌头碱回归方程y=12 205 378.669 9x-83 826.586 6,相关系数r=0.999 6。表明氢溴酸高乌甲素进样质量浓度在0.081 5~8.150 0 mg/mL、乌头碱进样质量浓度在0.040 0~4.000 0 mg/mL、新乌头碱进样质量浓度在0.041 0~4.100 0 mg/mL与峰面积呈良好的线性关系。
2.4.2 精密度试验 取混合对照品溶液按“2.1”项下色谱条件连续进样6次,计算3种化合物的含有量的RSD分别为2.24%、1.56%、2.25%,结果显示仪器精密度较高。
2.4.3 重复性试验 精密称取白喉乌头药材6份 按“2.3”项下制备供试品溶液,以“2.1”项下色谱条件进样,测定氢溴酸高乌甲素、乌头碱、新乌头碱的峰面积,计算氢溴酸高乌甲素的平均质量分数为2.753 5 mg/g, RSD为2.06%(n=6);乌头碱的平均质量分数为0.068 6 mg/g,RSD为1.16%(n=6); 新乌头碱的平均质量分数为0.371 3 mg/g,RSD为2.57%(n=6),结果表明本方法的重复性较好。
2.4.4 稳定性试验 取同一白喉乌头药材约5 g,精密称定,按“2.3”项下制成供试品溶液,按“2.1”项下色谱条件分别在0、4、8、14、20、24 h进样10 μL,记录色谱峰面积,计算氢溴酸高乌甲素、乌头碱、新乌头碱峰面积的RSD分别为 2.77%、1.61%、2.08%,结果表明供试品溶液在24 h内稳定性良好。
2.4.5 加样回收试验 取白喉乌头药材粉末约5 g精密称定,按“2.3”项下制成供试品溶液,分别加入3种不同质量浓度的氢溴酸高乌甲素、乌头碱、新乌头碱混合对照品,以“2.1”项下色谱条件进样测定.计算加样回收率,结果见表3~5。
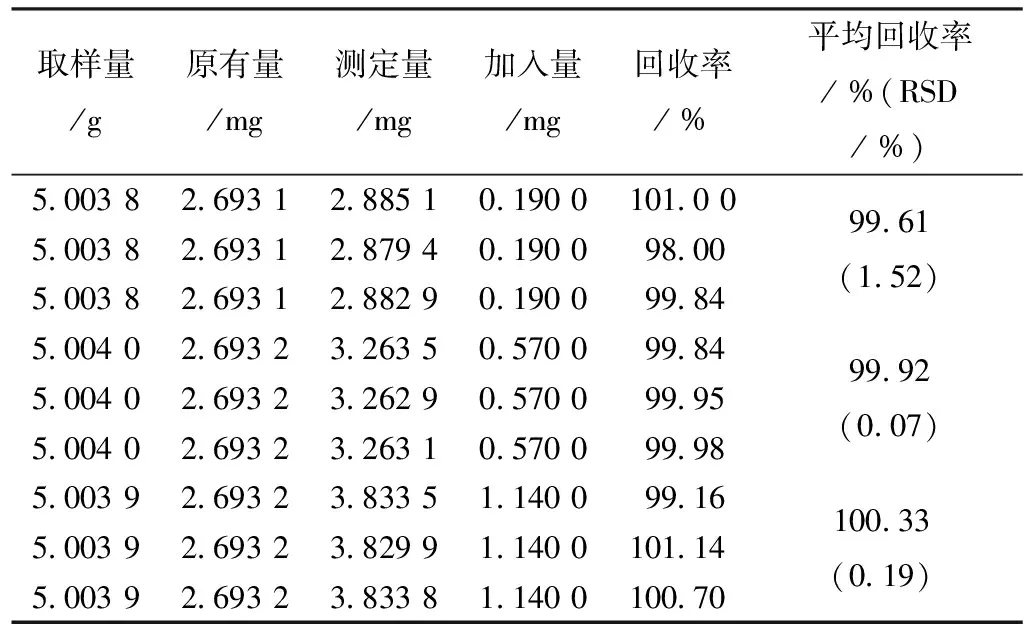
表3 氢溴酸高乌甲素加样回收率测定结果
2.4.6 样品测定 取白喉乌头药材3份(5.002 0 g、5.003 8 g、5.002 3 g),按“2.1”项下色谱条件平行测定3次,根据色谱峰面积计算出白喉乌头药材中氢溴酸高乌甲素、乌头碱、新乌头碱的量,结果见表6。
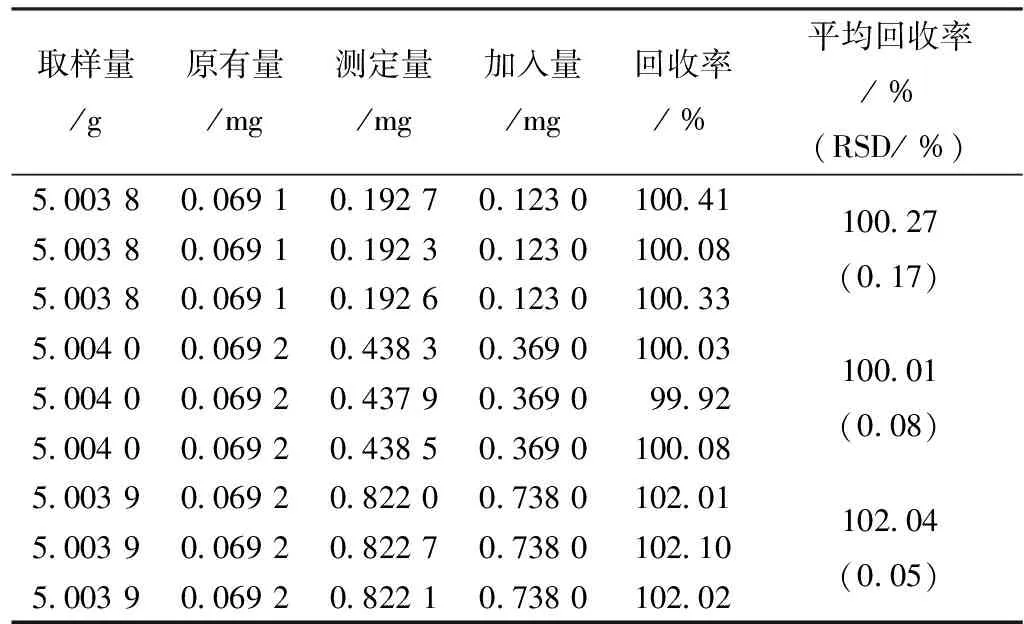
表4 乌头碱加样回收率测定结果
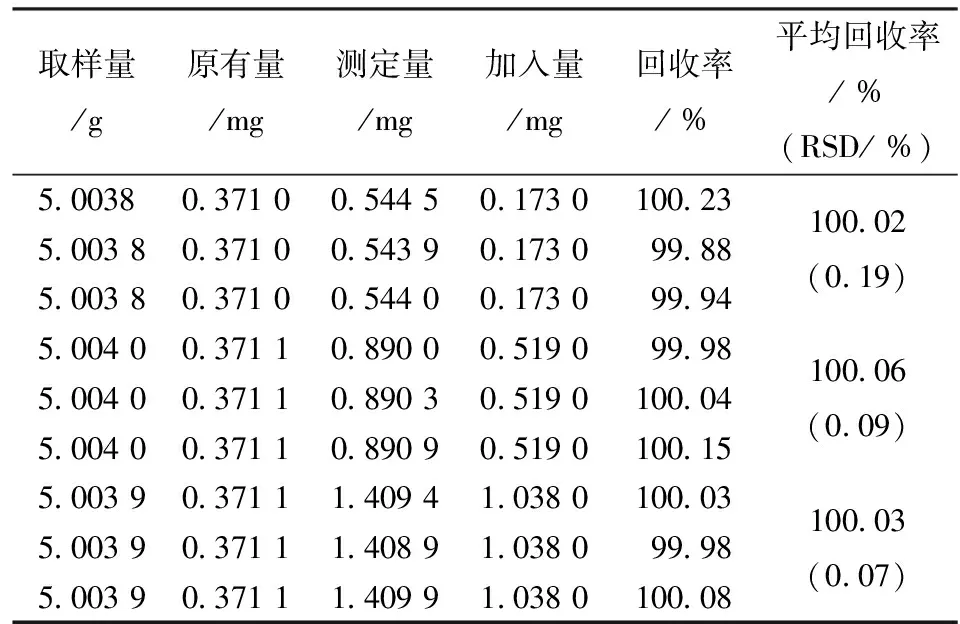
表5 新乌头碱加样回收率测定结果

表6 样品测定结果(n=3)
3 讨论
本研究采用高效液相色谱法梯度洗脱同时测定了白喉乌头中氢溴酸高乌甲素、乌头碱和新乌头碱的量,但氢溴酸高乌甲素作为一种二萜类生物碱非常不稳定,对光和高温都较敏感,本实验在供试品前处理过程中采取避光、60 ℃以下挥干等方法,防止其降解。
本实验在供试品前处理提取溶剂的选择过程中,参照文献[5-9]方法,分别筛选了甲醇、乙醇(75%,85%,95%,无水乙醇)、盐酸(1%,0.5%)、水、氨水乙醚液(75%,85%,95%)、氨水、三氯甲烷等不同溶剂,最后根据色谱图的分离度和峰形,最终选择无水乙醇作为提取溶剂;同时考察供试品的提取方式(索式提取、连续回流提取、超声提取等),最终选择超声提取20 min为供试品提取方法。
本实验采用二极管阵列检测器多波长扫描,当波长为235 nm时高乌甲素和乌头碱、新乌头碱均能被检出并且吸收较好,故确定其为检测波长;同时考虑到白喉乌头中活性成分的极性差异[10],因此针对梯度洗脱系统做了大量的考察和对比,包括甲醇-水,乙腈-水,甲醇-三氯甲烷-水,乙腈-乙酸氨等系统,经比较和分析不同洗脱系统下的色谱图分离度和峰形,表明乙腈-乙酸氨系统分离效果较好,故确定其为流动相体系进行梯度洗脱,并对流动相的比例做了大量工作,确定在流动相中加入二乙胺可以改善色谱峰拖尾现象[11]。
本实验中高效液相色谱图中各成分色谱峰清晰,分离度较好,稳定性和精密度等方法学考察均符合要求,表明采用高效液相色谱法梯度洗脱同时测定了白喉乌头中氢溴酸高乌甲素、乌头碱和新乌头碱的量,方法可行,操作简便,可用于白喉乌头中活性成分的测定和质量控制,也为白喉乌头的资源利用及质量标准制订奠定了基础。
参考文献:
[1] 中国科学院中国植物志编辑委员会.中国植物志:第二十七卷[M].北京:科学出版社,1979:171.
[2] 魏孝义,韦璧瑜,张 继.白喉乌头中的二萜生物碱成分[J].中草药,1995,26(7):345-346.
[3] 魏孝义,韦璧瑜,张 继.白喉乌头中的新二萜生物碱[J].植物学报,1996,38(12):995-997.
[4] 赵翡翠,李 杰. HPLC法测定新疆准噶尔乌头中双酯型生物碱[J].中成药, 2012,34(8):1552-1555.
[5] 随志刚,陈明玉,刘志强,等.草乌中乌头类生物碱提取方法比较研究[J].时珍国医国药,2009,20(3):513-514.
[6] 张德华,黄仁术,左 露,等.生物碱的提取方法研究进展[J].中国野生植物资源,2010,29(5):15-20.
[7] 黄志芳,易进海,陈东安.制川乌HPLC特征图谱研究和6种酯型生物碱的含量测定[J].药物分析杂志,2011,31(2):217-221.
[8] 付 玲,吴 超,赵翡翠. HPLC法测定新疆准噶尔乌头不同炮制品中单酯型生物碱的含量[J].新疆医科大学学报,2013,36(1):42-46.
[9] 朱日然,李启艳,朱宗敏,等.HPLC法测定附子及其炮制品中双酯型生物碱[J].中成药,2011,33(8):1375-1378.
[10] 匡学海,董晓萍,石任兵,等.中药化学:第十章[M].北京:中国中医药出版社,2002:322-328.
[11] 罗国安,梁琼麟,王义明,等.中药指纹图谱-质量评价口质量控制与新药研发 [M].北京:化学工业出版社,2009:25-35.