苛性碱溶液氧压浸出高砷锑烟尘
张旭,刘志宏,李玉虎,刘智勇,李启厚
(中南大学 冶金与环境学院,湖南 长沙,410083)
重有色冶炼是主要的砷污染源,我国每年由精矿带入冶炼厂的砷量高达数万吨[1-2]。砷及其化合物易于挥发,火法冶炼中富集于各类含砷烟尘中,如火法处理铜和铅阳极泥烟尘[3-4]、铜转炉烟灰[5-6]、高砷次氧化锌[7]等。实现砷与其他有价金属的高效分离,是处理各类含砷烟尘的必由途径,也是冶金技术亟待解决的难题。火法处理铅阳极泥产出的高砷锑烟尘,通常含砷15%~25%,锑40%~60%(质量分数),此外还含有一定量的铅和铋等,由于砷、锑同为VA 族元素,物理化学性质相似,而且其价态多,在烟尘中赋存物相及其嵌布状态复杂,处理这类烟尘时实现砷与锑等其他有价金属分离难度很大[8]。针对高砷锑烟尘的脱砷问题已有广泛的生产实践与研究。国内冶炼厂处理高砷锑烟尘的传统工艺为反射炉还原挥发,但由于砷、锑性质相似,挥发烟尘中仍含有20%左右的锑,且火法能耗高,存在含砷粉尘污染问题,该工艺将逐步被淘汰。因而,湿法脱砷技术是研究热点,如采用碱浸、酸浸工艺[4,6]等。段学臣[9]提出了低温氯化-蒸馏处理高砷锑烟尘的工艺,该方法利用AsCl3和SbCl3沸点不同蒸馏分离砷、锑,分离效果好,但氯盐体系对设备腐蚀严重,且AsCl3属易溶解、易挥发的剧毒物质,这些原因使其难以工业化应用。由于砷、锑氧化物均呈两性,因而简单碱浸或酸浸分离效果均不太理想。舒万艮等[10]研究了粗锑氧NaOH 溶液浸出脱砷制备醋酸锑的工艺,在90 ℃下,用9%(质量分数)的NaOH溶液浸出2.5 h,锑的浸出率小于1%,但砷的浸出率也不高,仅有74%左右。为提高砷的浸出率,周红华等[11-12]研究了Na2S 与NaOH 混合碱溶液浸出高砷锑烟尘-氧化分离砷、锑,在最佳条件下,砷的浸出率大于98%,且锑的回收率也可达到95%以上,但硫化剂、氧化剂等试剂消耗大,使得该工艺的经济性欠佳。樊立峰等[13-14]探讨了选择浸出处理砷锑烟尘的工艺,即首先采用碳酸钠焙烧-碱浸脱砷,然后采用硫化钠浸出回收锑,接着采用HCl-NaCl 浸出回收铅,再从浸出渣中回收锡。尽管该工艺基本实现了各主要有价金属的回收,但冗长的工艺路线使得处理成本较高,难以产业化应用。为此,本文作者对NaOH 溶液氧压浸出高砷锑烟尘进行实验研究,在碱性氧压条件下氧化As(Ⅲ)和Sb(Ⅲ),并利用As(Ⅴ)和Sb(Ⅴ)在碱性体系中溶解性的差别,使其分别进入溶液和渣中,完成砷、锑的高效分离,以期实现高砷锑烟尘的浸出、分离一步完成的短流程、高效率处理。
1 实验
1.1 实验原料
样品取自国内某铅冶炼厂的高砷锑烟尘,经研磨、烘干、混匀后作为实验原料,其化学成分和粒度分析结果分别如表1 和表2 所示,图1 所示为其XRD图谱。

表1 高砷锑烟尘主要化学成分(质量分数)Table 1 Main chemical composition of arsenic and antimony bearing flue dust %
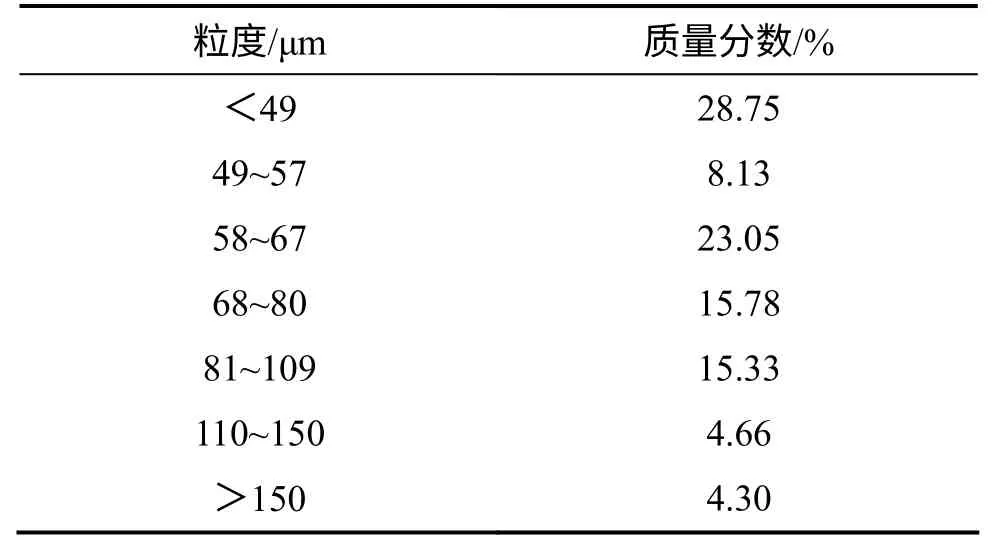
表2 高砷锑烟尘粒度分布Table 2 Particle size distribution of arsenic and antimony bearing flue dust

图1 高砷锑烟尘XRD 分析图谱Fig.1 XRD pattern of arsenic and antimony bearing flue dust
由表1 可知:实验所用高砷锑烟尘中As 和Sb 的质量分数分别为23.36%和22.70%。由图1 可知:烟尘中的As 和Sb 主要物相分别为As2O3和Sb2O3,而Sb 也有少量以 Sb2O5形态存在。由表2 可见:实验所用高砷锑烟尘粒度较细,粒径大于150 μm 的仅有4.30%,小于49 μm 的占28.75%。
实验所用试剂,如氢氧化钠、次亚磷酸钠、硫酸铈等,均为分析纯。水为去离子水。
1.2 浸出实验
浸出实验在1 L 机械搅拌钛制高压釜中进行。称取一定质量的高砷锑烟尘于高压釜内,按预定液固质量比往釜内加入设定浓度的氢氧化钠溶液,密闭高压釜,开启搅拌控制其速度在200 r/min,待釜内温度升至预定温度后,按实验要求的氧气分压通入O2,开始计算浸出时间。达到浸出时间后,关闭加热装置,往釜内冷却盘管中通入自来水冷却,待釜内压力降至常压后,开启高压釜,移出料液过滤洗涤。测量浸出液体积取样分析,浸出渣干燥后称重取样分析。
1.3 分析检测
采用次磷酸盐-碘量法[15]测定浸出液中的总砷含量;采用硫酸铈滴定法[15]测定浸出液中总锑含量;对于浸出液中低浓度的砷、铅、锑,采用美国热电公司IRIS Intrepid II XSP 型ICP-AES 分析其含量;采用Rigaku-TTRIII 型X 线衍射仪(Cu 靶,Kα,λ=0.154 06 nm)分析原料和浸出渣物相。浸出实验中,As,Sb 和Pb的浸出率按溶液分析结果计算。
2 实验结果与讨论
2.1 NaOH 质量浓度的影响
在O2分压2.0 MPa,温度140 ℃,浸出时间2 h,液固质量比10 的条件下,考察NaOH 质量浓度对高砷锑烟尘浸出的影响,砷、锑和铅浸出率随NaOH 质量浓度的变化关系及相应浸出渣的XRD 图谱分别如图2 和图3 所示。
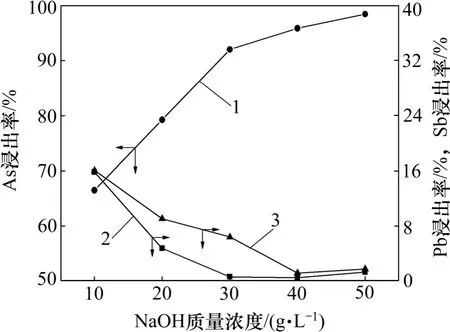
图2 NaOH 质量浓度对砷、锑和铅浸出率的影响Fig.2 Effects of NaOH concentrations on leaching rates of arsenic, antimony and lead
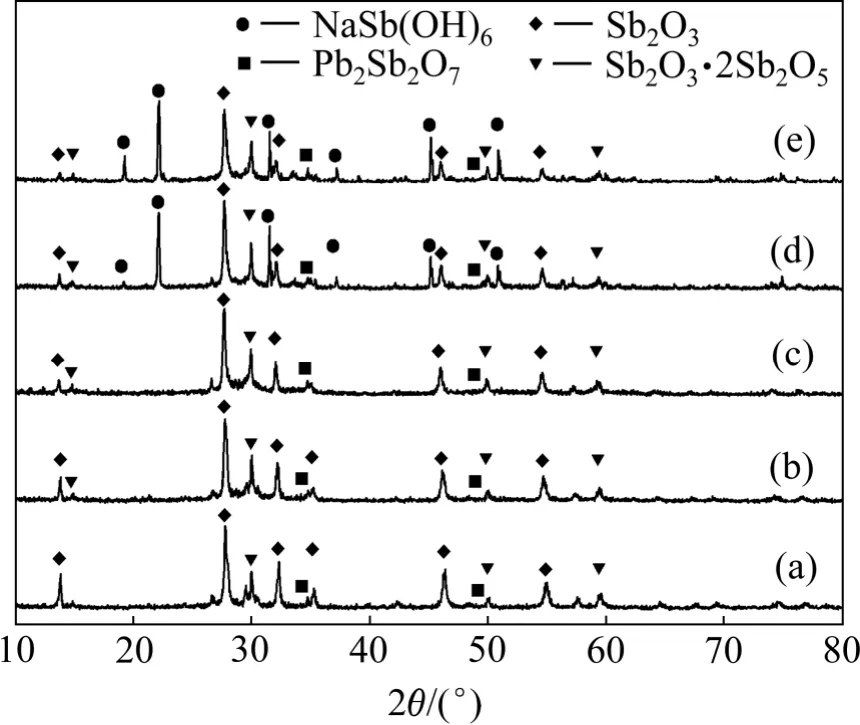
图3 不同NaOH 质量浓度下浸出渣的XRD 图谱Fig.3 XRD patterns of leach residues obtained at different NaOH concentrations
由图2 可见:随NaOH 质量浓度的增大,As 的浸出率提高,而与其相反,Sb 和Pb 浸出率则随之降低,但当NaOH 质量浓度大于40 g/L 后,其对各元素浸出率的影响趋于平缓。当NaOH 质量浓度由10 g/L 上升到40 g/L 时,砷的浸出率由66.51%提高至95.86%,铅、锑的浸出率分别由15.60%,15.85%降至0.11%,0.78%。原因在于:根据As-H2O 和Sb-H2O 系的φ-pH图,在高碱性条件下,As(Ⅲ)和Sb(Ⅲ)均易于被O2氧化为As(Ⅴ)和Sb(Ⅴ)[16-17];As(Ⅴ)在碱性体系具有较高的溶解度[18],而Sb(Ⅴ)则难溶于碱性溶液中[11-12]。图3 所示为浸出渣XRD 分析结果。由图3 可见:NaOH质量浓度较低时,浸出渣中Sb 主要为Sb2O3,随着NaOH 质量浓度提高,浸出渣中 Sb2O3·2Sb2O5和Pb2Sb2O7增多。当NaOH 质量浓度达到40 g/L,浸出渣的XRD 图谱中出现NaSb(OH)6的特征衍射峰,说明氧化生成的Sb(Ⅴ)大量以NaSb(OH)6沉淀。以上结果表明:在氧压浸出条件下,随着NaOH 质量浓度的增加,促进了物料中Sb(Ⅲ)氧化为Sb(Ⅴ),锑和铅以NaSb(OH)6,Pb2Sb2O7和Sb2O3·2Sb2O5等形态进入浸出渣中,实现As 与Sb 和Pb 的高效分离。
2.2 O2 分压的影响
在NaOH 质量浓度40 g/L,反应温度140 ℃,浸出时间2 h,液固质量比10 的条件下,考察O2分压对高砷锑烟尘浸出的影响。砷、锑和铅浸出率随O2分压的变化关系及相应浸出渣的XRD 图谱分别如图4 和图5 所示。
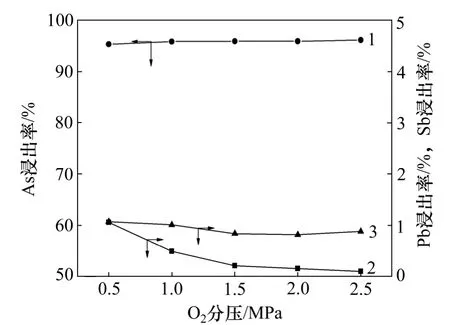
图4 O2 分压对砷、锑和铅浸出率的影响Fig.4 Effects of oxygen partial pressure on leaching rates of arsenic, antimony and lead
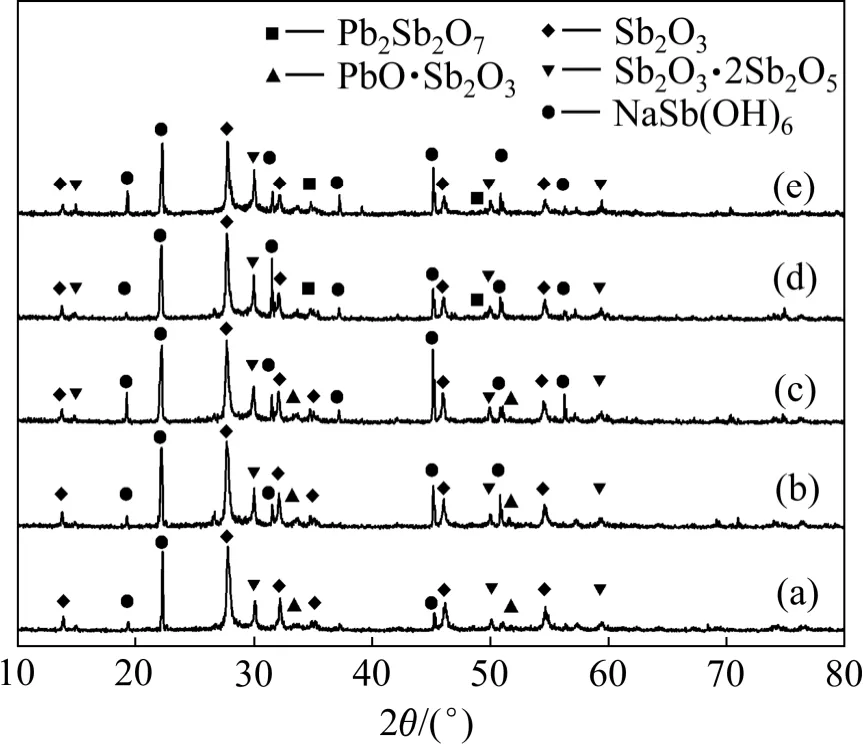
图5 不同O2 分压下浸出渣的XRD 图谱Fig.5 XRD patterns of leach residues obtained at different oxygen partial pressures
从图4 可知:当氧气分压从0.5 MPa 提高到2.5 MPa 时,As 和Sb 的浸出率基本不变,分别为95%和0.9%左右,而铅的浸出率随之逐步降低,由0.5 MPa时的1.02%降至2.5 MPa 时的0.05%。这表明As 和Sb氧化所需的氧气分压较低,在氧气分压为0.5 MPa 时,即可实现As(Ⅲ)和Sb(Ⅲ)分别向As(Ⅴ)和Sb(Ⅴ)的转化。由图5 可知:在氧气分压为0.5 MPa 时,浸出渣的XRD 图谱中已经出现NaSb(OH)6和Sb2O3·2Sb2O5的特征衍射峰,且随氧分压的增加,其衍射峰强度逐步提高,而Sb2O3的衍射峰不断减弱,这说明氧气分压越高,越有利于浸出渣中的Sb(Ⅲ)向Sb(Ⅴ)转变。当氧分压低于2.0 MPa 时,铅主要以PbO 形式与Sb2O3结合生成了PbO·Sb2O3沉淀,随着氧分压的增加,其进一步转化为Pb2Sb2O7。铅的沉淀形态随O2分压的改变,是铅浸出率随O2提高而稍有降低的原因。
2.3 浸出温度的影响
在NaOH 质量浓度40 g/L,氧气分压2.0 MPa,反应时间2 h,液固质量比10 的条件下,考察浸出温度对高砷锑烟尘浸出的影响。砷、锑和铅浸出率随温度的变化关系及相应浸出渣的XRD 图谱分别如图6和图7 所示。

图6 浸出温度对砷、锑和铅浸出率的影响Fig.6 Effects of leaching temperature on leaching rates of arsenic, antimony and lead

图7 不同浸出温度下浸出渣的XRD 图谱Fig.7 XRD patterns of leach residues obtained at different leaching temperatures
从图6可以看出,当温度从80 ℃上升到140 ℃时,As 的浸出率由89.05%上升到95.86%,而锑和铅的浸出率分别由1.19%和0.92%下降至0.78%和0.11%,进一步提高反应温度时,对砷、锑、铅的浸出率影响不大。由图7 可见,温度对浸出渣中Sb 的物相形态影响较大。80 ℃时,Sb 主要以Sb2O3和 NaSb(OH)6进入浸出渣;随着浸出温度的升高,Sb2O3和NaSb(OH)6的衍射峰逐步弱化,而Sb2O3·2Sb2O5的衍射特征峰显著增强;当浸出温度为170 ℃时,Sb2O3的衍射特征峰已基本消失,Sb 主要以NaSb(OH)6和Sb2O3·2Sb2O5形式存在;当浸出温度达到200 ℃时,浸出渣中Sb已完全转化为Sb2O3·2Sb2O5。另外,实验结果也表明:温度对Pb2Sb2O7的形成影响不大,但较高的温度有利于锑的氧化,由此促进铅的沉淀。
2.4 浸出时间的影响
在NaOH 质量浓度40 g/L,氧气分压2.0 MPa,浸出温度140 ℃,液固质量比10 的条件下,考察浸出时间对高砷锑烟尘浸出的影响。砷、锑和铅浸出率随浸出时间的变化关系及相应浸出渣的XRD 图谱分别如图8 和图9 所示。
从图8 可看出,浸出1 h 后,砷、锑、铅的浸出率可分别达到94.11%,1.27%和0.69%。随浸出时间的进一步增加,砷的浸出率稍有增加,而锑和铅的浸出率逐步降低。根据图1 可知,砷在高砷锑烟尘中主要以As2O3形式存在,因而对于高砷锑烟尘中的砷,在碱性溶液中会很快溶解。在高砷锑烟尘中,砷除了以As2O3形态存在外,还可能有少量难溶砷酸盐[11]。因此,当以As2O3形态存在的砷被浸出完全后,砷酸盐的溶解速度将直接决定砷的浸出效果。同样锑的浸出直接受其物相的影响,这点也可从图9 所示浸出渣的XRD 图谱中得到证实,浸出初始阶段,渣中锑主要以Sb2O3形式存在,其在碱性体系中溶解度较大,因此浸出率较高。随着浸出时间的延长,Sb(Ⅲ)被逐渐氧化为Sb(Ⅴ), 浸出渣中锑主要以NaSb(OH)6和Sb2O3·2Sb2O5形式存在,其在碱性溶液中溶解度较小,因而锑的浸出率随浸出时间延长而逐步降低。当浸出时间超过4 h 后,铅的浸出率会随时间的增加而再次升高,这可能是由于砷、锑的铅酸盐(AsxPbyOz,SbxPbyOz)被浸出后所造成。考虑到砷与锑和铅的分离效果及浸出效率,浸出时间以2 h 较为适宜。
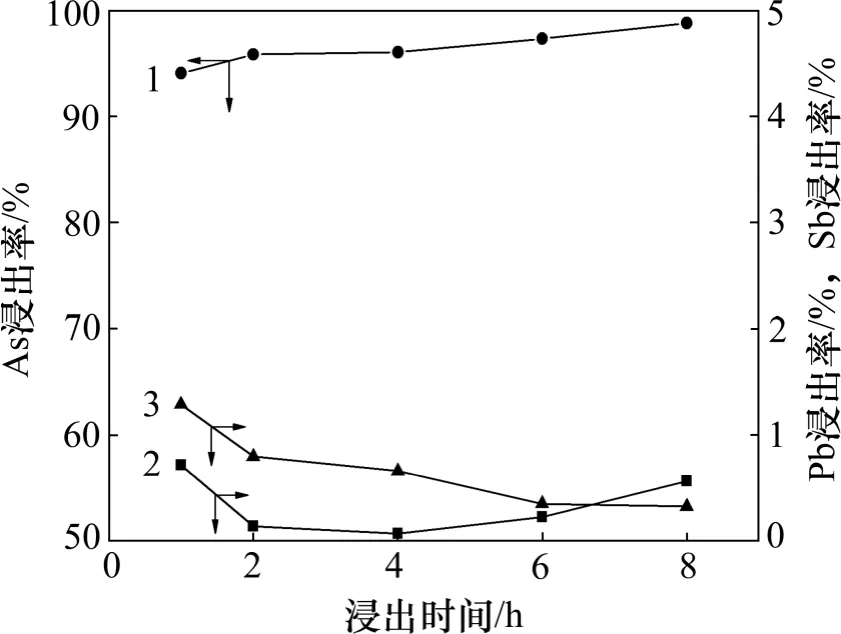
图8 浸出时间对砷、锑和铅浸出率的影响Fig.8 Effects of leaching time on leaching rates of arsenic,antimony and lead
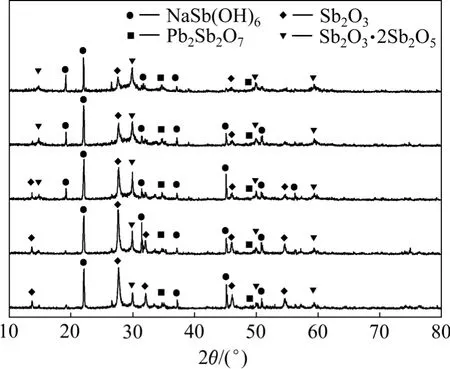
图9 不同浸出时间浸出渣的XRD 图谱Fig.9 XRD patterns of leach residues obtained at different leaching times
2.5 液固质量比的影响
在NaOH 质量浓度40 g/L,O2分压2.0 MPa,浸出温度140 ℃,浸出时间2 h 条件下,考察液固质量比对高砷锑烟尘浸出的影响。砷、锑和铅浸出率随液固质量比的变化关系及相应浸出渣的XRD 图谱分别如图10 和图11 所示。
由图10 可知:当液固质量比从5 增加至10 时,砷的浸出率由76.01%提高到95.86%,而锑的浸出率则由6.44%降至0.78%。当液固质量比进一步增加时,砷和锑的浸出率变化不大。与之不同的是,随着液固质量比增加,铅的浸出率逐步提高,特别是当液固质量比超过20 后,铅的浸出率迅速提高,如液固质量比为10 时,铅浸出率为0.11%;而当提高至20 时,其浸出率可达0.91%。低液固质量比条件下,碱量较少,不足以完全溶解烟尘中的砷、锑物相,而随着液固质量比的增加,过多的碱量导致物料中的Pb(Ⅱ)与OH-发生配合反应而溶解于溶液中。因此,为确保As 的浸出效果及其与Pb 和Sb 有效分离,选用液固质量比为10 较为合适。
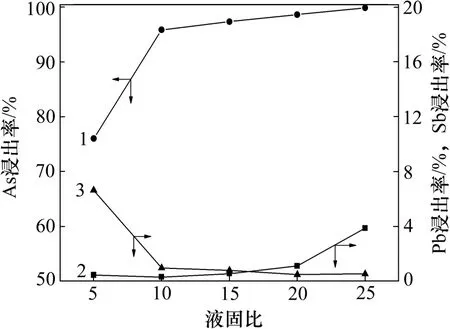
图10 液固质量比对砷、锑和铅浸出率的影响Fig.10 Effects of mass ratio of liquid to solid on leaching rates of arsenic, antimony and lead
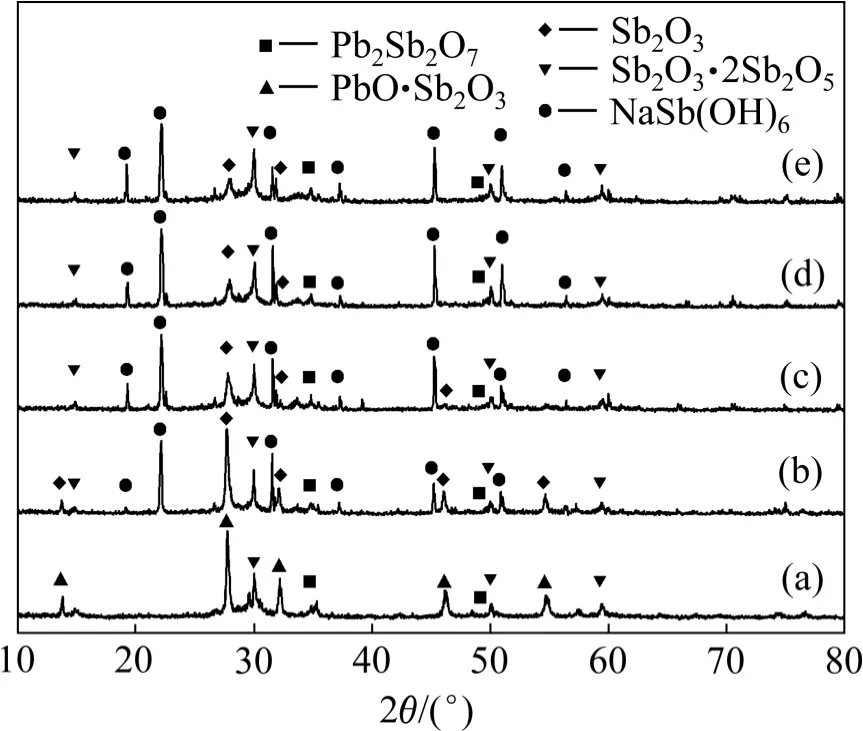
图11 不同液固质量比下浸出渣的XRD 图谱Fig.11 XRD patterns of leaching residues obtained at different mass ratio of liquid to solid
3 结论
(1) 火法处理铅阳极泥产出的高砷锑烟尘中,砷、锑的主要物相分别为As2O3和Sb2O3,锑也有少量以Sb2O5存在。
(2) 在苛性碱溶液中氧压浸出高砷锑烟尘,可实现砷与锑、铅的高效分离,其原理为As(Ⅲ)氧化为溶解度更大的As(Ⅴ)进入溶液,Sb(Ⅲ)氧化为Sb(Ⅴ),形成在碱性溶液中较 Sb2O3溶解度更低的Sb2O3.2Sb2O5,Pb2Sb2O7和NaSb(OH)6沉淀进入浸出渣中。
(3) 实验确定的最佳工艺条件为:NaOH 质量浓度40 g/L,O2分压2.0 MPa,浸出温度140 ℃,浸出时间2 h,液固质量比10。在此条件下,As 的浸出率可达95%以上,而Sb 和Pb 的浸出率均小于1.0%。该工艺实现了砷和锑的一步分离,工艺流程短,碱耗低,有价金属回收率高,因而具有较好的经济技术指标。
[1] Bhattacharya P, Welch A H, Stollenwerk K G, et al. Arsenic in the environment: Biology and chemistry[J]. Science of the Total Environment, 2007, 379: 109-120.
[2] Nriagu J O, Pacyna J M. Quantitative assessment of worldwide contamination of air, water and soils by trace metals[J]. Nature,1988, 333: 134-139.
[3] CAO Huazhen, CHEN Jinzhong, YUAN Haijun, et al.Preparation of pure SbCl3from lead anode slime bearing high antimony and low silver[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(12): 2397-2403.
[4] Amer A M. Processing of copper anodic-slimes for extraction of valuable metals[J]. Waste Management, 2003, 23(8): 763-770.
[5] CHEN Ya, LIAO Ting, LI Gaibian, et al. Recovery of bismuth and arsenic from copper smelter flue dusts after copper and zinc extraction[J]. Minerals Engineering, 2012, 39: 23-28.
[6] Morales A, Cruells M, Roca A, et al. Treatment of copper flash smelter flue dusts for copper and zinc extraction and arsenic stabilization[J]. Hydrometallurgy, 2010, 105(1/2): 148-154.
[7] LI Yuhu, LIU Zhihong, LI Qihou, et al. Removal of arsenic from Waelz zinc oxide using a mixed NaOH-Na2S leach[J].Hydrometallurgy, 2011, 108(3/4): 165-170.
[8] LI Yuhu, LIU Zhihong, ZHAO Zhongwei, et al. Determination of arsenic speciation in secondary zinc oxide and arsenic leachability[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(5): 1209-1216.
[9] 段学臣. 高砷锑烟尘中砷锑的回收[J]. 中南矿冶学院学报,1991, 22(2): 149-155.DUAN Xuechen. Recovery of arsenic and antimony from smoky dust with high content of arsenic and antimony[J]. Journal of Central South Institute of Mining & Metallurgy, 1991, 22(2):149-155.
[10] 舒万艮, 陈其垠, 姜友云. 由粗锑氧制备醋酸锑[J]. 矿产综合利用, 2000(2): 34-37.SHU Wanyin, CHEN Qiyin, JIANG Youyun. The preparation of antimony acetate from crude antimony oxide[J]. Mutipurpose Utilization of Mineral Resources, 2000(2): 34-37.
[11] 周红华. 高砷锑烟灰综合回收工艺研究[J]. 湖南有色金属,2005, 21(1): 21-22.ZHOU Honghua. Research on sythetic recycle of dust being rich in Sb and As[J]. Hunan Nonferrous Metals, 2005, 21(1): 21-22.
[12] 龙志娟. 用锑砷烟灰制取焦锑酸钠和砷酸钠[J]. 辽宁化工,2009, 38(10): 738-740.LONG Zhijuan. Preparation of sodium pyroantimonate and sodium arsenate with Sb and As-containing ash[J]. Liaoning Chemical Industry, 2009, 38(10): 738-740.
[13] 樊立峰, 谢刚, 杨大锦, 等. 从锑氧粉中提取锑、砷、铅的可行性工艺方案[J]. 云南冶金, 2006, 35(4): 33-35.FAN Lifeng, XIE Gang, YANG Dajin, et al. The feasible processes for extraction of antimony, arsenic and lead from antimony oxide[J]. Yunnan Metallurgy, 2006, 35(4): 33-35.
[14] 樊立峰, 谢刚, 杨大锦, 等. 锑氧粉砷浸出工艺研究[J]. 有色金属(冶炼部分), 2005(6): 16-18.FAN Lifeng, XIE Gang, YANG Dajin, et al. Study on leaching process of arsenic from antimony oxide power[J]. Nonferrous Metals (Extractive Metallurgy), 2005(6): 16-18.
[15] 北京矿冶研究总院测试研究所. 有色金属分析手册[M]. 北京:冶金工业出版社, 2008: 399-428.Beijing General Research Institute of Mining & Metallurgy Testing Institute. Non-ferrous metals analysis handbook[M],Beijing: Metallurgical Industry Press, 2008: 399-428.
[16] Parikh S J, Lafferty B J, Meade T G, et al. Evaluating environmental influences on As(Ⅲ) oxidation kinetics by a poorly crystalline Mn-oxide[J]. Environmental Science &Technology, 2010, 44(10): 3772-3778.
[17] Leuz A K, Jonhson C A. Oxidation of Sb(Ⅲ) to Sb(Ⅴ) by O2and H2O2in aqueous solutions[J]. Geochimica et Cosmochimica Acta, 2005, 69(5): 1165-1172.
[18] Cao S, Goldberg S, Herbel M J, et al. Sorption processes affecting arsenic solubility in oxidized surface sediments from Tulare Lake Bed, California[J]. Chemical Geology, 2006,228(1/2/3): 33-43.

