帕金森病大鼠黑质致密部IgG蛋白的表达变化
汪明玉 刘志辉 付文玉 庄文欣 孙杨 杨同 王欣 刘宗昱 王晓晓 马璐璐
帕金森病(PD)是中老年人常见的进行性神经元变性疾病,其典型的病理学特征是黑质多巴胺(dopamine, DA)能神经元大量变性和丢失。近年来,氧化应激及免疫炎性反应已成为PD发病机制的研究热点。越来越多的研究结果证明,在PD患者或PD动物模型脑中均可发现包括肿瘤坏死因子α(TNF-α)等在内的多种炎性反应因子表达水平增高[1],推测这是导致DA神经元变性凋亡的主要机制。近年来研究发现,外源性免疫球蛋白G(immunoglobulin G, IgG)可通过诱导免疫炎性反应成功建立PD的动物及细胞模型,提示IgG参与了PD的发病过程[2]。更为引人注目的是,IgG已被证明可由中枢神经系统内神经元自主分泌,并广泛存在于大脑皮质、海马、脊髓、小脑及周围神经系统的脊神经节等处[3-4]。但目前尚不清楚黑质部位是否有IgG阳性细胞存在,其分布特点如何,在PD发生中是否发生改变。该研究探讨了PD模型大鼠黑质致密部IgG的表达变化及其在PD发病中的作用。
1 材料和方法
1.1动物和试剂Spraque-Dawley(SD)健康雄性大鼠20只,体质量(180~220)g,购自山东中医药大学实验动物中心,随机分为模型组(15只)和健康对照组(5只)。6-羟多巴胺(6-hydroxydopamine,6-OHDA)、阿扑吗啡(apomorphine,APO)及酪氨酸羟化酶(tyrosine hydroxylase,TH)小鼠多克隆抗体为美国Sigma公司产品;兔抗大鼠IgG多克隆抗体购自美国Santa Cruz公司;SP试剂盒为北京中杉金桥生物技术公司产品;ZH-蓝星脑立体定位仪购自淮北正华生物仪器器材公司;荧光显微镜为Leica公司产品。
1.2方法
1.2.1模型制备:以水合氯醛(0.4 mL/kg)腹腔注射麻醉大鼠,将其固定于脑立体定位仪上,常规消毒后沿正中线切开颅顶皮肤,暴露前、后囟,参照Pellegrino等大鼠脑立体定位图谱,采用两点注射法制备大鼠PD模型[5]。右侧黑质坐标系统为:前囟后5.0 mm,正中线右侧2.0 mm,硬膜下8.0 mm;右侧前脑内侧束坐标系统:前囟后4.4 mm,正中线右侧1.2 mm,硬膜下8.0 mm。用10 μL微量进样器注入6-OHDA (2 μg/μL),每个坐标点注射10 μL,注射速度为1 μL/min,注射完毕后留针10 min,然后以1.0 mm/min速度缓慢退针。术后2周腹腔注射0.01%(质量浓度)的APO(0.5 mL/kg),观察、记录大鼠的行为变化,若头尾相接恒定转向健侧,且旋转圈数≥210 r/30 min,则视为PD大鼠造模成功。选取造模成功的5只大鼠作为模型组。
1.2.2灌注取材及切片:将两组大鼠麻醉后由颈总动脉依次灌注生理盐水50 mL及4%(质量浓度)多聚甲醛200 mL,断头取脑,在4%(质量浓度)多聚甲醛中后固定过夜。取中脑部位组织,制备石蜡切片,片厚5 μm。
1.2.3免疫组化:取两组大鼠的中脑黑质部位相邻切片,采用免疫组织化学ABC法分别进行TH及IgG染色。步骤简述如下:切片脱蜡至水,入3%(体积分数) H2O2溶液于37℃孵育15 min,正常羊血清封闭,37℃孵育30 min,倾去多余血清,加小鼠抗大鼠TH单克隆抗体(1∶1000);相邻切片加兔抗大鼠IgG多克隆抗体(1∶50);4℃冰箱过夜。加生物素化二抗,37℃温箱中l h。加SABC工作液,37℃温箱中l h,DAB避光显色。各步骤之间均用0.01 mol/L PBS冲洗。梯度酒精脱水,二甲苯透明,中性树胶封片。0.01 mol/L PBS代替一抗作为阴性对照。每组大鼠选取6张切片,计数每张切片上损毁侧和健侧TH、IgG阳性细胞数,并以损毁/健侧阳性细胞总数之比表示阳性表达的变化。另外,每只大鼠选取黑质致密部,可见TH阳性细胞的相邻切片5张,应用Image-Pro Plus专业图像分析软件,分别分析各组大鼠双侧黑质部位TH、IgG的积分光密度(IOD)值,并以损毁侧IOD值/健侧IOD值之比表示阳性表达的变化。
1.3统计学处理数据用SPSS17.0统计软件进行处理,结果以均数±标准差形式表示,采用两独立样本的t检验。取α=0.05。
2 结果
2.1大鼠行为学检测15只大鼠有8只(53.3%)造模成功。注射APO后PD大鼠出现僵直状态,随后出现以健侧后肢为支点的向健侧的旋转运动,呈首尾相接状态,平均8~10圈/min。
2.2免疫组化光镜下,对照组及模型组PD大鼠健侧可见密集的、胞体较大的呈椭圆形或锥体状的TH阳性神经元,有分支状的轴突或树突,TH免疫阳性物质位于细胞质内,TH阳性纤维分支呈网状,PD模型大鼠损毁侧TH阳性神经元数目明显减少,且细胞体积较小,突起变短,TH阳性纤维稀疏;两组大鼠黑质致密部和网状部IgG免疫阳性细胞均有分布,细胞形状呈锥体形或梭形,大小不等,对照组大鼠双侧黑质致密部和模型组大鼠的健侧IgG阳性细胞数量较少,分布较稀疏,而模型组的损毁侧IgG阳性细胞数量明显增加,分布密集(图1)。对照组大鼠黑质TH阳性神经元数及其IOD值变化均高于PD模型组,而黑质IgG阳性细胞数及其IOD值变化均低于PD模型组(表1)。
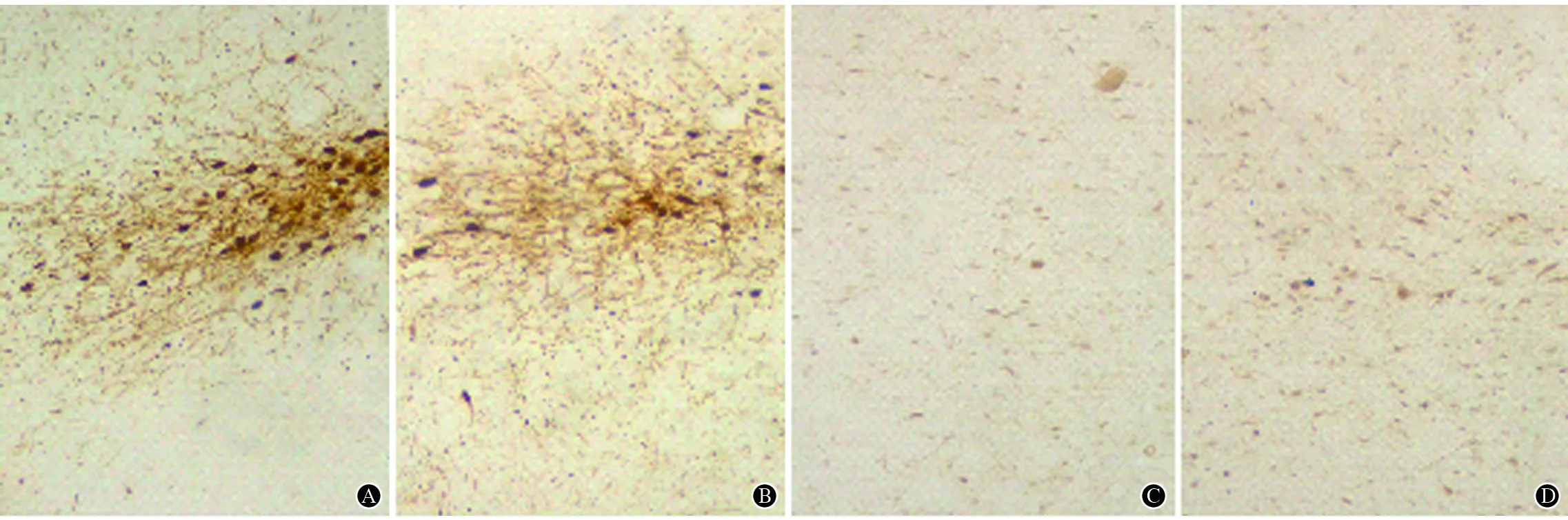
A:对照组大鼠黑质致密部TH免疫阳性神经元细胞体呈锥体形或椭圆形,细胞数量多,分布较密集;B:模型组大鼠黑质致密部TH免疫阳性神经元数量较少,分布较稀疏;C:对照组大鼠黑质致密部IgG阳性细胞胞体多呈梭形,数量较少,散在分布;D:模型组大鼠黑质致密部IgG免疫阳性细胞数量较多,分布较密集,体积较大
图1光镜下观察两组大鼠黑质致密TH及IgG免疫阳性神经元变化(免疫组化,×200)

表 1 两组大鼠黑质致密部TH、IgG阳性细胞数变化以及其IOD值变化比较
3 讨论
许多证据表明,免疫/炎性反应系统参与PD的发病,但关于IgG在神经细胞表达及其功能的研究较少。
TH是催化酪氨酸形成L-多巴的限速酶,是脑内DA能神经元的特异性蛋白标记物。该酶在黑质纹状体中活性和表达水平的变化与PD的发生发展密切相关。本实验结果显示,PD模型组损毁侧TH阳性神经元分布稀疏、胞体轮廓及突起模糊,且同对照组相比TH阳性神经元数目显著降低,表明在PD模型鼠脑内DA的合成能力明显下降。
有研究报道,外源性单体IgG对神经系统具有保护作用,但其机制尚不清楚,可能与IgG抑制补体系统对局部神经组织的损伤、减轻炎性反应[6]或具有免疫调节作用[7]有关。而对内源性(源自PD患者自身脑脊液及血清)IgG分子的研究发现,这些抗体能诱导体外培养的DA能神经元(细胞株)变性,对DA能神经元具有特异性损伤作用[8]。IgG可以激活补体系统,后者可以通过异常调理作用,刺激小胶质细胞呼吸爆发导致氧化应激等作用引起DA能神经元的相对特异性损伤[2]。另外,在补体存在的情况下,IgG可与小胶质细胞表面受体结合,从而激活小胶质细胞,通过产生超氧化物及氧化亚氮等对DA能神经元产生神经毒性作用[9]。
近来有学者检测分析PD患者血清中以往被认为与中枢神经系统病变和临床表现有关的7种自身抗体,结果发现,抗神经元抗体(antineuronal-cells)、抗脑裂解液抗体(anti-brain lysate)和抗dsDNA抗体(anti-dsDNA)显著增高[10],由此认为这些自身抗体可以作为PD诊断的标志物。由此可见,PD患者脑脊液和血清中的抗体在PD发病中具有重要的作用。
通过尸检研究,使人们对PD患者脑组织中IgG与PD的关联有了进一步的认识。PD患者路易小体(Lewy body)呈IgG免疫反应强阳性,PD早期黑质IgG阳性神经元比例显著高于晚期,其比例与黑质神经元丢失程度呈负相关[11]。学者们认为,神经元结合IgG可能是中枢神经系统神经元死亡的一种共同反应,是PD发病中体液免疫反应引发选择性黑质DA能神经元变性死亡发挥的作用。
虽然上述研究表明PD患者脑脊液、血清和脑组织中存在许多IgG分子,而且这些IgG分子与PD的发病和病理改变有关,但并未提到这些抗体的细胞来源。
IgG作为重要的免疫效应分子,一直被认为只由成熟B淋巴细胞产生,只有在血-脑脊液屏障(blood-brain barrier,BBB)受损时,IgG可以穿过BBB进入脑内参与免疫反应。所以多年来学者们一直推测存神经元中的IgG是从细胞外液中摄取而来。而在2008年Huang等研究发现,IgG存在于成年小鼠以及新生乳鼠的神经元中,通过共聚焦显微镜可观察到IgG免疫反应产物位于神经元的胞质、轴突和树突;通过原位杂交、单细胞RT-PCR方法进一步研究显示,重组免疫球蛋白γ链和κ链的转录产物也存在于成年小鼠脑神经元中;采用35S和125I标记的免疫沉淀反应进一步确定,小鼠脑神经元可以产生IgG[3]。近年来有学者对产生IgG的细胞种类进行深入研究发现,人体中枢神经系统的大脑、小脑、海马及脊髓等多种组织结构中的神经元及胶质细胞胞质及突起中IgG均有表达,神经系统阳性率可达82.3%,应用原位杂交技术及RT-PCR技术从蛋白水平及mRNA水平进一步明确了IgG既可以由神经元自身产生并分泌[4]。在此将其称为神经源性IgG。
该研究应用脑内注射神经毒素6-OHDA成功制备大鼠PD模型,采用相邻脑片,分别进行TH和IgG免疫组化,染色结果可见,在正常大鼠黑质致密部和网状部均有IgG阳性细胞存在,其阳性细胞的大小、形态和分布情况与TH阳性细胞明显不同:IgG阳性细胞呈锥体形或梭形,细胞数量多,分布范围明显大于TH阳性细胞分布区域。免疫组织化学染色结果显示,模型组损毁侧黑质TH阳性神经元数目显著降低,而损毁侧IgG阳性细胞数目显著增高,两组TH和IgG阳性细胞的IOD值比值亦有统计学差异,表明神经源性IgG的确参与了PD发病时机体的免疫反应。
综上所述,该研究结果表明,大鼠黑质致密部存在IgG阳性细胞,而且PD大鼠黑质IgG蛋白表达水平明显增高,提示IgG参与了PD的发生。至于神经源性IgG由黑质致密部的何种细胞产生,在PD发生和发展过程中具有何种确切作用,还需做进一步研究。
[1]More SV, Kumar H, Kim IS, et al. Cellular and molecular mediators of neuroinflammation in the pathogenesis of Parkinson’s disease[J]. Mediators Inflamm, 2013, 2013: 952375.
[2]汪锡金, 陈生弟, 刘卫国, 等. 帕金森病IgG诱导多巴胺能神经元损伤机制的初步研究[J].中华神经科杂志, 2004, 37: 335-339.
[3]Huang J, Sun X, Mao Y, et al. Expression of immunoglobulin gene with classical V-(D)-J rearrangement in mouse brain neurons[J]. Int J Biochem Cell Biol, 2008, 40: 1604-1615.
[4]Niu N, Zhang J, Guo Y, et al. Expression and distribution of immunoglobulin G and its receptors in the human nervous system [J]. Int J Biochem Cell Biol, 2011, 43: 556-563.
[5]Pellegrino LJ,Pellegrino AS,Cushman AJ.A stereotaxic atlas of the rat brain[M].2 nd ed.Plenum press,1979.
[6]Arumugam TV, Tang SC, Lathia JD, et al. Intravenous immunoglobulin(IVIG) protects the brain against experimental stroke by preventing complement-mediated neuronal cell death[J]. Proc Natl Acad Sci USA, 2007, 104: 14104-14109.
[7]Fehlings MG, Nguyen DH. Immunoglobulin G: a potential treatment to attenuate neuroinflammation following spinal cord injury[J]. J Clin Immunol, 2010, 30 (Suppl 1): S109-S112.
[8]Le WD, Rowe DB, Jankovic J, et al. Effects of cerebrospinal fluid from patients with Parkinson’s disease on dopaminergic cells[J]. Arch Neurol, 1999, 56: 194-200.
[9]Wang XJ, Yan ZQ, Lu GQ, et al. Parkinson disease IgG and C5a-induced synergistic dopaminergic neurotoxicity: Role of microglia [J]. Int Neurochem, 2007, 50: 39-50.
[10]Benkler M, Agmon-Levin N, Hassin-Baer S, et al. Immunology, Autoimmunity, and Autoantibodies in Parkinson’s Disease[J]. Clin Rev Allergy Immunol, 2011, 42: 164-171.
[11]Orr CF, Rowe DB, Mizuno Y, et al. Possible role for humoral immunity in the pathogenesis of Parkinson’s disease[J]. Brain, 2005, 128(Pt 11): 2665-2674.

