横山水库浮游动物群落结构特征及水质评价
杨亮杰吕光汉竺俊全徐 镇金春华
(1. 宁波大学教育部应用海洋生物技术重点实验室, 宁波 315211; 2. 宁波市原水集团有限公司横山水库分公司, 宁波 315211)
横山水库浮游动物群落结构特征及水质评价
杨亮杰1吕光汉2竺俊全1徐 镇1金春华1
(1. 宁波大学教育部应用海洋生物技术重点实验室, 宁波 315211; 2. 宁波市原水集团有限公司横山水库分公司, 宁波 315211)
为了解横山水库浮游动物群落结构特征及水质状况, 于2012年5月(春)、7月(夏)、10月(秋)及2013年1月(冬)对该水库的浮游动物及主要水质理化指标进行了调查分析, 利用生物多样性指数法和综合营养状态指数法评价其水质状况。结果共鉴定浮游动物100种(原生动物47种、轮虫36种、枝角类12种、桡足类5种)。春夏秋季种类组成主要以轮虫和原生动物为主, 枝角类与桡足类种类较少; 冬季各种类均很少。优势种为王氏似铃壳虫(Tintinnopsis wangi)、淡水简筒虫(Tintinnidium fluviatile)、球形沙壳虫(Difflugia globulosa)、湖生累枝虫(Epistylis lacustris)、裂痕龟纹轮虫(Anuraeopsis fissa)、针簇多肢轮虫(Polyarthra trigla)、裂足臂尾轮虫(Brachionus diversicornis)和等刺异尾轮虫(Trichocerca similis), 季节更替明显。浮游动物年均丰度为1460 ind./L, 变化范围17—3164 ind./L; 年均生物量为1.252 mg/L, 变化范围0.042—2.732 mg/L; 香农多样性指数(H')、均匀度指数(J)及丰富度指数(D)年均值分别为 2.06、0.68及 1.30; 全年综合营养状态指数值范围33.36—44.15。CCA分析表明, 温度及pH等环境因子与浮游动物群落结构具有明显相关性。水质总体评价显示, 横山水库水质处中污染状态、水体处中营养水平, 基本符合国家Ⅱ类水的水质标准, 但作为饮用水水源地, 其水质还需进一步加强管理与调控。
CCA; 浮游动物; 群落结构; 生物多样性; 水质评价
浮游动物在水环境生态系统的物质转化、能量流动、信息传递等诸多生态过程中起着至关重要的作用[1—3]; 作为天然水域食物链中的一个主要环节,其种类和数量变动会直接或间接影响其他水生生物的丰度和分布[4]。在湖泊水库净水生态渔业实施过程中, 浮游动物群落结构及生物量的变化可用来作为制定滤食性鱼类放养量的依据。此外浮游动物生命周期短, 易受环境变化的影响, 其种类组成及分布与温度、透明度、pH等水环境因子密切相关, 不少种类还可作为环境污染和水体富营养化的指示生物[5—8]。目前, 浮游动物群落结构变化和生物多样性监测手段已广泛应用于湖泊水库生态环境评价研究中[9—12], 取得的成果为湖泊水库的水质管理、水环境污染控制及生态修复等提供了依据。
横山水库是一座以城市供水为主, 兼有防洪、灌溉、发电、渔业等综合利用的大(二)型水利工程,位于甬江流域奉化江支流上游, 库区年均降雨量1685.8 mm, 集雨面积 150.80 km2, 平均年径流量1.52×109m3, 总库容1.11×109m3。作为宁波市重要的饮用水水源地, 年供水量约 9.2×108m3。近年来,该水库在春季偶有出现轻微“水华”现象, 为了确保对城市的供水安全, 水库管理部门在控制库区周围污染源的同时, 采取了净水生态渔业技术措施调控库水环境, 控制水体富营养化发展及“水华”的发生。目前, 横山水库浮游动物群落生态学资料缺乏。本研究通过对横山水库的一年四季采样, 调查分析浮游动物的种类组成、丰度和生物量、物种多样性及相关环境因子, 揭示横山水库浮游动物群落结构特征并评价其水环境状况, 以期为横山水库水环境监测与保护、水质与生态渔业管理提供理论依据, 也为该水库浮游动物的后续演替研究提供参照资料。
1 材料与方法
1.1 采样点设置
在横山水库设置 4个采样站点: 上游 2(1#, 29°33′ 11.48″N, 121°20′ 19.63″E)、库中(2#, 29°34′7.32″N, 121°20' 8.77″E)、坝前(3#, 29°34′ 28.34″N, 121°21′ 13.98″E)及上游 1(4#, 29°33′ 52.32″N, 121°19′ 37.48″E)(图1), 每站点设上(0.5 m)、中(5 m)、下(10 m)三个采样水层。

图1 横山水库采样站点分布Fig. 1 Sampling distribution in Hengshan Reservoir
1.2 样品采集与处理
分别于2012年5月(春)、7月(夏)、10月(秋)和2013年1月(冬)各调查采样一次。浮游动物定性定量样品的采集与处理参考 SL167—1996《水库渔业资源调查技术规范》进行。种类的鉴定参考有关工具书[13,14], 样品浓缩后采用浮游动物计数框进行计数, 浮游动物湿重参考文献[15]。
采用YSI多参数水质监测仪现场测定温度、pH及溶解氧, 用萨氏盘测定透明度。总磷、总氮、高锰酸盐指数及叶绿素a等理化指标的测定方法参照文献[16]。
1.3 优势度及多样性指数计算
优势度 Y =(Ni/N)fi; 优势种更替率 R=(a+b–2c)/ (a+b–c)×100%; 香农多样性指数H' = – ∑(Ni/N)ln(Ni/ N); 均匀度指数 J = H/lnS; 丰富度指数 D =(S–1)/ lnN。式中Ni为第i种的个体数, N为所有种类的总个体数, fi为第i种在各站中出现的频度, S为浮游动物种类数, a与b分别为相邻两季的优势种数, c为相邻两季共同的优势种数。
1.4 综合营养状态指数计算
1.5 典范对应分析
对物种丰度数据进行处理, 选择相对丰度>1%,出现频率>25%的种类, 采用 Cancoo软件进行典范对应分析(CCA), 得出浮游动物与环境因子关系。
1.6 聚类分析
对各站点数据进行标准化处理, 运用SPSS 13.0统计软件进行系统聚类分析, 聚类方法采用组间连接法(Between-groups linkage), 数据间距离采用欧氏距离(Euclidean distance), 得到各站点浮游动物群落组成相似性聚类图。
2 结果
2.1 浮游动物种类组成及优势种变化
四次调查共鉴定浮游动物 100种, 其中原生动物47种、轮虫36种、枝角类12种、桡足类5种。种类数夏季最多, 为66种; 春季次之, 为53种; 秋季第三, 为35种, 冬季最少, 仅15种, 季节变化明显。春、夏、秋季种类组成主要以轮虫和原生动物为主, 枝角类与桡足类种类较少, 而冬季各种类均很少。春季与夏季, 中、上层种类较下层多; 而秋季与冬季, 中、下层种类较上层多。四站点之间种类组成差异不大。
四季共出现浮游动物优势种(优势度≥0.02)8种,其中原生动物 4种, 分别为王氏似铃壳虫(Tintinnopsis wangi)、淡水简筒虫(Tintinnidium fluviatile)、球形沙壳虫(Difflugia globulosa)和湖生累枝虫(Epistylis lacustris); 轮虫 4种, 分别为裂痕龟纹轮虫(Anuraeopsis fissa)、针簇多肢轮虫(Polyarthra trigla)、裂足臂尾轮虫(Brachionus diversicornis)和等刺异尾轮虫(Trichocerca similis)。夏季优势种最多,达7种, 其优势度介于0.033—0.307之间; 秋季优势种最少, 仅王氏似铃壳虫1种, 优势度高达0.793。春、夏、秋、冬四季优势种变化从轮虫优势为主逐渐过渡到原生动物优势为主(表1)。
优势种季节更替率(R)冬–春季最高, 为 100%;夏-秋季次之, 为 85.71%; 春-夏季再次之, 为62.50%; 秋-冬季最低, 为50.00%。

表1 横山水库浮游动物优势种及优势度季节变化Tab. 1 Seasonal variations of dominant species of zooplankton in Hengshan Reservoir
2.2 浮游动物丰度和生物量变化
浮游动物年均丰度为1460 ind./L, 变化范围17 —3164 ind./L。原生动物丰度占浮游动物总丰度的54.84%, 轮虫占 41.41%, 枝角类和桡足类所占的比例极低, 分别为1.08%和2.67%。夏季平均丰度最高,为2613 ind./L; 春季次之, 为1646 ind./L; 秋季第三,为1544 ind./L; 冬季最低, 仅为34 ind./L, 季节差异显著(P<0.05, 图2)。
浮游动物年均生物量为 1.252 mg/L, 变化范围0.042—2.732 mg/L。原生动物、轮虫、枝角类及桡足类生物量分别占浮游动物总生物量的 1.73%、23.90%、37.02%及37.35%。夏季平均生物量最高, 为1.728 mg/L; 春季次之, 为 1.648 mg/L; 秋季第三,为1.481 mg/L; 冬季最低, 为0.152 mg/L, 季节差异显著(P<0.05), 变化趋势与丰度相同(图3)。
2.3 生物多样性指数
各站点四季浮游动物Shannon多样性指数(H')、 Pielou均匀度指数(J)、Margalef丰富度指数(D)变动情况见表2。香农多样性指数年均值为2.06, 变化范围0.88—3.21, 秋冬季较低, 春夏季较高。均匀度指数年均值为 0.68, 变化范围 0.37—0.96, 秋季最低,冬季最高。丰富度指数年均值为 1.30, 变化范围0.51—2.24, 秋冬季较低, 春夏季较高。各站点变化趋势有所不同, 丰富度指数总体表现为1号和2号站点大于3号和4号站点; 均匀度指数3号站点较其他站点高。

图2 横山水库浮游动物丰度变化Fig. 2 The abundance of zooplankton in Hengshan Reservoir
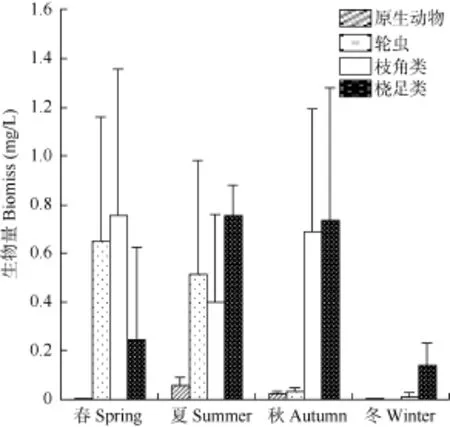
图3 横山水库浮游动物生物量变化Fig. 3 The biomass variation of zooplankton in Hengshan Reservoir
2.4 各站点浮游动物群落系统聚类特征
以四季四个站点、每一站点三采样水层获得的48个浮游动物样品的3种多样性指数、种类数、丰度和生物量为变量进行的聚类分析结果如图4所示。48个样点的浮游动物大致聚类成冬季类群、秋季类群及春夏季类群等 3大类群。春夏季类群种类数多,多样性与丰富度指数较高; 秋季类群与冬季类群距离较近, 种类数少、丰度低, 叶绿素 a含量低; 在各季节类群内冬季的各站位之间相似性最高, 夏季类群上、中、下三水层间差别较为明显, 其他季节的垂直分布差异不大, 四个站点间的分化不显著。
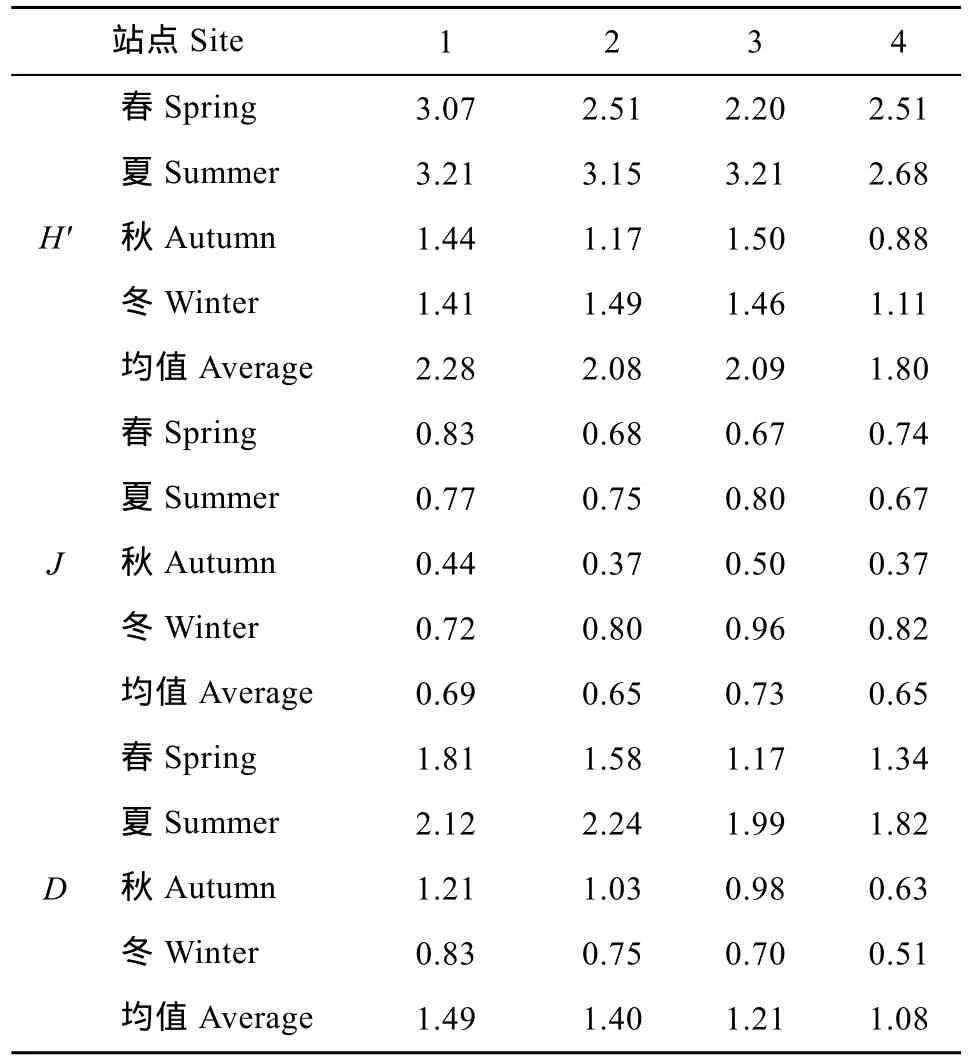
表2 横山水库浮游动物多样性指数Tab. 2 The diversity index of zooplankton in Hengshan Reservoir
2.5 主要理化因子及综合营养状态指数
各站点不同季节主要理化指标均值见表 3。总氮变化范围0.92—1.79 mg/L, 平均值1.49 mg/L; 总磷变化范围0.02—0.06 mg/L, 平均值0.03 mg/L。温度在四站点间差异不大, 叶绿素 a在春夏两季明显高于秋冬季。CODMn值变化范围 0.85—2.37 mg/L,春夏季值大于秋冬季。透明度与溶解氧均在冬季最高, pH全年变化较小。统计性检验显示, 除TP在不同季节间无显著性差异外, 其他 7个指标均存在极显著性差异(P<0.01)。
表4为依据透明度、总氮、总磷、叶绿素a和高锰酸钾指数计算得到的综合营养状态指数, 其变化范围为33.36—44.15, 均值为38.45。春、夏、秋、冬四季平均值分别为42.20、38.56、35.18、37.85; 四站点年平均值分别为39.36、38.85、37.23、38.36。
2.6 浮游动物与环境因子的相关关系
对横山水库 16种浮游动物和各项环境因子进行CCA分析(表5、表6、图5)。由表5可见, 排序轴一和排序轴二的特征值分别为0.295和0.121, 分别解释了物种变异的 45.0%和 18.5%, 达到总特征值(0.655)的 63.5%、总典范分析特征值(0.562)的74.0%。CCA排序中的透明度(SD)、温度(T)、pH、溶解氧(DO)、总磷(TP)、总氮(TN)、高锰酸盐指数(CODMn)和叶绿素a (Chl. a)等环境因子共解释了物种组成总变异的 82.4%。轴一的物种环境相关系数为 0.987, 轴二的物种环境相关系数为 0.971, 表明横山水库环境因子与浮游动物种类组成关系密切。

图4 横山水库浮游动物群落系统聚类图Fig. 4 The hierarchical cluster dendrogram of zooplankton in Hengshan Reservoir
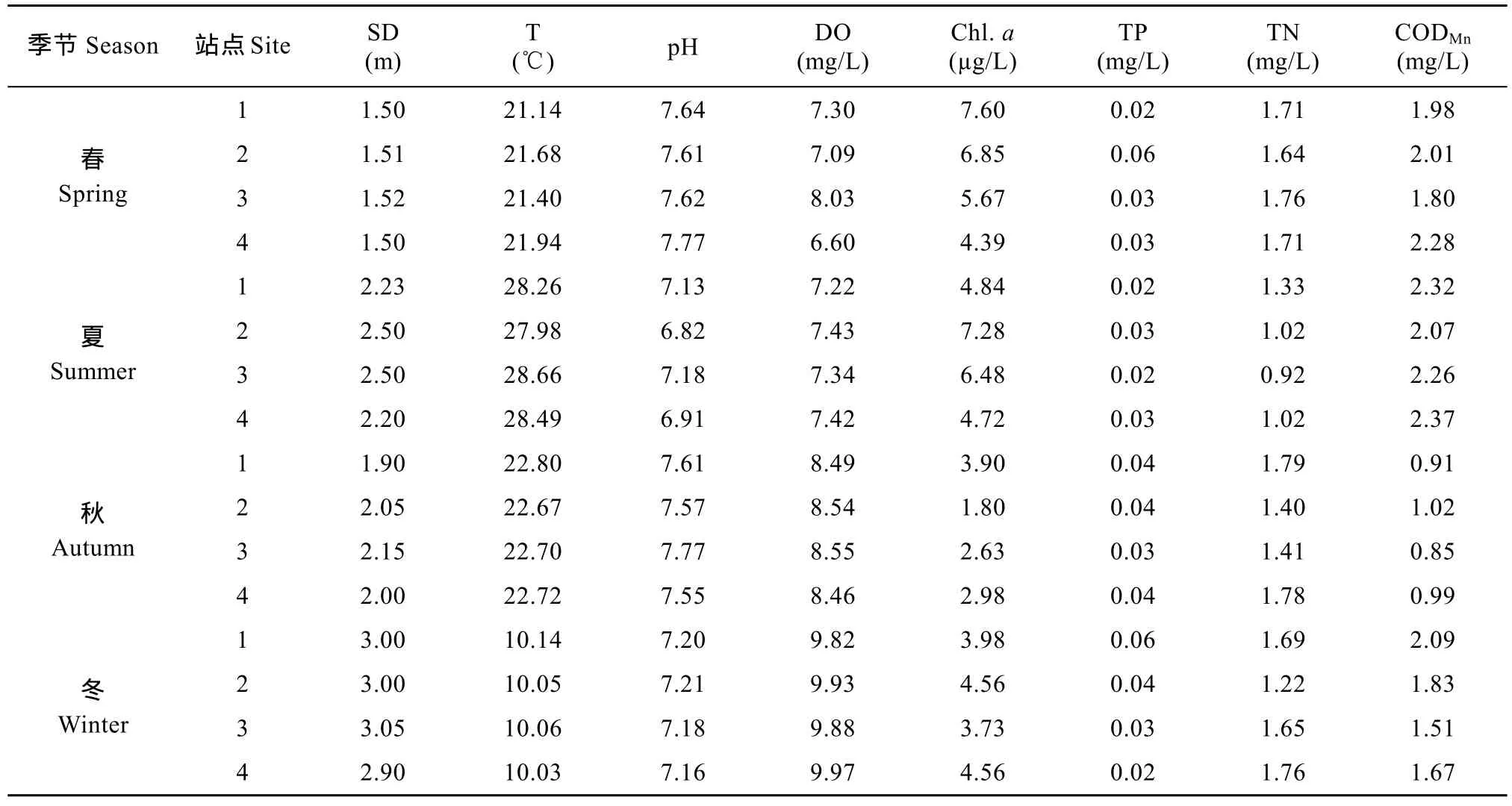
表3 横山水库水质理化指标Tab. 3 The chemical and physical parameters in Hengshan Reservoir

表4 横山水库四季综合营养状态指数Tab. 4 The comprehensive nutrition state index of Hengshan Reservoir

表5 水库浮游动物种类和环境因子间CCA分析的统计信息Tab. 5 Summary statistics for the axes of CCA performed on zooplankton in the reservoir
由表 6可见, 两种类排序轴之间的相关系数为0.001, 近似垂直, 两环境排序轴之间的相关系数为0, 表明排序结果可靠。透明度和溶解氧是 CCA第一排序轴的重要影响因子, 其相关系数分别为0.8512和 0.6439; 第二排序轴与温度、高锰酸盐指数有较高的负相关性, 其相关系数分别为–0.8096和–0.7418, 而与总氮、pH有较高的正相关性, 其相关系数分别为 0.7805和0.7286。

表6 前2个排序轴和环境因子间的相关系数Tab. 6 Correlation coefficients of environmental factors with the first two axes of CCA
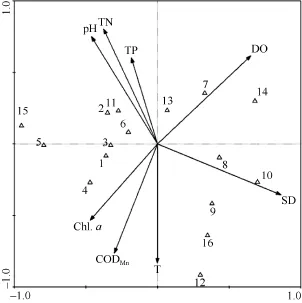
图5 横山水库浮游动物与环境因子间的CCA排序图Fig. 5 CCA biplot of species-environment of zooplankton in Hengshan Reservoir
3 讨 论
3.1 浮游动物群落结构特征及其影响因子
本研究发现横山水库浮游动物 100种, 其中原生动物种类最多, 轮虫次之, 枝角类和桡足类较少。群落结构特点为小型浮游动物种类数在总种数中所占比例较高, 大型浮游动物种类数所占比例较低。原生动物种类多、丰度高, 但生物量所占比例并不大, 形成优势的种类主要有王氏似铃壳虫、淡水简筒虫、球形沙壳虫及湖生累枝虫。轮虫丰度在春季达到最高, 这可能是由于浮游植物在春季丰度高, 且多为轮虫喜食的绿藻种类, 利于轮虫的生长繁殖[17,18]。枝角类与轮虫存在较强的竞争关系, 当水体中枝角类丰度较高时, 会对轮虫产生抑制作用而使其丰度降低[19,20], 横山水库四季枝角类均较少, 且主要为个体较小的长额象鼻 溞(Bosmina longirostris), 因此对轮虫构成的竞争压力较小。桡足类主要以无节幼体形式存在, 有研究认为无节幼体主要以滤食细菌为主[21], 此次调查发现无节幼体在夏秋季生物量较高, 这可能是由于夏秋季节水温较高, 有利于细菌的生长繁殖, 为无节幼体提供了较为丰富的食物来源。
捕食和温度被认为是决定浮游动物群落丰度、结构及导致浮游动物群落演替最主要的生物与非生物因子[22,23]。滤食性鱼类的丰度对浮游动物生物量和种类组成具有显著影响, 其对浮游动物的捕食是影响浮游动物群落结构的主要因素[24]。横山水库近年来采取净水生态渔业措施, 每年在水库中放养大量的滤食性鲢鳙鱼, 其捕食带来的下行效应必然对浮游动物群落结构产生重要影响。根据体积效率假说, 鱼类对浮游动物的捕食具有明显的选择性, 通常在同等能耗下优先选择个体较大的种类[25]。因此,当滤食性鱼类丰度较高时, 浮游动物群落会逐渐从大型个体为主转变为以小型个体为主[26], 桡足类和枝角类相应减少, 较大个体枝角类比例下降。横山水库浮游动物主要以轮虫与原生动物为主, 可能是由于枝角类和桡足类承受了较大的摄食压力, 从而难以成为优势类群。
CCA排序显示温度与第二排序轴有很强的相关性, 其相关系数为–0.8096, 对横山水库浮游动物群落结构季节变动具有重要影响。每一种浮游动物都有适应其生长的耐受温度范围, 超过这个范围则会影响其生长, 且不同种类的浮游动物其耐受温度范围也不同。原生动物可以生存的温度在 0—35 ℃,最适温度为 10—25℃。CCA排序图显示球形沙壳虫、湖生累枝虫和淡水简筒虫均与温度具有较强的正相关性, 且球形沙壳虫只在温度最高的夏季出现。在 15—25℃内, 绝大部分轮虫的发育时间会随着温度的升高而缩短, 轮虫总数的高峰一般在水温20℃以上时出现[27], 横山水库轮虫丰度同样在平均水温大于 20℃的夏季达到最高峰。pH对枝角类的代谢、生殖、发育等具有重要影响, 有研究指出过高或过低的pH均会影响枝角类的呼吸与摄食率[28]。从排序图中可看出, 长额象鼻 溞与 pH呈正相关关系。氮磷等营养盐一般通过浮游植物间接影响浮游动物的生长与分布, 营养盐的升高一般伴随着浮游植物丰度的增加, 进而促进浮游动物生长繁殖, 水体中浮游动植物丰度的升高可能引起水体透明度的下降, 从排序图中也可看出总氮、总磷与透明度之间均存在一定的负相关性, 其相关系数分别为–0.6901和–0.3182。
3.2 横山水库水质总体评价
生物多样性指数通过浮游动物的种类、数量等能较客观地反映水域环境对生物产生的综合累积效应, 然而水体环境、计数方法等因素都可能对多样性指数产生影响; 而依据水体理化指标的化学监测方法可以方便、直观地反映水环境状态, 但由于采用定期取样的调查方法, 得出的检测结果只能代表取样瞬间的状态, 不能反映取样前后的情况。因此本文同时采用了生物多样性指数法与综合营养状态指数法两种方法, 分别从两个角度来评价横山水库的水环境状况, 以期得到较为可信的结果。
根据综合营养状态指数 TSI(∑)<30为贫营养、30≤TSI(∑)≤50为中营养、TSI(∑)>50为富营养[29]。由表 4数值可见, 营养状态指数的季节变化趋势为春季>夏季>冬季>秋季、站点间年均值变化趋势为1号>2号>4号>3号, 全年各站点均处于中营养水平。
根据香农指数(H')值, 0—1为重度污染、1—3为中度污染(其中1—2为α中污、2—3为β中污)、>3为轻污或无污[30,31]。从表2数值判断, 横山水库春夏季各站点水质处于 β中污或轻污或无污, 而秋冬季基本处于 α中污。根据 Margalef (D)指数值, 0—1为多污型、1—2为α中污、2—3为β中污、3—4为寡污型, >4表示水体清洁[32]。从表2数值可知, 春夏季各站点水质处于α中污或β中污; 秋季1、2号站点处于α中污, 3、4号站点处于多污; 冬季各站点处于多污, 可见两指数评价结果基本一致。
综合水体理化指标与浮游动物多样性指数的评价结果可知, 横山水库水质处中污染状态、水体处中营养水平。春季水体透明度较低, 可能是浮游植物丰度较高所引起, 为防止春季水华的发生, 应进一步调整净水生态渔业技术措施, 适当增加以浮游植物为主要滤食对象的鲢鱼的放养比例。同时, 控制氮磷营养盐的输入, 防止富营养化发生, 确保水质符合饮用水标准。
[1] Wu L, Feng W S, Chen X J, et al. Community structure characteristics of zooplankton in Yili region of Xinjiang in summer [J]. Chinese Journal of Applied Ecology, 2008, 19(1): 163—172 [吴利, 冯伟松, 陈小娟, 等. 新疆伊犁地区夏季浮游动物群落结构特征. 应用生态学报, 2008, 19(1): 163—172]
[2] Yan Q Y, Yu Y H, Feng W S. Corresponding relations between DNA fingerprinting topological structure and species composition of plankton community in Dongting Lake [J]. Acta Ecologica Sinica, 2005, 25(9): 2221—2226 [颜庆云, 余育和, 冯伟松. 洞庭湖浮游生物群落 DNA指纹拓扑结构与物种组成对应关系. 生态学报, 2005, 25(9): 2221—2226]
[3] Zhang T, Ma X H, Wang G P, et al. Community structure and spatial distribution of plankton in the Poyang Lake national nature reserve, China [J]. Acta Hydrobiologica Sinica, 2014, 38(1): 158—165 [张婷, 马行厚, 王桂苹, 等.鄱阳湖国家级自然保护区浮游生物群落结构及空间分布.水生生物学报, 2014, 38(1): 158—165]
[4] Xu M Q. Evaluation of self-purification efficiency of Fuhe stream-Baiyangdian lake through zooplankton [J]. Acta Hydrobiologica Sinica, 1996, 20(3): 212—220 [许木启. 从浮游动物群落结构与功能的变化看府河—白洋淀水体的自净效果. 水生生物学报, 1996, 20(3): 212—220]
[5] Yu C G, Chen X Q, Hu H Y, et al. Species composition and community structure characteristics of zooplankton in the zhoushan fishing ground and its adjacent area [J]. Acta Hydrobiologica Sinica, 2011, 3(1): 183—193 [俞存根, 陈小庆, 胡颢琰, 等. 舟山渔场及邻近海域浮游动物种类组成及群落结构特征. 水生生物学报, 2011, 3(1): 183—193]
[6] Wang X Q, Zeng Y Y, Wu H H, et al. Investigation on plankton on plankton community composition and water quality state in the mainstream of Xiangjiang River [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 488—494 [王晓清, 曾亚英, 吴含含, 等. 湘江干流浮游生物群落结构及水质状况分析. 水生生物学报, 2013, 37(3): 488—494]
[7] Warwick R M. The nematode/copepod ratio and its use in pollution ecology [J]. Marine Pollution Bulletin, 1981, 12: 329—333
[8] Deng D G, Yang W, Meng X L, et al. Seasonal variations of crustacean zooplankton community structure in the middle reaches of the Huaihe River [J]. Acta Hydrobiologica Sinica, 2013, 37(5): 869—875 [邓道贵, 杨威, 孟小丽, 等. 淮河中游浮游甲壳动物群落结构的季节动态. 水生生物学报, 2013, 37(5): 869—875]
[9] Zhang N. Community Structure of Metazoan Zooplankton and Ecological Assessment of Water Quality in Qingcaosha Reservoir [D]. Thesis for Master of Science. Shanghai Ocean University. Shanghai. 2012 [张宁. 青草沙水库后生浮游动物群落结构及水质生态学评价. 硕士学位论文, 上海海洋大学, 上海. 2012]
[10] Wang Y Y. Community Structure of Zooplankton and Ecological assessment of water quality in Dishui Lake [D]. Thesis for Master of Science. Shanghai Normal University, Shanghai. 2008 [王延洋. 滴水湖浮游动物群落结构及水质生态学评价. 硕士学位论文, 上海师范大学, 上海. 2008]
[11] Chen L, Liu Y, Yu N, et al. Preliminary study on the metazoan zooplankton community structure of Fenshuijiang Reservoir and water quality assessment [J]. Journal of East China Normal University (Natural Science), 2010, (6): 72—82 [陈亮, 刘一, 禹娜, 等. 分水江水库浮游动物群落结构的初步研究及水质评价. 华东师范大学学报(自然科学版), 2010, (6): 72—82]
[12] Lin Q Q, Hu R, Duan S S, et al. Reservoir trophic states and the response of plankton in Guangdong Province [J]. Acta Ecologica Sinica, 2003, 23(6): 1101—1108 [林秋奇, 胡韧,段舜山, 等. 广东省大中型供水水库营养现状及浮游生物的响应. 生态学报, 2003, 23(6): 1101—1108]
[13] Han M S. Atlas of Plankton in Freshwater [M]. Beijing: Agricultural Press. 1980, 2—170 [韩茂森. 淡水浮游生物图谱. 农业出版社. 1980, 2—170]
[14] Zhou F X, Chen J H. Atlas of Microbiology in Freshwater [M]. Beijing: Chemical Industry Press. 2005, 35—359 [周凤霞, 陈剑虹. 淡水微型生物图谱. 化学工业出版社. 2005, 35—359]
[15] Zhao W. Aquatic Biology [M]. Beijing: China Agriculture Press. 2005, 503—516 [赵文. 水生生物学. 中国农业出版社. 2005, 503—516]
[16] Wang M C, Liu X Q, Zhang J H. Evaluate method and classification standard on lake eutrophication [J]. Environment al Monitoring in China, 2002, 18(5): 47—50 [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47—50]
[17] Nogueira M G. Zooplankton composition, dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), Sao Paulo, Brazil [J]. Hydrobiologia, 2001, 455: 1—18
[18] Gilbert J J. Competition between Rotifers and Daphnia [J]. Ecology, 1985, 66: 1943—1950
[19] Zhao S Y, Han B P. Size structure of the metazoan zooplankton community in a tropical lake: Xinghu Lake, South China [J]. Acta Ecologica Sinica, 2006, 26(8): 2646—2654 [赵帅营, 韩博平. 基于个体大小的后生浮游动物群落结构分析——以广东星湖为例. 生态学报, 2006, 26(8): 2646—2654]
[20] Gilbert J J. Supression of rotifer populations by Daphnia: A review of the evidence, the mechanisms and the effect on zooplankton community structure [J]. Limnology & Oceanography, 1988, 33: 1286—1303
[21] Sherr E B, Sherr B F. High rates of consumption of bacteria by pelagic ciliates [J]. Nature, 1987, 325: 710—711
[22] Wang T. Predation and Competition: Interspecies Interaetions of Zooplankton Communities in Liuxihe Reservoir [D]. Doctoral Dissertation, Jinan University, Guangzhou. 2010 [望甜, 捕食与竞争——流溪河水库浮游动物群落的种间关系研究, 博士学位论文, 暨南大学, 广州. 2010]
[23] Aleksandra M L, Hillebrand H, Lengfellner K, et al. Temperature effects on phytoplankton diversity — The zooplankton link [J]. Journal of Sea Research, 2014, 85: 359—364
[24] Swiercowski A, Godlewska M, Poltorak T. The relationship between the spatial distribution of fish, zooplankton and other environmental parameters in the Solina Reservoir, Poland [J]. Aquatic Living Resources, 2000, 13: 373—377
[25] Yang Y F, Huang X F, Liu J K, et al. Effects of fish stocking on the zooplankton community structure in a shallow lake in China [J]. Fisheries Management and Ecology, 2005, 12(2): 81—89
[26] Korponai J, Matyas K, Paulovits G. The effect of different fish communities on the cladoceran plankton assemblages of the Kis-Balaton Reservoir, Hungary [J]. Hydrobiologia, 1997, 360: 211—221
[27] Huang X F, Hu C Y, Wu Z T. Rotifers in lake Donghu, wuhan [J]. Acta Hydrobiologica Sinica, 1985, 9(2): 129—143 [黄祥飞, 胡春英, 伍悼田. 武汉东湖的轮虫. 水生生物学报, 1985, 9(2): 129—143]
[28] Yang L L, Zhou X Y, Liu Q G, et al. Seasonal succession of crustacean zooplankton in relation to the major environmental factors in Lake Ulungur, Xinjiang [J]. Acta Ecologica Sinica, 2011, 31(15): 4468—4476 [杨丽丽, 周小玉, 刘其根, 等. 新疆乌伦古湖浮游甲壳动物的季节演替及与环境因子的关系. 生态学报, 2011, 31(15): 4468—4476]
[29] Cheng F, Ling Q f, Xu H J, et al. Assessment of water quality and the main pollutions of Taihu Lake [J]. Journal of Shanghai Ocean University, 2010, 19(1): 105—110 [成芳,凌去非, 徐海军, 等. 太湖水质现状与主要污染物分析.上海海洋大学学报, 2010, 19(1): 105—110]
[30] Wen X L, Xi Y L, Zhang L, et al. Analysis of community structure of rotifera and ecological assessment of water quality in lake Jinghu, Wuhu City [J]. Acta Hydrobiologica Sinica, 2006, 30(2): 152—158 [温新利, 席贻龙, 张雷, 等.芜湖市镜湖轮虫群落结构分析及水质的生态学评. 水生生物学报, 2006, 30(2): 152—158]
[31] Sun Z Q, Shi X L, Xu L L, et al. The protozoan community structure and its response to the change of water quality in typical wetland landscape in summer [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 290—299 [孙志强, 施心路, 徐琳琳, 等. 景观湿地夏季原生动物群落结构与水质关系. 水生生物学报, 2013, 37(2): 290—299]
[32] Liu C, Yu N, Chen L Q, et al. Zooplankton communities and bio-assessment of five rivers in the outskirts unit of southwest Shanghai [J]. Journal of Fudan University (Natural Science), 2007, 46(6): 913—919 [刘超, 禹娜,陈立侨, 等. 上海市西南城郊河道春季的浮游生物组成及水质评价. 复旦学报(自然科学版), 2007, 46(6): 913—919]
CHARACTERISTICS OF ZOOPLANKTON COMMUNITY IN HENGSHAN RESERVOIR AND WATER QUALITY ASSESSMENT
YANG Liang-Jie1, LÜ Guang-Han2, ZHU Jun-Quan1, XU Zhen1and JIN Chun-Hua1
(1. Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China; 2. Ningbo Raw Water Group Co., LTD. Hengshan Reservoir Branch, Ningbo 315211, China)
To evaluate tropic state and biotic community of Hengshan Reservoir, Zooplankton samples were collected with a plankton net in May (spring), July (summer), October (autumn) 2012 and January (winter) 2013, fixed with 5% formaldehyde, stored in plastic bottles and identified with a microscope. Biodiversity index and physicochemical index were utilized to assess the water quality of Hengshan Reservoir. A total of 100 zooplankton species (47 Protozoa, 36 Rotifera, 12 Cladocera and 5 Copepoda) were identified with the seasonal variation that 66 the zooplankton species were found in summer, 53 species in spring, and 15 species in winter. The dominant species were Anuraeopsis fissa, Polyarthra trigla, Brachionus diversicornis, Trichocerca similis, Tintinnopsis wangi, Tintinnidium fluviatile, Difflugia globulosa and Epistylis lacustris. The results of dominant seasons change rate (R) showed that the R value was the highest in winter-spring (100%), followed by summer-autumn (85.71%) and spring-summer (62.50%), and the lowest in autumn-winter (50.00%). The average annual abundance of the zooplankton was 1460 ind./L, ranged from 17 ind./L to 3164 ind./L, and the highest was in summer (2613 ind./L). The average annual biomass was 1.252 mg/L, ranged from 0.042 mg/L to 2.732 mg/L, and the highest one was in summer (1.728 mg/L). The mean value of Shannon index was 2.06, ranged from 0.88 to 3.21, generally lower in autumn and winter and higher in spring and summer. The annual average of Pielou index was 0.68, ranged from 0.37 to 0.96, the lowest in autumn and maximum in winter. The annual average of Margelef index was 1.30, ranged from 0.51 to 2.24, lower in autumn and winter and higher in spring and summer. According to the comprehensive trophic level index, the values of Hengshan Reservoir were varied from 33.36 to 44.15 with the average of 38.45. These results showed that environmental factor was significantly associated with zooplankton species composition, and the zooplankton community structure of Hengshan Reservoir was much affected by temperature and pH. Water quality evaluation indicated that Hengshan Reservoir was in secondary pollution and meso-trophic level.
CCA; Plankton; Community structure; Biodiversity; Water quality
Q145+.2
A
1000-3207(2014)04-0720-09
10.7541/2014.102
2013-11-04;
2014-02-28
宁波原水集团有限公司技术开发项目(HK11101); 浙江省水利科技计划项目(RC1322); 国家级星火计划项目(2011GA 701001); 宁波大学学科项目(xkl11088)资助
杨亮杰(1988—), 男, 浙江湖州人; 硕士研究生; 主要从事水库生态环境研究。E-mail: 930226331@qq.com
竺俊全, E-mail: zhujunquan@nbu.edu.cn; 金春华, E-mail: jinchunhua@nbu.edu.cn

