洱海鲢、鳙的食物组成及与太湖新银鱼的食性重叠研究
胡翠林王圣瑞过龙根谢 平
(1. 华中农业大学水产学院, 武汉 430070; 2. 中国科学院水生生物研究所东湖台站, 武汉 430072; 3. 中国环境科学研究院湖泊生态环境创新基地, 国家环境保护湖泊污染控制重点实验室, 北京 100012)
洱海鲢、鳙的食物组成及与太湖新银鱼的食性重叠研究
胡翠林1,2王圣瑞3过龙根2谢 平1,2
(1. 华中农业大学水产学院, 武汉 430070; 2. 中国科学院水生生物研究所东湖台站, 武汉 430072; 3. 中国环境科学研究院湖泊生态环境创新基地, 国家环境保护湖泊污染控制重点实验室, 北京 100012)
为了研究鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)两种鱼食物组成的空间变化, 分析了2010年7月至2011年10月在洱海古生和北部两采样点逐月采集或收集的共93尾鲢和71尾鳙的肠道内含物, 对其食物组成的季节变化、空间变化及与太湖新银鱼(Neosalanx taihuensis)的食物重叠进行了研究。结果表明, 鲢、鳙全年摄食的饵料生物数分别为 75 属和 64属。根据相对重要性指数(IRI%), 微囊藻(Microcystis)和 象鼻 溞(Bosmina)为两种鱼的主要饵料类群。鲢、鳙的食物组成呈明显的季节变化, 这与饵料生物的季节变化密切相关。在空间上, 两种鱼在古生摄食的浮游植物比例大于北部, 这是由不同区域饵料生物组成差异导致的结果。Schoener重叠指数显示鲢、鳙与太湖新银鱼之间的食性重叠不显著(E<0.6)。
洱海; 鲢; 鳙; 太湖新银鱼; 食物组成; 食性重叠
鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)由于其滤食性特点, 被证明可以控制藻类的过度生长[1]。近十多年来被引进到大量的湖泊、水库中用于改善水质[2]。20世纪60年代鲢、鳙作为经济鱼类被引进到洱海[3]。近几年, 由于洱海水质持续恶化, 鲢、鳙被大量投放到水体中用于水质治理及修复(洱海管理局)。
鲢、鳙作为我国湖泊、水库的重要放流鱼类, 有关其生物学及生态学效应有很多报道[4,5]。1982年陈少莲研究了东湖鲢、鳙的食物组成[6]。刘恩生等也先后对太湖、巢湖超富营养化水体中鲢、鳙的食性进行了报道[7,8]。但是针对富营养化初期条件下鲢、鳙的食性研究很少, 并且有关这两种鱼食物组成的季节变化及空间变化还未见报道。为了掌握这两种鱼在富营养化初期水体中的控藻能力及放养比例,了解它们的食物组成变化是有必要的。
为了提高鱼产量, 太湖新银鱼于1991年被成功引进到洱海[3]。目前太湖新银鱼和鲢、鳙是洱海最主要的经济鱼类。它们都摄食浮游动物且都栖息于水体中上层。目前有关这三种鱼的食物重叠还没有研究。为了探讨富营养化初级阶段鲢、鳙的食物组成及与太湖新银鱼的食物关系, 本文对洱海鲢、鳙食物组成的季节变化、空间变化及与太湖新银鱼的食物重叠程度进行了充分研究, 旨在为洱海湖泊渔业管理及生态修复提供理论依据。
1 材料与方法
1.1 样品的采集和鉴定
2010年7月至2011年10月, 用网目大小(1—5) cm 的刺网捕捞鲢、鳙, 在两种鱼类数量非常少的季节, 结合在沿湖主要村庄市场收购的鱼样品进行分析。其中 2011年 1月没有采集或收集到鲢样品, 2010年10月、2011年1月和2月没有采集或收集到鳙样品。为了比较不同区域鲢、鳙的食物组成, 于2011年5—10月在北部(1号点; 25°91′ N, 100°15′ E)和古生(2号点; 25°85′ N, 100°17′ E)采集鱼样品(图1)。每次当场对采集或收集到的鲢、鳙测量体长(精确到 1 mm)和体重(精确到1 g)。为了检测鲢、鳙肠含物组成, 每月随机选择鲢、鳙各3—7条进行解剖,取出前肠肠含物, 加 10%福尔马林溶液保存, 带回实验室分析。另外, 为了了解不同区域水体中饵料生物的组成情况, 于2011年7月采集鲢、鳙同时, 也对北部和古生浮游动、植物的生物量进行了调查。太湖新银鱼的采样时间是2009年9月至2010年10月, 用网目 6 mm的刺网逐月捕捞, 每次随机选取60—70条银鱼标本保存在 10%的福尔马林溶液中,带回实验室分析。
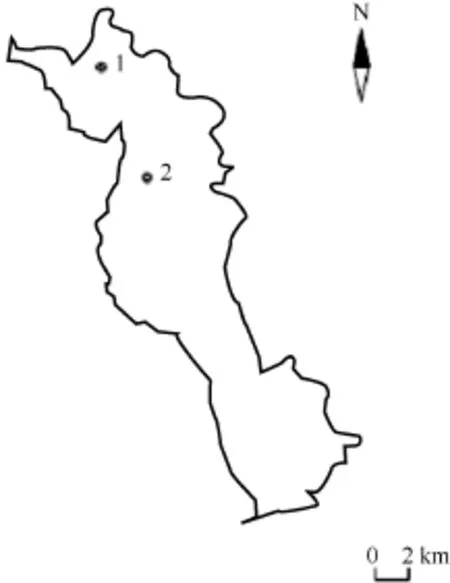
图1 洱海地图及采样点分布Fig. 1 Sketch map of Lake Erhai and the sampling stations
鲢、鳙肠含物浮游生物种类的计数鉴定方法参照Xie[9,10]和陈少莲[6], 取出少许前肠含物的样品用蒸馏水稀释至50 mL, 用磁力搅拌器充分混匀。取1 mL在1 mL计数框中于10×10倍显微镜下全片镜检计数浮游甲壳动物和轮虫, 枝角类和桡足类的残肢根据具体的大小估算成体个数; 浮游植物的定量计数是取相同的稀释液(如藻类密度依然很大, 按比例再进行稀释)0.1 mL于0.1 mL的计数框中置10×40倍显微镜下计数, 每片计数100个视野。各浮游动物和浮游植物的生物量比例根据相应计数的密度和稀释的比例换算得出。太湖新银鱼由于个体较小, 取出全部肠含物在显微镜下计数。所有肠含物都是鉴定到属。
1.2 数据处理
食物组成使用出现率F%, 数量百分比N%, 重量百分比 W%, 相对重要性指数 IRI%表示, 计算公式如下:
出现率F% =(某种食物在消化道中出现的次数/具有食物的消化道总数)×100%。
数量百分比N% =(消化道中某食物的个数/消化道中全部食物的总个数)×100%。
重量百分比 W% =(消化道中某食物的重量/所有食物的重量)×100%。
重要性指数 IRI = F% (N%+W%), 相对重要性指数IRI% =(IRI / ∑IRI)× 100[11—13]。
使用 Schoener 重叠指数(E)[14]计算鲢、鳙分别与太湖新银鱼之间食物组成的重叠程度, E值范围为0—1, 当E > 0.6表示显著性重叠。
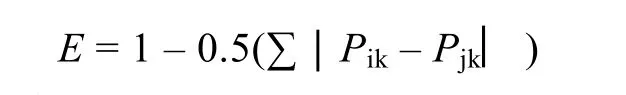
式中, E为食物重叠程度, Pik和Pjk分别代表饵料生物 k 在鱼类 i和 j的肠含物中所占的比例(采用IRI%)。在缺少有关饵料资源的定量数据的情况下,这个指数是最适合于鱼类之间的饵料重叠的[15]。
本文采用 PRIMER 5.0 进行聚类分析, 并以相似性系数70%为标准来研究各月份鲢、鳙食物组成的Bray-Curtis相似性指数[16]。
2 结果
试验期间共采集或收集到鲢样本93尾, 鳙样本71尾。样本体长鲢(20.34—46.31) cm, 平均29.96 cm,鳙(23.50—43.10) cm, 平均 31.81 cm; 体重鲢(153.80—1750) g, 平均527.68 g, 鳙(252.20—1630) g, 平均705.53 g。
2.1 食物组成
鲢 如表 1所示, 肠道中出现的浮游植物隶属7门59属, 其中蓝藻门 10属, 绿藻门29属, 硅藻门14属, 黄藻门1属, 金藻门1属, 裸藻门1属,甲藻门3属。出现的浮游动物有枝角类、桡足类和轮虫, 其中枝角类6属, 桡足类3属, 轮虫7属。
从数量百分比看, 蓝藻门的微囊藻比值最高,占食物总数的 64.85%, 其次是绿藻门的暗丝藻, 比值为 11.65%, 浮游动物比值较低, 不到 10.00%; 与数量百分比相反, 鲢肠含物重量百分比显示浮游动物占绝对优势, 以枝角类的象鼻 溞 属和 溞属比值最高, 分别占肠道内含物总重量的 54.32%和 20.80%;所有的鲢肠道中都发现有微囊藻, 出现率为 100%,其次为象鼻 溞(97.85%)和龟甲轮虫(90.32%); 从相对重要性指数看, 蓝藻门的微囊藻比值最高, 占45.75%, 其次为枝角类的象鼻 溞, 占34.87%, 桡足类和轮虫比值非常低, 分别只有0.53%和1.60%。
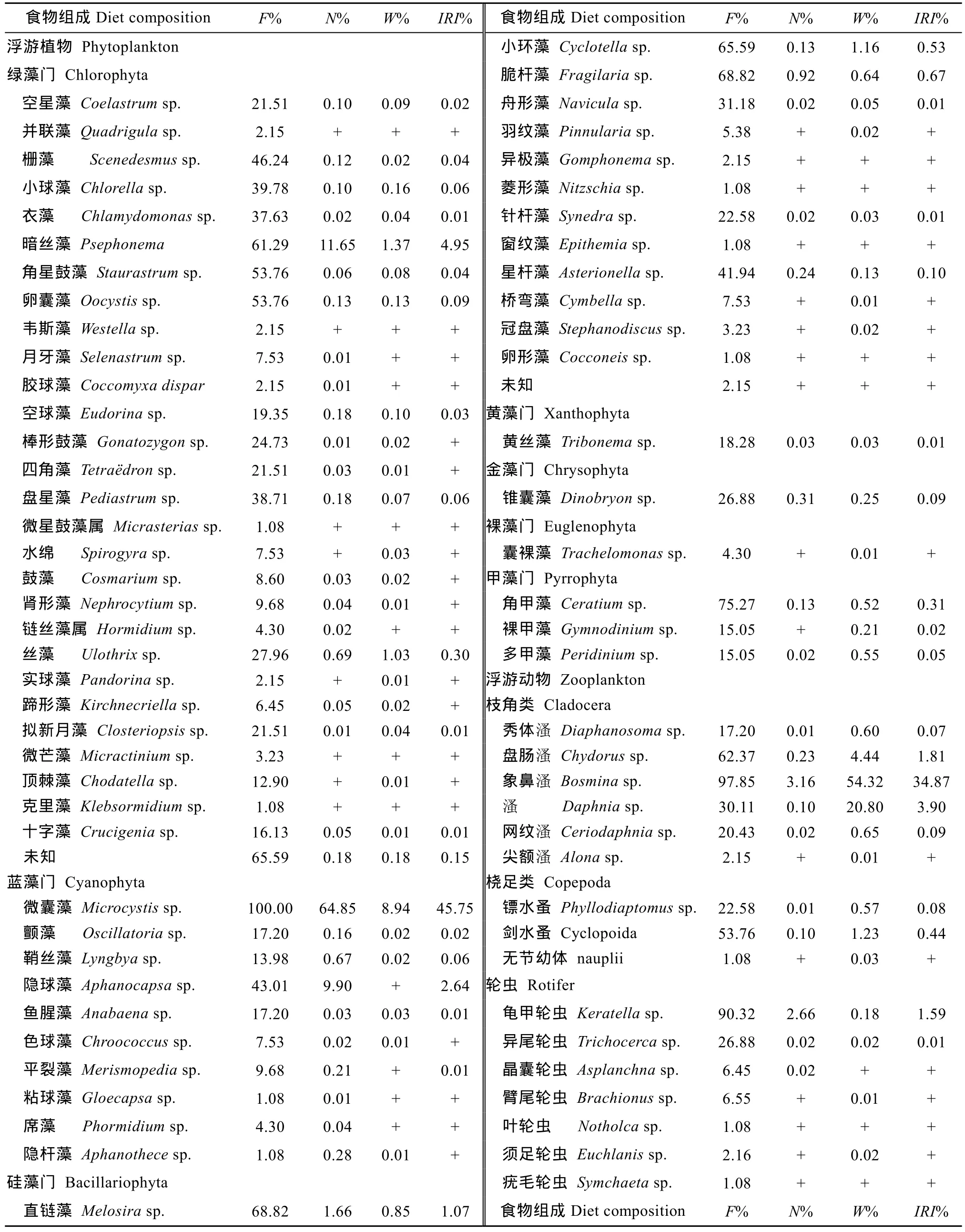
表1 鲢的食物组成Tab. 1 Diet compositions of H. molitrix
鳙 如表 2所示, 鳙肠道中出现的浮游植物种类数略少于鲢, 共有藻类7门51属, 包括蓝藻门9属, 绿藻门28属, 硅藻门9属, 黄藻门1属, 金藻门1属, 裸藻门1属, 甲藻门2属。浮游动物有枝角类7属, 桡足类3属, 轮虫3属。
与鲢的食物组成有所不同, 鳙肠含物中数量百分比最高的是蓝藻门的微囊藻(68.51%), 其次是枝角类的象鼻 溞(12.22%); 与鲢相似, 鳙肠道中食物的重量百分比以浮游动物占主导地位, 总比值为 95.89%, 其中枝角类的象鼻 溞最高, 为62.55%, 其次是溞(14.01%)和 盘肠 溞(13.42%); 相对重要性指数以象鼻溞和微囊藻最高, 分别为42.07%和41.05%。

表2 鳙的食物组成Tab. 2 Diet compositions of A. nobilis
2.2 食物组成的季节变化
鲢 以相似系数 70%为标准, 聚类分析将鲢15个月份的食物组成分为4个组(图 2)。第1组是3月, 肠含物组成以枝角类为主; 第2组是2月和12月, 食物组成以硅藻门和枝角类为主; 第 3组是4—6月, 鲢主要摄食蓝藻门、绿藻门、金藻门和枝角类食物; 第4组是7—11月, 鱼类以蓝藻门、枝角类或绿藻门为主要食物来源(图 3)。
鳙 聚类分析表明, 以相似系数 70%为标准时, 鳙 12个月份的食物组成可分为 2个组(图4)。一组是3—4月, 肠含物主要以枝角类为主; 另一组是其他所有月份, 鱼类主要摄食枝角类和蓝藻门种类 (2011年10月主要摄食枝角类和绿藻门种类) (图 5)。
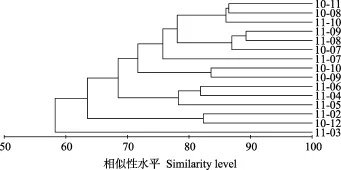
图2 鲢各月份食物组成的聚类分析图Fig. 2 Dendrogram of the cluster analysis on the monthly dietary composition of H. molitrix
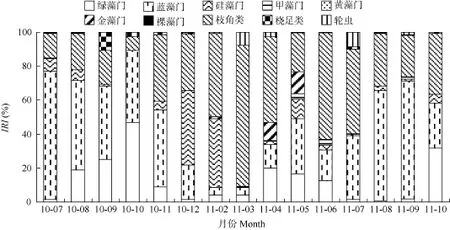
图3 不同月份鲢食物的组成比例Fig. 3 Proportion of food composition of H. molitrix in different months

图4 鳙各月份食物组成的聚类分析图Fig. 4 Dendrogram of the cluster analysis on the monthly dietary composition of A. nobilis
2.3 食物组成及饵料分布的空间比较
在两不同的区域, 鲢的食物都是以浮游动物为主, 在古生摄食的浮游动物重量占食物总重量的73.23%, 北部的为89.11%。在古生摄食的浮游植物比例显著大于北部。与鲢相似, 鳙在这两个区域也是以浮游动物为主要食物来源, 在古生摄食的浮游植物比例高于北部, 但没有鲢明显 (图 6、图7)。
古生总的浮游植物生物量大于北部, 但蓝藻生物量不到北部的一半。与浮游植物相反, 北部的浮游动物生物量远远高于古生, 主要表现在象鼻 溞、盘肠 溞等小型种类(表 3)。
2.4 鲢、鳙分别与太湖新银鱼的食物重叠
太湖新银鱼主要摄食大型浮游动物, Daphnia比值最高, 占47.83%, 其次是镖水蚤(19.62%)和 秀体溞(11.72%)。 小型 溞比例较低, 如盘肠 溞 和网纹 溞的比例分别只有0.35%和1.64%。根据三种鱼的食物组成比例(IRI%)计算 Schoener重叠指数, 结果表明鲢-银鱼的食性重叠不显著(重叠系数 E=0.44); 鳙-银鱼的食性重叠指数也未达到显著水平(重叠系数E=0.37)。
3 讨论

图5 不同月份鳙食物的组成比例Fig. 5 Proportion of food composition of A. nobilis in different month
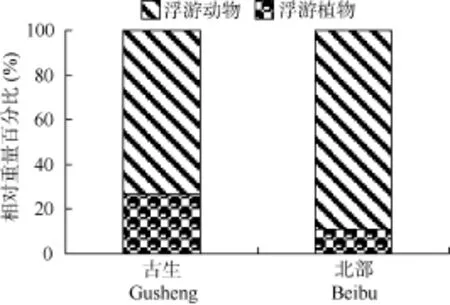
图6 不同区域鲢肠含物中浮游动、植物比例Fig. 6 Phytoplankton and zooplankton components in the gut content of H. molitrix in different regions

图7 不同区域鳙肠含物中浮游动、植物比例Fig. 7 Phytoplankton and zooplankton components in the gut content of A. nobilis in different regions
本研究结果表明, 数量百分比上鲢的食物以蓝藻门为主, 其次是绿藻门和枝角类; 鳙的食物也以蓝藻门为主, 其次是枝角类。重量百分比上鲢主要摄食枝角类, 其次是蓝藻门种类; 而鳙肠含物中以枝角类占绝对优势, 百分比达92.79%。这与前人的研究结果不同, 例如, 在太湖, 微囊藻在鲢、鳙食物中的体积比例超过 90%; 在巢湖, 鲢、鳙食物中微囊藻的数量百分比和重量百分比都在95%以上[7,8]。这是因为太湖和巢湖都是超富营养化水体, 水中浮游植物种类比较单一, 大多为微囊藻。而洱海还处于富营养化初级阶段, 水中除微囊藻外, 还有比较多的绿藻门、硅藻门及枝角类种类。
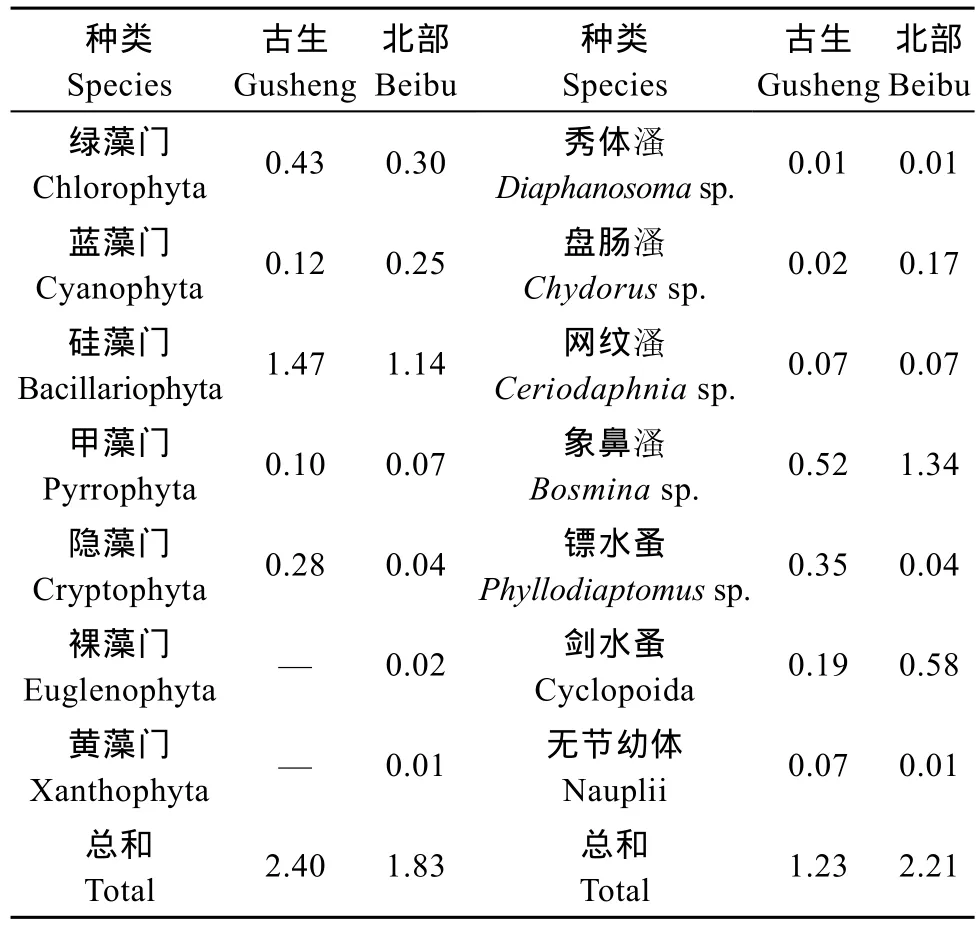
表3 七月份洱海不同区域饵料生物量Tab. 3 Biomass of food resources in different regions in Lake Erhai (mg/L)
许多研究都表明, 鱼类食物组成的季节变化与生活水域的饵料季节变化密切相关[17,18]。我们的研究结果也证实了这一点, 例如, 夏、秋季微囊藻、象鼻 溞和盘肠 溞在食物中比例显著上升, 与此时期水温升高, 这三种种类在洱海水体中占优势有关。
鲢、鳙鱼食物组成还因区域的不同而有差异。古生的鲢比北部的鲢摄食的浮游植物比例要高, 鳙也是同样情况。洱海北部富营养化程度较严重, 微囊藻生物量比古生高[19]。但本次调查结果发现, 古生水体中总的浮游植物生物量比北部高, 主要表现在绿藻门、硅藻门和甲藻门等。其次, 北部浮游动物生物量显著高于古生, 主要表现在小型 溞类, 例如象鼻 溞、盘肠 溞和剑水溞。这种饵料组成的差异使得古生的鲢、鳙肠含物中浮游植物比例高于北部, 而浮游动物比例又低于北部。这种鱼类食物组成的区域差异, 是不同区域饵料生物组成差异导致的结果[17]。
鲢、鳙和太湖新银鱼都是洱海最重要的经济鱼类。虽然它们都属于浮游生物食性鱼类, 但从本研究的食物重叠系数结果看, 鲢、鳙与太湖新银鱼的食性重叠均没有达到显著水平。这可能与它们的摄食方式不同有关。研究表明, 鲢、鳙是滤食性鱼类,无直接选择饵料生物的能力[20], 摄取的食物主要取决于水体中饵料生物的变化。虽然也有部分学者认为鲢、鳙对食物有主动选择能力[21], 但是这种选择能力非常弱[22]。与鲢、鳙不同, 太湖新银鱼属于视觉性摄食鱼类, 主动捕食大型浮游动物[23,24]。这从本研究结果也能得到证实。但太湖新银鱼在大型浮游动物不足时会转向摄食小型浮游动物[25]。所以本研究中鲢、鳙和太湖新银鱼食物重叠系数较小, 另一原因是洱海目前处于富营养化初级水平, 水体中还存在有大量的大型浮游动物。我们认为, 假如未来洱海水质继续恶化, 达到富营养化水平后, 鲢、鳙鱼的食物组成绝大部分(可能 90%以上)为微囊藻,太湖新银鱼的食物组成主要为小型浮游动物, 其食物重叠性会继续下降。
[1] Xie P, Liu J C. Practical success of biomanipulation using filter-feeding fish to control cyanobacteria blooms [J]. The Scientific World Journal, 2001, 1: 337—356
[2] Liu M, Xu M X, Xu D L, et al. Status quo and progress in research and application on nonclassical biomanipulation of silver carp and bighead carp [J]. Journal of Hydroecology, 2010, 3(3): 99—103 [刘敏, 徐敏娴, 许迪亮, 等. 鲢、鳙非经典生物操纵作用的研究进展与应用现状. 水生态学杂志, 2010, 3(3): 99—103]
[3] Du B H, Li Y A. Danger risk to fish diversity in Erhai Lake and proposals to dispel it [J]. Research of Environmental Sciences, 2001, 14(3): 42—44 [杜宝汉, 李永安. 洱海鱼类多样性危机及解危对策环境科学研究. 环境科学研究, 2001, 14(3): 42—44]
[4] Zhao B L, Li D M, Zou G Z, et al. The age and growth of silver carp and bighead carp in Hongqi Reservoir [J]. Heilongjiang Fisheries, 1999, 2: 21—24 [赵宝林, 李德明,邹桂芝, 等. 红旗泡水库鲢鳙鱼的年龄与生长. 黑龙江水产, 1999, 2: 21—24]
[5] Chen L J, Mei Z, Kong Y J, et al. The influences of silver carp and bighead carp in bio-manipulation pen on the community structure of cladocera in Lake Gehu [J]. Journal of Fisheries of China, 2013, 37(4): 545—555 [陈立婧, 梅榛,孔优佳, 等. 滆湖控藻网围中鲢鳙对枝角类群落结构的影响. 水产学报, 2013, 37(4): 545—555]
[6] Chen S L. Feeding habits of stocking silver carp and bighead carp in Lake Donghu [J]. Reservoir Fishery, 1982, 3: 21—26 [陈少莲. 东湖放养鲢、鳙鱼种的食性分析. 水库渔业, 1982, 3: 21—26]
[7] Liu E S, Bao C H, Yang Q C. Analysis on the diet contents of Hypophthalmichthys molitrix and Aristichthys nobilos under eutrophication in Chaohu Lake [J]. Journal of Hydroecology, 2009, 2(3): 27—31 [刘恩生, 鲍传和, 杨启超. 巢湖鲢、鳙在富营养化条件下的食物组成分析. 水生态学杂志, 2009, 2(3): 27—31]
[8] Liu E S, Bao C H, Cao P, et al. Food composition of silver carp and bighead carp and the analysis on changes of fish catch in Lake Taihu [J]. Reservoir Fisheries, 2007, 27(4): 72—74 [刘恩生, 鲍传和, 曹萍, 等. 太湖鲢、鳙的食物组成及渔获量变化原因分析. 水利渔业, 2007, 27(4): 72—74]
[9] Xie P. Gut contents of silver carp, Hypophthalmichthys molitrix, and the disruption of a centric diatom, Cyclotella, on passage through the esophagus and intestine [J]. Aquaculture, 1999, 180: 295—305
[10] Xie P. Gut contents of bighead carp (Aristichthys nobilis) and the process and digestion of algal cells in the alimentary canal [J]. Aquaculture, 2001, 195: 149—161
[11] Hyslop E. Stomach contents analysis-a review of methods and their application [J]. Journal of Fish Biology, 1980, 17: 411—429
[12] Bowen S H. Quantitative description of the diet [A]. In: Nielsen L A, Johnson D L (Eds.), Fisheries techniques [C]. Bethesda: American Fisheries Society. 1983, 325—336
[13] Pinkas L, Oliphant M S, Iverson I L K. Food habits of albacore, bluefin tuna and bonito in California waters [J]. California Fish and Game, 1971, 152: 1—105
[14] Schoener T W. Non-synchronous spatial overlap of lizards in patchy habitats [J]. Ecology, 1970, 51: 408—418
[15] Wallace R K. An assessment of diet-overlap indexes [J]. Transactions of the American Fisheries Society, 1981, 110: 72—76
[16] Zhang B, Jin X S, Dai F Q. Feeding habits and their variation of seasnail (Liparis tanakae) in the central and southern Yellow Sea [J]. Journal of Fisheries of China, 2011, 35(8): 1199—1206 [张波, 金显仕, 戴芳群. 黄海中南部细纹狮子鱼的摄食习性及其变化. 水产学报, 2011, 35(8):1199—1206]
[17] Li Z H, Xu K D, Jiang R J, et al. Seasonal variation of food habits of Chelidonichthys spinosus in the middle-northern East China Sea [J]. Marine Fisheries, 2010, 32(2): 192—198 [李振华, 徐开达, 蒋日进, 等. 东海中北部小眼绿鳍鱼食性的季节变化. 海洋渔业, 2010, 32(2): 192—198]
[18] Yuan G, Ru H J, Liu X Q. Feeding habits of Pelteobagrus nitidus in Lake Dongting [J]. Acta Hydrobiologica Sinica, 2011, 35(2): 270—275 [袁刚, 茹辉军, 刘学勤. 洞庭湖光泽黄颡鱼食性研究. 水生生物学报, 2011, 35(2): 270—275]
[19] Yang W, Deng D G, Zhang S, et al. Seasonal dynamic and spatial distribution of chlorophyll-a concentration in Lake Erhai [J]. Journal of Lake Sciences, 2012, 24(6): 858—864 [杨威, 邓道贵, 张赛, 等. 洱海叶绿素 a浓度的季节动态和空间分布. 湖泊科学, 2012, 24(6): 858—864]
[20] Xie P. Silver Carp and Bighead, and Their Use in the Control of Algal Blooms [M]. Beijing: Science Press. 2003, 71—74 [谢平, 鲢、鳙与藻类水华控制. 北京: 科学出版社. 2003, 71—74]
[21] He Z H. The biomass of plankton in freshwater — improving the quantitative work of plankton [J]. Chinese Journal of Zoology, 1979, 4: 53—56 [何志辉. 淡水浮游生物的生物量——改进浮游生物定量工作的当务之急. 动物学杂志, 1979, 4: 53—56]
[22] Ke Z X. Ecological studies on food habits of two biomanipulation fish, silver and bighead carp, in large pens with their effects on water quality and plankton communities [D]. Thesis for Doctoral of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2008 [柯志新. 太湖梅梁湾生物控藻围栏内鲢、鳙摄食生态学和控藻效果的研究. 博士学位论文, 中国科学院水生生物研究所, 武汉. 2008]
[23] Liu Z W, Zhu S Q. Food and feeding behavior of icefish (Neosalanx taihuensis Chen) in Dianchi Lake [J]. Acta Zoologica Sinica, 1994, 40(3): 253—261 [刘正文, 朱松泉.滇池产太湖新银鱼食性与摄食行为的初步研究. 动物学报, 1994, 40(3): 253—261]
[24] Yin G J, Cao K J, Yu Z T, et al. The reproduction, feeding habits and growth of Salangid fishes Neosalanx taihuensis and Neosalanx oligodontis in Wanghu Lake [J]. Journal of Lake Science, 1997, 9(1): 63—70 [殷国俊, 曹克驹, 余志堂, 等. 网湖银鱼的繁殖、食性与生长. 湖泊科学, 1997, 9(1): 63—70]
[25] Qin J H. Ecological Effects of the Invasive Icefish Neosalanx taihuensis in a deep oligotrophic plateau lake, Lake Fuxian [D]. Thesis for Doctoral of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2005 [覃剑晖. 太湖新银鱼入侵高原深水贫营养湖泊-抚仙湖生态学研究. 博士学位论文, 中国科学院水生生物研究所, 武汉. 2005]
FOOD COMPOSITON OF HYPOPHTHALMICHTHYS MOLITRIX AND ARISTICHTHYS NOBILIS AND THE DIET OVERLAP WITH NEOSALANX TAIHUENSIS IN LAKE ERHAI
HU Cui-Lin1,2, WANG Sheng-Rui3, GUO Long-Gen2and XIE Ping1,2
(1. College of Fishery, Huazhong Agricultural University, Wuhan 430070, China; 2. Donghu Experimental Station of Lake Ecosystems, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 3. State Environmental Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-Environment, Chinese Research Academy of Environment Sciences, Beijing 100012, China)
To study the spatial and seasonal variations of food composition of Hypophthalmichthys molitrix and Aristichthys nobilis and the diet overlap with Neosalanx taihuensis, gut contents of 93 Hypophthalmichthys molitrix and 71 Aristichthys nobilis in Lake Erhai were collected from July 2010 to October 2011. The results showed that 75 and 64 genus of preys ingested by H. molitrix and A. nobilis, respectively. Microcystis and Bosmina sp. were the dominant preys of the two fish species based on the index of relative importance (IRI%). The seasonal variations of food composition of the two fishes were significant, which were closely related to the variations of food resources in the area. The proportion of phytoplankton ingested by H. molitrix and A. nobilis in Gusheng was greater than those in northern Erhai, which resulted from the different food compositions in these two regions. The Schoener overlap index revealed no significant dietary overlap between the two fish species and N. taihuensis (E<0.6).
Erhai; Hypophthalmichthys molitrix; Aristichthys nobilis; Neosalanx taihuensis; Food composition; Diet overlap
Q959.4
A
1000-3207(2014)04-0706-08
10.7541/2014.100
2013-06-07;
2013-12-09
国家水体污染控制与治理科技重大专项(2012ZX07105-004); 国家自然科学基金项目(40703017, 40873079)资助
胡翠林(1985—), 女, 安徽安庆人; 博士研究生; 主要研究方向为水生生物学。E-mail: hcl0106@163.com
谢平, E-mail: xieping@ihb.ac.cn

