磁珠富集法筛选兰州鲇微卫星分子标记
魏大为连总强吴旭东王发新肖 伟张利平
(1. 甘肃农业大学动物科学技术学院, 兰州 730070; 2. 宁夏回族自治区水产研究所, 银川 750001; 3. 宁夏渔业工程技术研究中心, 银川 750001)
磁珠富集法筛选兰州鲇微卫星分子标记
魏大为1,2,3连总强1,2,3吴旭东1,2,3王发新1,3肖 伟2,3张利平1
(1. 甘肃农业大学动物科学技术学院, 兰州 730070; 2. 宁夏回族自治区水产研究所, 银川 750001; 3. 宁夏渔业工程技术研究中心, 银川 750001)
兰州鲇(Silurus lanzhouensis)又名黄河鲶, 隶属于鲇形目(Siluriformes)、鲇科(Siluridea)、鲇属(Silurus), 是我国黄河中上游特有的大型经济鱼类。肉质细嫩、少刺、味道鲜美, 具有很高的营养价值, 俗有“黄河鲶鱼活人参”之称[1]。但由于过度捕捞、水利工程等因素, 兰州鲇野生种群数量日益减少, 已被《中国物种红色名录》列为濒危物种[2]。
微卫星(Microsatellite)是一类广泛存在于真核生物基因组中具有高度变异性的简单重复DNA序列[3], 它们多以2—6个碱基序列为核心单位, 串联排列, 序列长度为几十至几百个碱基[4]。由于微卫星具有共显性、多态性丰富、杂合度高、基因型可快速简便检测等优点[5], 目前广泛应用于物种遗传结构研究[6,7]、遗传多样性分析[8]、遗传图谱构建[9]和QLT定位分析[10]等领域。
2003年宁夏回族自治区水产研究所攻克兰州鲇人工繁育技术难题, 已是具有规模化兰州鲇繁育能力的国家级现代种业示范场, 促进了这一特有、珍稀鱼类资源保护和大面积养殖。但目前所养殖的兰州鲇绝大部分是未经选育的自然群体, 遗传分化较大, 个体生长差异大, 对养殖环境适应性差。因此, 充分了解兰州鲇种群结构、遗传多样性现状, 开展种质资源保护和人工选育工作十分必要。目前, 关于兰州鲇的研究主要集中在苗种繁殖、生理生化、营养需求、毒理抗性等方面[11—13], 利用分子标记方法对其种群结构、遗传多样性的研究较少。本研究应用磁珠富集法筛选兰州鲇微卫星分子标记, 旨在为开展兰州鲇种质资源保护、遗传图谱构建及人工选育等工作提供理论依据。
1 材料与方法
1.1 实验材料
采集宁夏回族自治区水产研究所全国现代渔业种业示范场(106°22′2″ E, 38°34′ 47″ N)30尾兰州鲇尾鳍样本, 无水乙醇–20℃保存。接头序列(MseI A: 5′-TACTCAGGACTC AT-3′; MseI B: 5′-GACGATGAGTCCTGAG-3′)、MseI-N引物(5′-GATGAGTCCTGAGTAA (N) -3′)、生物素标记探针(AC)12、(AG)12、(ATC)8、(AAAC)8、(AGAT)8均由上海生物工程有限公司合成, pMD19-T载体、链霉亲和素磁珠购自promega公司, 感受态细胞E.coli DH5α为宁夏水产研究所实验室保存。
1.2 特定大小DNA片断筛选
采用苯酚-氯仿法提取兰州鲇基因组DNA, 取20 μL 100 ng/μL基因组DNA加入5 U的内切酶MseI 37℃、酶切3.5h, 1.8%琼脂糖凝胶电泳回收200—800 bp DNA片段。将终浓度为20 μmol/L的MseI A和MseI B接头等比例混合, 94℃变性8min, 缓慢降至室温制备成连接接头; 连接酶切回收片段, 16℃过夜, 连接混合液稀释1/10倍, 以MseIN为引物PCR预扩增, 获取特定大小DNA片段。
1.3 生物素探针杂交
取上述PCR产物24 μL, 94℃下变性8min, 加入70 μL 65℃杂交缓冲液6×SSC+0.1%SDS和6 μL生物素标记探针, 65℃反应30min, 冷却至室温加入300 μL TEN100buffer混匀, 4℃保存。
1.4 磁珠富集
取1—2 mg链霉亲和素磁珠, 加入300 μL TEN100buffer室温洗涤3次, 每次3min。磁力架固定磁珠弃去上清液,用60 μL TEN100buffer重悬磁珠后加入杂交液, 室温反应30min, 待磁珠吸附完毕, 固定磁珠移去杂交混合液。300 μL TEN1000室温洗涤3次, 洗去与磁珠非特异性结合的DNA片段, 再用300 μL的0.2×SSC+0.1%SDS室温洗涤磁珠3次。最后加入80 μL TE, 94℃变性8min, 固定磁珠吸取上清液, 获取单链目的DNA片段。
1.5 单链DNA片段PCR扩增
以单链目的DNA片段为模板, PCR扩增获得双链目的DNA片段。PCR反应体系20 μL: MseI-N引物
(10 μmol/L) 1 μL, 10×Buffer(含Mg2+) 2 μL, dNTPs
(10 μmol/L) 1.6 μL, 模板DNA 20 ng, Taq聚合酶(5 U/μL) 0.2 μL, 去离子水10.2 μL。PCR反应条件为: 94℃预变性3min, 94℃变性1min, 53℃退火1min, 72℃延伸1min, 经N(N=25、30、34、36)个循环, 确定最佳循环次数。72℃延伸5min, 扩增产物4℃保存。
1.6 T-载体连接、转化与阳性克隆筛选
PCR产物回收纯化, 连接到pMD19-T载体中, 转入大肠杆菌DH5α菌株, 涂布于含Amp的LB固体培养基上, 构建兰州鲇微卫星富集文库。富集文库经蓝白斑筛选, 挑取阳性克隆至含有Amp的LB液体培养基37℃过夜。以菌液为模板, 以M13(+)、M13(–)通用引物和不含有生物素的探针序列作为双引物进行PCR扩增, 扩增产物经琼脂糖电泳检测, 挑取目的条带(100—800 bp)中含有两条或两条以上条带的阳性克隆测序。
1.7 引物设计、筛选与多态性分析
测序结果用软件 MEGA4.0构建系统发育树去掉同源序列; 用 SSRHunter设定参数(重复元件的核苷酸数最多为6个, 最少重复次数为4次), 查找微卫星序列, 并人工检查核对后提交 GenBank; 挑选两侧翼区均足够长的微卫星序列, 设计引物进行PCR扩增。PCR反应体系25 μL: 10×Buffer(含Mg2+)3.0 μL, dNTPs(10 μmol/L)2.0 μL, 模板DNA 20 ng, 上游、下游引物(10 μmol/L)各0.5 μL, Taq聚合酶(5 U/µL)0.2 µL, 无菌超纯水补足总体积至25 μL。PCR反应程序: 94℃预变性5min, 94℃变性30s, 退火30s,退火温度依引物而异, 72℃延伸1min, 34个循环; 72℃延伸10min, 4℃保存。扩增产物先经琼脂糖凝胶法检验, 再用8%聚丙烯酰胺凝胶银染法检测, 利用pBR322显示微卫星条带的大小。利用Popgene version1.32(http//genepop. curtin.edu.au/)统计各微卫星标记等位基因的数目、基因杂合度和多态信息含量。
2 结果
2.1 微卫星片段富集
本研究选用内切酶 MseI对基因组 DNA进行酶切,酶切片段均匀弥散, DNA已完全被酶切。PCR预扩增特定DNA片段在30个循环后电泳检测, 结果显示在200—800 bp处出现Smear区域(图1), 说明可满足构建微卫星DNA文库的需要。

图1 基因组DNA、酶切与预扩增产物电泳结果Fig.1 The electrophoresis of genomie DNA, digested by enzyme MseI and PCR amplification

图2 PCR扩增单链目的片段不同循环次数电泳结果Fig. 2 The electrophoresis by different PCR cycles
以MseI-N为引物, 分别设置单链目的DNA片段25、30、34和 36个循环扩增, 结果显示 36个循环获得双链目的片段效果最佳。亲和捕捉的目的片段主要集中在200—500 bp左右, 而800 bp以上的较少, 与酶切回收片段基本相符(图2)。将富集的微卫星DNA片段与pMD19-T载体连接, 转化至大肠杆菌DH5α菌株进行克隆, 经蓝白斑初步筛选获得含有微卫星序列(电泳结果是两条或者两条以上的条带)的500个阳性克隆(图3), 随机选取300个克隆测序分析。

图3 微卫星序列阳性克隆电泳检测结果Fig. 3 Representing recombined positive clones containing microsatellite sequence
2.2 微卫星富集文库鉴定
测序结果依据 Linda,et al.[14]关于微卫星划定标准进行微卫星文库鉴定, 结果显示 158个(52.7%)克隆符合微卫星界定标准, 序列比对去掉同源序列共获得 121个微卫星序列(GenBank 中序列登录号: KJ008462-KJ008582)。依据Weber[5]制定的标准, 121个微卫星序列中完美型62个(51.2%)、非完美型27个(22.3%)、混合型为 32个(26.5%)(图 4); 重复次数主要分布在 16—20次,重复30次以下的比例为80.16%(图5)。
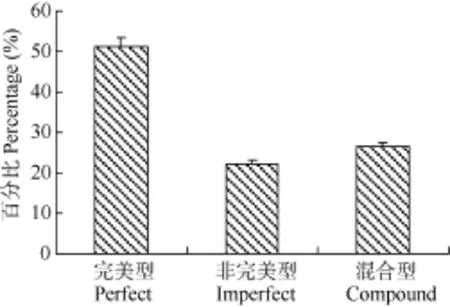
图4 兰州鲇微卫星序列特征分布Fig. 4 Characteristic of microsatellite types in S. lanzhouensis
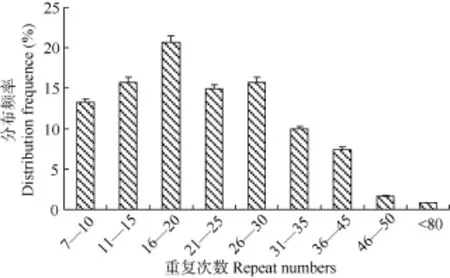
图5 兰州鲇微卫星重复次数的频率分布Fig. 5 Percentage of microsatellite repeat numbers in S. Lanzhouensis
2.3 微卫星标记筛选与多态性分析
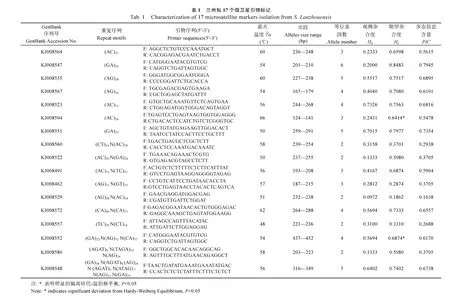
根据侧翼序列长短, 在 121个微卫星序列中共设计出90对引物。随机选取其中 30对, 进行兰州鲇微卫星标记位点筛选与多态性分析。30个兰州鲇试验样本中筛选出 17对多态性引物, 每对引物等位基因数(Na) 2—6个(平均 3.47), 观测杂合度(Ho) 0.0972—0.7326(平均 0.4118), 期望杂合度(He)0.1862—0.8483(平均0.6103), 多态信息含量(PIC) 0.1638—0.7945(平均0.5345), 详见表1。
3 讨论
磁珠富集法制备微卫星文库具有快速、便捷、效率高、成本低、所获微卫星质量高等特点, 是一种值得推荐的微卫星制备方法[15]。但是操作过程中的一些因素会影响筛选微卫星的效率, 优化亲和素磁珠与生物素探针-微卫星复合体的吸附条件, 使其高效捕捉是构建文库的关键。磁珠的平衡、洗涤时间和洗涤温度都要严格控制, 整个操作过程要轻柔, 以达到最佳的分离效率。
Kruglyak, et al.[16]的研究发现, 在大多数真核生物中微卫星重复单元主要是二核苷酸(AC/TG)n, 两碱基重复序列类型的多态性最高, 其次为三碱基, 再次为四碱基。李齐发等[17]选择(CA)12、(CAG)8、(CCG)8和(TTTC)8探针富集牦牛(Bos grunniens)微卫星, Barker, et al.[18]以(CT)n、(AG)n、(CA)n、(AAT)n和(ATT)n探针富集黄花柳(Salix burjatica)微卫星, 鲁翠云等[19]选择(CA)15、(AG)12、和(AAG)8探针富集鳙鱼(Aristichthys nobilis)微卫星, 刘臻等[20]以(AC)8、(CT)8、(AT)7、(GATA)8和(GATT)7探针富集黄颡鱼(Pseudobagrus fulvidraco)微卫星, 本研究用(AC)12、(AG)12、(ATC)8、(AAAC)6和(AGAT)6混合探针富集兰州鲇微卫星, 均成功筛选到各种类型的多态性微卫星标记。因此在今后的研究中使用多种探针来筛选增加微卫星种类是可行的。
本研究筛选到的微卫星序列, 除探针使用的 AC、AG、ATC、AAAC和AGAT重复单元外, 还发现GTCT、TTCT、TTCC、TGTC、CTCA、TTTC重复序列的微卫星类型。121个微卫星序列中完美型62个(51.2%)、非完美型 27个(22.3%)、混合型为 32个(26.5%); 这一结果与白鲢(Hypophthalmichtys molitrix)[21]、哲罗鱼(HuchotaiMen Pallas)[22]、黄颡鱼(Pseudobagrus fulvidraco)[20]以及大黄鱼(Pseudosciaena croce)[23]的微卫星序列特点基本相符, 其中兰州鲇微卫星中, 非完美型和混合型比例略高; Santibanez, et al.[24]研究表明生物生存环境的变化会导致其微卫星重复次数和长度发生变化, 当生态环境适宜于其生存发展时,复制滑移(Replication slippage)频率较高, 使微卫星重复次数增加、长度变长, 完美型比列较高。当生态环境不适宜于其生存发展时, 点突变频率较高, 使微卫星重复序列中断, 阻碍长度增加, 非完美型比列增加。本次研究筛选到的兰州鲇非完美型和混合型微卫星序列较为丰富,造成这一结果的原因可能与兰州鲇的进化及环境变迁有关; 有学者认为鲶类祖先为早白垩纪时鼠目(Gonorynchiformes), 经晚白垩纪复杂的地理变迁, 鼠目衍生出原始的鲤类和鲶类, 并独立分化形成了若干不同的类群,逐渐从非洲向欧亚大陆扩展, 经过很长的一段时间后, 新的类群和新种又不断分化出来。在较近的地质时期, 鲶科的鲶属似乎在我国的西南地区发生过更次级的分化[25,26]。这一系列自然环境的变迁及人为因素, 使兰州鲇栖息范围越来越窄, 迫使其基因组在复制传递过程中造成更多的变异, 增加其遗传多样性, 以缓解生存压力。
本研究中获得17对多态性微卫星标记的平均等位基因数为3.47, 与吴旭东等[27]利用12对大口鲇微卫星标记进行兰州鲇个体遗传结构分析所得平均等位基因数7.92相比较小。蒋鹏等[28]研究表明等位基因的数目反映了该位点在进化过程中积累的遗传变异程度, 等位基因数越多说明进化历程这个位点突变越活跃, 物种在自然选择中发展的取向越大, 对生活环境的适应潜能越大。这一结果说明不同的微卫星标记位点, 检测到的等位基因数目不同, 代表的遗传信息量也有所差异。本次筛选到的17对多态性微卫星位点在兰州鲇进化过程中积累的遗传变异程度较小, 在进化历程中这些位点突变较活跃。
多态信息含量(PIC)是衡量微卫星多态性的重要指标[3]。Bacon, et al.[29]研究发现, 微卫星的多态性(或变异性)与其长度有关, 不完美型微卫星的变异性应比完美型低。本次检测17对多态性微卫星位点中, 7对完美型平均多态信息含量为0.6613, 2对不完美型平均多态信息含量为0.4623, 8对混合型平均多态信息含量为0.4313, 三种类型的多态信息含量平均值差异极显著(P<0.01), 完美型多态信息含量显著的高于不完美型和混合型。这一结果说明兰州鲇完美型微卫星标记比不完美型微卫星标记多态性高,与郑燕等[30]在水稻(Oryza sativa)、拟南芥(Arabidopsis thaliana)的研究结果一致。但是研究发现在大多数植物上五核苷酸重复完整型的多态性略低于不完整型, 表现出独有特殊性[34]。在水产动物是否也存在这种现象, 有待深入研究。
兰州鲇是名贵黄河鱼类, 具有较高的经济价值, 人工驯养已取得成功, 推广应用前景广阔。本研究构建了兰州鲇基因组微卫星文库, 获得了大量可利用的微卫星序列。随机设计的30对微卫星引物中17对在兰州鲇中具有多态性, 多态性引物占 56.7%, 观测杂合度为 0.0972—0.7326, 期望杂合度为 0.1862—0.8483, 说明微卫星文库构建较好, 可为下一步进行兰州鲇种质资源保护、遗传图谱构建、标记辅助育种提供大量候选微卫星标记, 并将为兰州鲇种系评估、经济性状的QTL定位等研究奠定基础。
致谢:
中国科学院院士、中国科学院水生生物研究所研究员桂建芳老师对本课题试验研究给予指导和帮助, 在此表示诚挚的谢意。
[1] Wu X D, Zhang Q, Zhao H X, et al. A new species of cat-fish in Ningxia——Silurus lanzhouensis and it’s intensive morphological description [J]. Freshwater Fisheries, 2006, 36(3): 26—29 [吴旭东, 张奇, 赵红雪, 等. 宁夏鲇属鱼类一新纪录种——兰州鲇形态学特征描述. 淡水渔业, 2006, 36(3): 26—29]
[2] Wang S, Yue P Q, Chen Y Y. The Red Book of China Endangered Animals (Fish) [M]. Beijing: Science Press. 1998 [汪松, 乐佩琦, 陈宜瑜. 中国濒危动物红皮书(鱼类). 北京: 科学出版社. 1998]
[3] Schlotterer C, Tautz D. Slippage synthesis of simple sequence DNA [J]. Nucleic Acids Research, 1992, 20: 211—215
[4] Zane L, Bargelloni L, Pataruello T. Strategies for microsatellites isolation: a review [J]. Molecular Ecology, 2002, 11: 1—16
[5] Weber J L. Informativeness of human (dC-dA)n (dG-dT)n polymorphisms [J]. Genomics, 1990, 7: 524—530
[6] Wu X, Yan M J, Li Z J. Genetic structure of mandarin fish Siniperca chuatsi in different geographic populations along, the middle and lower reaches of Yangtze River basin [J]. Acta Hydrobiologica Sinica, 2010, 34(4): 843—849 [吴旭,严美姣, 李钟杰. 长江中下游不同地理种群鳜遗传结构研究. 水生生物学报, 2010, 34(4): 843—849]
[7] Jiang S K, Huang C, Zhang X J, et al. Development of a Highly Informative Microsatellite (SSR) marker framework for rice (Oryza sativa L.) genotypin [J]. Agricultural Sciences in China, 2010, 9(12): 1697—1704
[8] Shao Y, Wang J W, He Y F, et al. The application of microsatellite markers on genetic quality control of an inbred strain of Gobiocypris rarus [J]. Acta Hydrobiologica Sinica, 2009, 33(4): 649—655 [邵燕, 王剑伟, 何勇凤, 等. 稀有鲫近交系微卫星多态性分析. 水生生物学报, 2009, 33(4): 649—655]
[9] Postlethwait J H, Johnson S, Midson C N, et al. A Genetic Linkage Map for the Zebra fish [J]. Science, 1994, 264(29): 699—703
[10] Guo Y U, Cheng B S, Hong D L. Construction of SSR linkage map and analysis of QTLs for rolled leaf in japoniea rice (Oryza sativa) [J]. Rice Science, 2010, 17(1): 28—34
[11] Shi L N, Zhang Q, Wu X D, et al. Individual fertility of the Silurus lanzhouensis [J]. Journal of Gansu Agricultural University, 2008, 43(1): 67—70 [史丽娜, 张奇, 吴旭东,等. 兰州鲇个体繁殖力的研究. 甘肃农业大学学报, 2008, 43(1): 67—70
[12] Yang Y H, He Y L, Zhou J S, et al. Quality evaluation of the meat of Silurus lanzhouensis, Silurus asotus and Cyrinus carpio [J]. Acta Hydrobiologica Sinica, 2013, 30(1): 54—61 [杨元昊, 贺玉良, 周继术, 等. 兰州鲇与鲇、黄河鲤肌肉品质比较. 水生生物学报, 2013, 30(1): 54—61]
[13] Wu X D, Lian Z Q, Hou Y X, et al. Effects of arsenic on activities of the metabolic enzymes contents of RNA and protein in several tissues of Silurus lanzhouensis [J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1078—1083 [吴旭东,连总强, 侯玉霞, 等. 砷对兰州鲇组织中代谢酶活性及RNA和蛋白质含量影响, 水生生物学报, 2013, 37(6): 1078—1083]
[14] Linda C, Luke R, Dan M, et al. Computational and experimental characterization of physically clustered simple sequence repeats in plants [J]. Genetics, 2000, 156(2): 847—854
[15] Bronw J, Hardwick L J, Wright A F. A simple method for rapid isolation of microsatellites from yeast artificial chromosomes [J]. Molecular and Cellular Probes, 1995, 9: 53—58
[16] Kruglyak S, Durrett R, Schug M D, et al. Distribution and abundance of microsatellites in the yeast genome can be explained by a balance between slippage events and point motations [J]. Molecular Biology and Evolution, 2000, 17: 1210—1219
[17] Li Q F, Zhao X B, Luo X L, et al. Construction and identification on enriched microsatellite library from yak genome [J]. Acta Genetica Sinica, 2004, 31(5): 489—494 [李齐发, 赵兴波, 罗晓林, 等. 牦牛基因组微卫星富集文库的构建与分析. 遗传学报, 2004, 31(5): 489—494]
[18] Barker J H A, Pachlich A, Trybush S, et al. Microsatellite markers for diverse Salix species [J]. Molecular Ecology Notes, 2003, 3: 4—6
[19] Lu C Y, Sun X W, Liang L Q. Isolation of microsatellite marks in bighead carp Aristichthys nobilis [J]. Journal of Fishery Sciences of China, 2005, 12(2): 192—196 [鲁翠云,孙效文, 梁利群. 鳙鱼微卫星分子标记筛选. 中国水产科学, 2005, 12(2): 192—196]
[20] Liu Z, Lu S Q, Zhang J S, et al. Isolation and characterization of microsatellites in Pseudobagrus fulvidraco [J]. Journal of Agricultural Biotechnology, 2008, 16(4): 604—609 [刘臻, 鲁双庆, 张建设, 等. 黄颡鱼微卫星标记筛选及特征分析. 农业生物技术学报, 2008, 16(4): 604—609]
[21] Lu C Y, Sun X W, Cao J, et al. Microsatellite enrichment by magnetic beads in silver carp (Hypophthalmichtys molitrix) [J]. Journal of Agricultural Biotechnology, 2005, 13(6): 772—776 [鲁翠云, 孙效文, 曹洁, 等. 磁珠富集法筛选白鲢的微卫星分子标记. 农业生物技术学报, 2005, 13(6): 772—776]
[22] Tong G X, Lu C Y, Kuang Y Y, et al. Construction and identification on enriched microsatellite library from Huchotaimen Pallas genome [J]. Journal of Fishery Sciences of China, 2006, 13(2): 181—186 [佟广香, 鲁翠云, 匡友谊,等. 哲罗鱼基因组微卫星富集文库的构建与分析. 中国水产科学, 2006, 13(2): 181—186]
[23] Hao J, Sun X W, Liang L Q, et al. Enrichment of large yellow croaker genome microsatellite markers using magnet beads [J]. Journal of Fishery Sciences of China, 2006, 13(5): 762—766 [郝君, 孙效文, 梁利群, 等. 大黄鱼微卫星标记的富集与筛选. 中国水产科学, 2006, 13(5): 762—766]
[24] Santibanez K M, Gangeswaran R, Hancock J M. A relationship between lengths of microsatellite and nearby substitution rates in mammalian genomes [J]. Molecular Biology and Evolution, 2001, 18: 2119—2123
[25] Novacek M J, Marshall L G. Early biogeographic history of ostariophysan fishes [J]. Copeia, 1976, 23(1): 1—12
[26] Chen X L. A review of the Chinese Siluridae [J]. Acta Hydrobiologica Sinica, 1977, 6(2): 197—216 [ 粦陈湘 . 我国鲇科鱼类的总述. 水生生物学报, 1977, 6(2): 197—216]
[27] Wu X D, Lian Z Q, Hou Y X, et al. Application analysis of microsatellite markers from Silurus meriaionalis on three species of siluriormes [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 638—645 [吴旭东, 连总强, 侯玉霞, 等. 大口鲇微卫星标记在三个鲇形目鱼类种群间适用性研究. 水生生物学报, 2011, 35(4): 638—645]
[28] Jiang P, Yin H B, Zhang Y, et al. Analysis of parentage between male Pelteobagrus fulvidraco and guarded fertilized eggs [J]. Acta Zoologica Sinica, 2008, 54(5): 798—804 [蒋鹏, 尹洪滨, 张研, 等. 雄性普通黄颡鱼与所保护受精卵间的亲缘关系分析. 动物学报, 2008, 54(5): 798—804]
[29] Bacon A L, Farrington S M, Dunlop M G. Sequence interruptions confer differential stability at microsatellite alleles in mismatch repair-deficient cells [J]. Human Molecular Genetics, 2000, 9(18): 2707—2713
[30] Zheng Y, Jin G L, Wu W R, et al. Relationship between sequence completeness and polymorphism of microsatellite [J]. Genomics and Applied Biology, 2012, 31(6): 587—591 [郑燕, 金谷雷, 吴为人, 等. 微卫星序列完整性与多态性的关系, 基因组学与应用生物学, 2012, 31(6): 587—591]
MICROSATELLITE ENRICHMENT BY MAGNETIC BEADS IN SILURUS LANZHOUENSIS
WEI Da-Wei1,2,3, LIAN Zong-Qiang1,2,3, WU Xu-Dong1,2,3, WANG Fa-Xin1,3, XIAO-Wei2,3
and ZHANG Li-Ping1
(1. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China; 2. Ningxia Fisheries Research Institute, Yinchuan 750001; 3. Ningxia Engineering Research Center for Fisheries, Yinchuan 750001, China)
兰州鲇; 微卫星标记; 磁珠富集; 筛选及特征
Silurus lanzhouensis; Microsatellites; Magnetic bead enriched; Isolation and characterization
Q173
A
1000-3207(2014)04-0791-06
10.7541/2014.110
2014-02-25;
2014-04-19
国家自然科学基金项目(31360633); 国家科技支撑计划项目(2012BAD25B09)资助
魏大为(1989—), 男, 甘肃通渭人; 硕士研究生; 主要从事动物遗传与生物技术研究。E-mail: weidaweiwdw@163.com
吴旭东(1967—), 男, 博士, 研究员; 主要从事水生动物分子生物学及种质资源保护与增养殖研究。E-mail: amy95@126.com

